
La fotoquímica es la rama de la química que estudia los efectos químicos de la luz. Generalmente, este término se utiliza para describir una reacción química causada por la absorción de radiación ultravioleta ( longitud de onda de 100 a 400 nm ), visible (400–750 nm) o infrarroja (750–2500 nm). [1]
En la naturaleza, la fotoquímica es de inmensa importancia ya que es la base de la fotosíntesis, la visión y la formación de vitamina D con la luz solar. [2] También es responsable de la aparición de mutaciones del ADN que conducen a cánceres de piel. [3]
Las reacciones fotoquímicas se desarrollan de manera diferente a las reacciones impulsadas por la temperatura. Las vías fotoquímicas acceden a intermediarios de alta energía que no se pueden generar térmicamente, superando así grandes barreras de activación en un corto período de tiempo y permitiendo reacciones que de otro modo serían inaccesibles mediante procesos térmicos. La fotoquímica también puede ser destructiva, como lo ilustra la fotodegradación de los plásticos.
La fotoexcitación es el primer paso en un proceso fotoquímico donde el reactivo se eleva a un estado de mayor energía, un estado excitado . La primera ley de la fotoquímica, conocida como la ley de Grotthuss-Draper (por los químicos Theodor Grotthuss y John W. Draper ), establece que la luz debe ser absorbida por una sustancia química para que tenga lugar una reacción fotoquímica . Según la segunda ley de la fotoquímica, conocida como la ley de Stark-Einstein (por los físicos Johannes Stark y Albert Einstein ), por cada fotón de luz absorbido por un sistema químico, no se activa más de una molécula para una reacción fotoquímica, según lo definido por el rendimiento cuántico . [4] [5]
Cuando una molécula o átomo en el estado fundamental (S 0 ) absorbe luz, un electrón se excita a un nivel orbital superior. Este electrón mantiene su espín de acuerdo con la regla de selección de espín; otras transiciones violarían la ley de conservación del momento angular . La excitación a un estado singlete superior puede ser de HOMO a LUMO o a un orbital superior, de modo que son posibles los estados de excitación singlete S 1 , S 2 , S 3 ... a diferentes energías.
La regla de Kasha estipula que los estados singlete superiores se relajarían rápidamente mediante desintegración sin radiación o conversión interna (CI) a S 1 . Por lo tanto, S 1 suele ser, pero no siempre, el único estado excitado singlete relevante. Este estado excitado S 1 puede relajarse aún más a S 0 mediante CI, pero también mediante una transición radiativa permitida de S 1 a S 0 que emite un fotón; este proceso se denomina fluorescencia .
Alternativamente, es posible que el estado excitado S 1 experimente una inversión de espín y genere un estado excitado triplete T 1 que tenga dos electrones desapareados con el mismo espín. Esta violación de la regla de selección de espín es posible mediante el cruce entre sistemas (ISC) de los niveles vibracionales y electrónicos de S 1 y T 1 . Según la regla de multiplicidad máxima de Hund , este estado T 1 sería algo más estable que S 1 .
Este estado triplete puede relajarse al estado fundamental S 0 mediante ISC sin radiación o mediante una vía de radiación llamada fosforescencia . Este proceso implica un cambio de espín electrónico, que está prohibido por las reglas de selección de espín, lo que hace que la fosforescencia (de T 1 a S 0 ) sea mucho más lenta que la fluorescencia (de S 1 a S 0 ). Por lo tanto, los estados triplete generalmente tienen vidas medias más largas que los estados singlete. Estas transiciones suelen resumirse en un diagrama de energía de estado o diagrama de Jablonski , el paradigma de la fotoquímica molecular.
Estas especies excitadas, ya sean S 1 o T 1 , tienen un orbital de baja energía semivacío y, en consecuencia, son más oxidantes que el estado fundamental. Pero, al mismo tiempo, tienen un electrón en un orbital de alta energía y, por lo tanto, son más reductoras . En general, las especies excitadas son propensas a participar en procesos de transferencia de electrones. [6]

Las reacciones fotoquímicas requieren una fuente de luz que emita longitudes de onda correspondientes a una transición electrónica en el reactivo. En los primeros experimentos (y en la vida cotidiana), la luz solar era la fuente de luz, aunque es policromática. [7] Las lámparas de vapor de mercurio son más comunes en el laboratorio. Las lámparas de vapor de mercurio de baja presión emiten principalmente a 254 nm. Para fuentes policromáticas, los rangos de longitud de onda se pueden seleccionar utilizando filtros. Alternativamente, los rayos láser suelen ser monocromáticos (aunque se pueden obtener dos o más longitudes de onda utilizando óptica no lineal ), y los LED tienen una banda relativamente estrecha que se puede utilizar de manera eficiente, así como las lámparas Rayonet, para obtener rayos aproximadamente monocromáticos.

La luz emitida debe alcanzar el grupo funcional objetivo sin ser bloqueada por el reactor, el medio u otros grupos funcionales presentes. Para muchas aplicaciones, se utiliza cuarzo para los reactores, así como para contener la lámpara. El Pyrex absorbe en longitudes de onda inferiores a 275 nm. El disolvente es un parámetro experimental importante. Los disolventes son reactivos potenciales y, por este motivo, se evitan los disolventes clorados porque el enlace C-Cl puede provocar la cloración del sustrato. Los disolventes con una fuerte absorción impiden que los fotones lleguen al sustrato. Los disolventes de hidrocarburos absorben solo en longitudes de onda cortas y, por lo tanto, se prefieren para experimentos fotoquímicos que requieren fotones de alta energía. Los disolventes que contienen insaturación absorben en longitudes de onda más largas y pueden filtrar de forma útil las longitudes de onda cortas. Por ejemplo, el ciclohexano y la acetona "cortan" (absorben fuertemente) en longitudes de onda inferiores a 215 y 330 nm, respectivamente.
Por lo general, la longitud de onda empleada para inducir un proceso fotoquímico se selecciona en función del espectro de absorción de las especies reactivas, que suele ser el máximo de absorción. Sin embargo, en los últimos años [ ¿cuándo? ] se ha demostrado que, en la mayoría de las reacciones de formación de enlaces, el espectro de absorción no permite seleccionar la longitud de onda óptima para lograr el mayor rendimiento de reacción en función de la absortividad. Este desajuste fundamental entre la absortividad y la reactividad se ha dilucidado con los denominados gráficos de acción fotoquímica . [8] [9]
La fotoquímica de flujo continuo ofrece múltiples ventajas sobre la fotoquímica por lotes. Las reacciones fotoquímicas son impulsadas por la cantidad de fotones que pueden activar las moléculas que provocan la reacción deseada. La gran relación entre área superficial y volumen de un microrreactor maximiza la iluminación y, al mismo tiempo, permite un enfriamiento eficiente, lo que disminuye los productos secundarios térmicos. [10]
En el caso de las reacciones fotoquímicas, la luz proporciona la energía de activación . En términos simples, la luz es un mecanismo para proporcionar la energía de activación necesaria para muchas reacciones. Si se emplea luz láser , es posible excitar selectivamente una molécula para producir un estado electrónico y vibracional deseado. [11] De igual modo, la emisión de un estado particular puede ser monitoreada selectivamente, proporcionando una medida de la población de ese estado. Si el sistema químico está a baja presión, esto permite a los científicos observar la distribución de energía de los productos de una reacción química antes de que las diferencias en energía hayan sido difuminadas y promediadas por colisiones repetidas.
La absorción de un fotón por una molécula reactiva también puede permitir que se produzca una reacción no solo al llevar la molécula a la energía de activación necesaria, sino también al cambiar la simetría de la configuración electrónica de la molécula, lo que permite una ruta de reacción que de otro modo sería inaccesible, como se describe en las reglas de selección de Woodward-Hoffmann . Una reacción de cicloadición [2+2] es un ejemplo de una reacción pericíclica que se puede analizar utilizando estas reglas o mediante la teoría de orbitales moleculares fronterizos relacionada .
Algunas reacciones fotoquímicas son varios órdenes de magnitud más rápidas que las reacciones térmicas; a menudo se observan reacciones tan rápidas como 10−9 segundos y procesos asociados tan rápidos como 10−15 segundos .
El fotón puede ser absorbido directamente por el reactivo o por un fotosensibilizador , que absorbe el fotón y transfiere la energía al reactivo. El proceso opuesto, cuando un estado fotoexcitado es desactivado por un reactivo químico, se denomina extinción .
La mayoría de las transformaciones fotoquímicas se producen mediante una serie de pasos simples conocidos como procesos fotoquímicos primarios. Un ejemplo común de estos procesos es la transferencia de protones en estado excitado.
Ejemplos de reacciones orgánicas fotoquímicas son las reacciones electrocíclicas , las reacciones radicalarias , la fotoisomerización y las reacciones de Norrish . [20] [21]
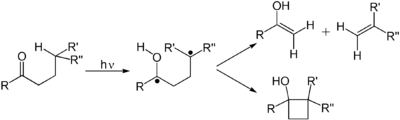
Los alquenos experimentan muchas reacciones importantes que se producen a través de una transición de π a π* inducida por fotones. El primer estado electrónico excitado de un alqueno carece del enlace π , de modo que la rotación alrededor del enlace C–C es rápida y la molécula participa en reacciones que no se observan térmicamente. Estas reacciones incluyen la isomerización cis-trans y la cicloadición a otro alqueno (estado fundamental) para dar derivados de ciclobutano . La isomerización cis-trans de un (poli)alqueno está involucrada en el retinal , un componente de la maquinaria de la visión . La dimerización de los alquenos es relevante para el fotodaño del ADN , donde se observan dímeros de timina al iluminar el ADN con radiación UV. Dichos dímeros interfieren con la transcripción . Los efectos beneficiosos de la luz solar están asociados con la reacción de retrociclación (deciclación) inducida fotoquímicamente del ergosterol para dar vitamina D. En la reacción de DeMayo , un alqueno reacciona con una 1,3-dicetona y reacciona a través de su enol para producir una 1,5-dicetona. Otra reacción fotoquímica común es la transposición del di-π-metano de Howard Zimmerman .
En una aplicación industrial, se preparan anualmente alrededor de 100.000 toneladas de cloruro de bencilo mediante la reacción fotoquímica en fase gaseosa del tolueno con cloro . [22] La luz es absorbida por las moléculas de cloro; la baja energía de esta transición se indica por el color amarillento del gas. El fotón induce la homólisis del enlace Cl-Cl y el radical de cloro resultante convierte el tolueno en el radical bencilo:
Los mercaptanos se pueden producir mediante la adición fotoquímica de sulfuro de hidrógeno (H 2 S) a alfa olefinas .
Los complejos de coordinación y los compuestos organometálicos también son fotorreactivos. Estas reacciones pueden implicar isomerización cis-trans. Más comúnmente, las fotorreacciones resultan en la disociación de ligandos, ya que el fotón excita un electrón en el metal a un orbital que es antienlazante con respecto a los ligandos. Por lo tanto, los carbonilos metálicos que resisten la sustitución térmica experimentan descarbonilación al ser irradiados con luz UV. La irradiación UV de una solución de hexacarbonilo de molibdeno en THF da el complejo de THF, que es útil sintéticamente:
En una reacción relacionada, la fotólisis del pentacarbonilo de hierro produce nonacarbonilo de dihierro (ver figura):
Algunos complejos de coordinación fotorreactivos pueden sufrir procesos de oxidación-reducción mediante la transferencia de un solo electrón. Esta transferencia de electrones puede ocurrir dentro de la esfera de coordinación interna o externa del metal. [23]
A continuación se muestran algunos tipos diferentes de reacciones fotoquímicas:
Aunque el blanqueo se practica desde hace mucho tiempo, la primera reacción fotoquímica fue descrita por Trommsdorff en 1834. [24] Observó que los cristales del compuesto α-santonina, al ser expuestos a la luz solar, se volvían amarillos y estallaban. En un estudio de 2007, la reacción se describió como una sucesión de tres pasos que se desarrollaban dentro de un único cristal. [25]
El primer paso es una reacción de reordenamiento a un intermedio de ciclopentadienona ( 2 ), el segundo una dimerización en una reacción de Diels–Alder ( 3 ), y el tercero una cicloadición intramolecular [2+2] ( 4 ). El efecto de estallido se atribuye a un gran cambio en el volumen del cristal en la dimerización.
La organización de estas conferencias es facilitada por la Fundación Internacional de Fotoquímica. [26]