La marcha parkinsoniana (o marcha festinante , del latín festinare [apresurarse]) es el tipo de marcha que presentan los pacientes con enfermedad de Parkinson (EP). [2] Las personas con Parkinson suelen describirla como una sensación de estar atascado en el lugar al iniciar un paso o un giro, y puede aumentar el riesgo de caídas. [3] Este trastorno está causado por una deficiencia de dopamina en el circuito de los ganglios basales que conduce a déficits motores . La marcha es una de las características motoras más afectadas de este trastorno, aunque los síntomas de la enfermedad de Parkinson son variados.
La marcha parkinsoniana se caracteriza por pasos pequeños y arrastrados y una lentitud general de movimiento ( hipocinesia ), o incluso la pérdida total de movimiento ( acinesia ) en casos extremos. [4] [5] [6] Los pacientes con EP muestran una longitud de zancada reducida , velocidad de marcha durante la deambulación libre y tasa de cadencia , mientras que aumenta la duración del doble apoyo. [7] [8] [9] [10] El paciente tiene dificultad para comenzar, pero también tiene dificultad para detenerse después de comenzar. Esto se debe a la hipertonía muscular. [11]

Los pacientes con enfermedad de Parkinson presentan características de marcha que son marcadamente diferentes de la marcha normal. Si bien la lista de características anormales de la marcha que se presenta a continuación es la más comentada, ciertamente no es exhaustiva.
Mientras que en la marcha normal, el talón toca el suelo antes que los dedos (también llamado marcha de talón a punta), en la marcha parkinsoniana, el movimiento se caracteriza por un golpe de pie plano (donde todo el pie se coloca en el suelo al mismo tiempo) [12] o con menor frecuencia y en las etapas más avanzadas de la enfermedad por una marcha de punta a talón (donde los dedos tocan el suelo antes que el talón). Además, los pacientes con EP tienen una elevación reducida del pie durante la fase de balanceo de la marcha, lo que produce una menor distancia entre los dedos y el suelo. [13]
Los pacientes con enfermedad de Parkinson tienen un impacto reducido en el impacto del talón y se ha descubierto que este mecanismo está relacionado con la gravedad de la enfermedad, ya que el impacto disminuye a medida que progresa la enfermedad. Además, los pacientes con Parkinson muestran una tendencia hacia cargas relativas más altas en las regiones del antepié combinadas con un cambio de carga hacia las áreas mediales del pie. Se cree que este cambio de carga ayuda a compensar el desequilibrio postural . Se ha descubierto que la variabilidad intraindividual en el patrón de impacto del pie es sorprendentemente menor en los pacientes con EP en comparación con las personas normales. [14]
En la marcha normal, la gráfica de la fuerza de reacción vertical sobre el suelo (GRF) tiene dos picos: uno cuando el pie golpea el suelo y el segundo pico es causado por la fuerza de empuje desde el suelo. La forma de la señal de GRF vertical es anormal en la EP. [15] [16] En las primeras etapas de la enfermedad, se encuentran fuerzas reducidas (o alturas de pico) para el contacto del talón y la fase de empuje que se asemeja a la de los sujetos de edad avanzada. En las etapas más avanzadas del trastorno, donde la marcha se caracteriza por pequeños pasos arrastrados, los pacientes con EP muestran solo un pico estrecho en la señal de GRF vertical. [ cita requerida ]
Las caídas y el bloqueo de la marcha son dos fenómenos episódicos que son comunes en la marcha parkinsoniana. En general, se cree que las caídas y el bloqueo de la marcha en la EP están estrechamente relacionados por varias razones, la más importante de las cuales es que ambos síntomas son comunes en las etapas avanzadas de la enfermedad y son menos comunes en las etapas iniciales, y el bloqueo de la marcha conduce a caídas en muchos casos. Ambos síntomas a menudo responden mal y, a veces, de manera paradójica al tratamiento con medicación dopaminérgica, lo que quizás indique una fisiopatología subyacente común . [17] Es posible demostrar una respuesta pobre y paradójica a la medicación dopaminérgica a través de un paradigma de desafío en el que la marcha se evalúa después de la retirada de la medicación y en el estado de medicación ON completa. [18]
Bloqueo de la marcha : el bloqueo de la marcha (FOG) es típicamente un episodio transitorio, que dura menos de un minuto, en el que la marcha se detiene y el paciente se queja de que sus pies están pegados al suelo. Cuando el paciente supera el bloqueo, puede caminar con relativa fluidez. La fisiopatología del fenómeno es poco conocida, pero es probable que se extienda a lo largo de una red funcional-anatómica diseminada. [19] Lamentablemente, los tratamientos actuales para el FOG ofrecen solo beneficios limitados, pero se están explorando activamente una variedad de enfoques novedosos, [20] y se está pensando en cómo coordinar mejor las futuras estrategias de investigación. [21]
La forma más común de FOG es la "vacilación al iniciar" (que ocurre cuando el paciente quiere comenzar a caminar), seguida en frecuencia por la "vacilación al girar" [22] [23] La FOG también se puede experimentar en espacios estrechos o estrechos, como una puerta, al ajustar los pasos para llegar a un destino, y en situaciones estresantes, como cuando suena el teléfono o el timbre o cuando se abre la puerta del ascensor. A medida que progresa la enfermedad, la FOG puede aparecer espontáneamente incluso en un espacio abierto de la pista. [17] Está demostrado que las intervenciones psicológicas pueden ayudar a reducir el efecto negativo de los factores psicosociales, como la ansiedad o la depresión, que pueden empeorar el bloqueo de la marcha o el temblor en pacientes con Parkinson. [24] En base a eso, cada paciente podría beneficiarse de la intervención psicológica, no solo para reducir la ansiedad, la depresión, el dolor y el insomnio, sino también para reducir el efecto de los factores psicosociales en el empeoramiento de los síntomas motores.
Caídas : Las caídas, como la FOG, son raras en las primeras etapas del trastorno y se vuelven más frecuentes a medida que la enfermedad progresa. Las caídas se producen principalmente debido a cambios repentinos en la postura, en particular movimientos de giro del tronco o intentos de realizar más de una actividad simultáneamente mientras se camina o se mantiene el equilibrio. Las caídas también son comunes durante los traslados, como levantarse de una silla o de la cama. Los pacientes con EP se caen principalmente hacia adelante (45% de todas las caídas) y alrededor del 20% se caen lateralmente. [17] Las caídas que ocurren con frecuencia muy temprano en el curso de la enfermedad pueden significar que se debe considerar otro diagnóstico (como parálisis supranuclear progresiva). [25]
La inestabilidad postural en posición erguida es común en la EP terminal y compromete la capacidad de mantener el equilibrio durante las tareas cotidianas, como caminar , girar y levantarse de una posición sentada . La incapacidad de equilibrar adecuadamente el centro de masa del cuerpo sobre la base de apoyo combinada con la inflexibilidad en los movimientos corporales (debido al aumento de la rigidez) hace que los pacientes con EP avanzada se caigan. Mientras que el balanceo postural en posición normal generalmente aumenta en pacientes con trastornos del equilibrio derivados de un accidente cerebrovascular , traumatismo craneoencefálico y ataxia cerebelosa , a menudo se reduce en pacientes con EP. La razón de esto es que en la EP el problema parece ser una falta de flexibilidad para cambiar las respuestas posturales. Esta inflexibilidad aumenta la tendencia a caer en estos pacientes. [26] [27]
Los estudios electromiográficos (EMG) de los músculos de las piernas en pacientes con EP han mostrado una reducción extrema en la activación del músculo tibial anterior en la fase inicial de apoyo y en las fases inicial y tardía de balanceo, y una reducción en el estallido del músculo tríceps sural en el impulso. Por otro lado, los músculos cuádriceps y los isquiotibiales muestran una activación prolongada en la fase de apoyo de la marcha. [28] Esto implica que los pacientes con EP tienen una mayor rigidez pasiva de las articulaciones del tobillo, muestran una mayor actividad EMG de fondo y una mayor co-contracción de los músculos de las piernas en apoyo. Las articulaciones más rígidas conducen a un balanceo postural anormal en los pacientes con EP. [29] [30]
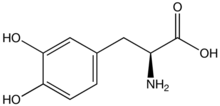
La forma de tratamiento más utilizada es la L-dopa en diversas formas. La L-dopa es capaz de atravesar la barrera hematoencefálica como profármaco y se descarboxila en el cerebro para formar el neurotransmisor dopamina mediante la enzima L-aminoácido aromático descarboxilasa. De esta manera, la L-dopa puede reemplazar parte del déficit de dopamina que se observa en el parkinsonismo. Debido a la inhibición por retroalimentación, la L-dopa produce una reducción en la formación endógena de L-dopa, por lo que finalmente se vuelve contraproducente.
Efecto sobre los parámetros de la marcha : la longitud de la zancada y los parámetros cinemáticos (velocidad de balanceo, velocidad pico) relacionados con la energía son sensibles a la dopa. Los parámetros temporales (duración de la zancada y del balanceo, variabilidad de la duración de la zancada), relacionados con el ritmo, son resistentes a la dopa. [31]
Efecto sobre las caídas y el bloqueo de la marcha : el tratamiento con levodopa disminuye la frecuencia y el tipo acinético de FOG, con una tendencia a episodios de FOG más cortos. Los resultados indican que esto se debe principalmente a que la L-dopa aumenta el umbral para que se produzca FOG, pero la fisiopatología fundamental de la FOG no cambió. [32] También se ha demostrado que otros agonistas de la dopamina como ropinirol , pramipexol y pergolida que tienen una fuerte afinidad por los receptores D2 (a diferencia de la L-dopa que tiene una fuerte afinidad por el receptor D1 ) aumentan la frecuencia de FOG. [33]
Efectos sobre el desequilibrio postural : la enfermedad de Parkinson presenta un desequilibrio postural anormal en la postura y el tratamiento con levodopa aumenta las anomalías del desequilibrio postural. [34] Durante el movimiento, se ha demostrado que las alteraciones posturales autonómicas tempranas solo se corrigen parcialmente, mientras que las correcciones posturales que ocurren más tarde no se ven afectadas por la dopamina. Estos resultados indican que las lesiones no dopaminérgicasdesempeñan un papel en el desequilibrio postural en pacientes con EP. [35]

La disfunción de los ganglios basales en la EP hace que dejen de actuar como señal interna para la marcha en los pacientes con Parkinson. Por ello, se han desarrollado diversas señales sensoriales externas, como las auditivas y visuales, para eludir las funciones de señalización de los ganglios basales.
Señales visuales : Las señales visuales son comúnmente líneas transversales o varillas en el piso (marcadores de piso). Se ha demostrado que estas señales mejoran la longitud y la velocidad de la zancada en la marcha parkinsoniana al sustituir la retroalimentación cinestésica por la retroalimentación visual para regular la amplitud del movimiento. [36] Además, se ha demostrado que el inicio de la marcha mejora significativamente en pacientes con EP en comparación con las señales auditivas. [37] Se ha informado que las señales visuales administradas por "bastones láser" mejoran el inicio de la marcha. [38] También se han desarrollado recientemente gafas de realidad virtual para ayudar a caminar a los pacientes con EP. [39]
Señales auditivas : Las señales auditivas son comúnmenteseñales rítmicas generadas por un metrónomo o equivalente, a veces incrustadas en la música, ajustadas a la cadencia habitual del sujeto o ligeramente por encima de ella. Las señales auditivas rítmicas se han asociado con aumentos en la velocidad y la cadencia y, a veces, la zancada después de que se haya iniciado la marcha. Se ha demostrado que las señales auditivas tienen poco o ningún efecto en el inicio de la marcha. [37] Además, existen algoritmos de predicción para respaldar una señalización auditiva más eficiente. [40] Estos algoritmos predicen episodios de congelamiento para que se pueda iniciar una señalización.

Se ha demostrado que la estimulación cerebral profunda (ECP) en el núcleo pedunculopontino , una parte del tronco encefálico involucrada en la planificación motora , [41] mejora la función de la marcha en pacientes con enfermedad de Parkinson. [42]
También se ha demostrado que la estimulación cerebral profunda en el núcleo subtalámico (STN) y el globo pálido tiene efectos positivos en las anomalías de la marcha que presentan los pacientes con enfermedad de Parkinson. Se ha informado que la estimulación cerebral profunda en el STN reduce significativamente el bloqueo de la marcha en el seguimiento de 1 y 2 años. [43] Se han informado resultados contradictorios sobre los efectos de la estimulación cerebral profunda en la estabilidad postural [34] [44] Los resultados parecen ser altamente específicos de la ubicación. Los estudios que informan efectos positivos sugieren que la eficacia de la estimulación cerebral profunda para mejorar la estabilidad postural se debe a su capacidad para afectar las vías no dopaminérgicas (además de las vías dopaminérgicas) que se cree que causan el balanceo postural en pacientes con EP. [34] Varios estudios sugieren que la estimulación del STN con frecuencias bajas (60–80 Hz) alivia mejor los déficits de la marcha que con las frecuencias altas comúnmente utilizadas (>130 Hz). [45]
Estrategias de atención : Al prestar más atención conscientemente al caminar y ensayar cada paso antes de darlo realmente, los pacientes con EP han demostrado mejorar su marcha. A veces, un acompañante que camina junto al paciente le recuerda que se concentre en la marcha o crea una señal visual para pasar por encima colocando un pie delante de la persona con EP sobre el que debe pasar. Esto hace que el paciente centre su atención en la acción de dar un paso, lo que hace que esta sea una acción voluntaria y, por lo tanto, evita la vía defectuosa de los ganglios basales (que es responsable de acciones involuntarias como caminar). También se ha demostrado que evitar tareas duales que requieren atención motora o atención cognitiva normaliza la marcha en los pacientes con EP. [46] [47]
Ejercicio : Se ha demostrado que la fisioterapia y el ejercicio tienen efectos positivos sobre los parámetros de la marcha en pacientes con EP. [48]
Los fisioterapeutas pueden ayudar a mejorar la marcha creando programas de entrenamiento para alargar la longitud de la zancada del paciente, ampliar la base de apoyo, mejorar el patrón de marcha de talón-punta , enderezar la postura del paciente y aumentar los patrones de balanceo de los brazos. [49]
Las investigaciones han demostrado que el entrenamiento de la marcha que combina un arnés de arriba con caminar en una cinta de correr ha demostrado mejorar tanto la velocidad de la marcha como la longitud de la zancada. [50] El arnés ayuda al paciente a mantener una postura erguida al eliminar la necesidad de utilizar un dispositivo de ayuda para la movilidad , una práctica que normalmente promueve una postura flexionada hacia adelante. [49] Se cree que la activación del generador de patrón central conduce a la mejora del patrón de marcha. [49]
La mejora de la flexibilidad del tronco, junto con el fortalecimiento de los músculos centrales y de las extremidades inferiores, se ha asociado con un mayor equilibrio y una mejora en el patrón de marcha. [51] Los ejercicios aeróbicos como el ciclismo en tándem y los aeróbicos acuáticos también son cruciales para mejorar la fuerza y el equilibrio general. [51] Debido a la naturaleza progresiva de la EP, es importante mantener una rutina de ejercicios para mantener sus beneficios. [51]
Estrategias como el uso de un bastón para caminar vertical también pueden ayudar a mejorar la alineación postural erguida. El terapeuta también puede utilizar baldosas o huellas en el suelo para mejorar la colocación de los pies y ampliar la base de apoyo del paciente. [49] La visualización creativa de la marcha con un patrón de marcha más normalizado y el ensayo mental del movimiento deseado también han demostrado ser eficaces. [51]
El paciente también debe ser desafiado a caminar sobre una variedad de superficies, como baldosas, alfombras, césped o superficies de espuma, lo que también beneficiará el progreso del individuo hacia la normalización de su patrón de marcha. [49]
La encefalopatía arteriosclerótica subcortical (EAS), también llamada parkinsonismo de la parte inferior del cuerpo, y la ataxia cerebelosa son otros dos trastornos de la marcha cuyos síntomas parecen asemejarse mucho a los del Parkinson. Sin embargo, mediante estudios de análisis de regresión se ha revelado que en el Parkinson, el aumento de la velocidad de la marcha cambia la longitud de la zancada de forma lineal (que se asemeja a la de los controles). Sin embargo, en la EAS y la ataxia cerebelosa, la longitud de la zancada tuvo una contribución desproporcionada al aumento de la velocidad, lo que indica que la EAS y la ataxia cerebelosa tienen mecanismos subyacentes comunes diferentes de los del Parkinson. [43]
Los problemas de movilidad asociados con las caídas y el congelamiento de la marcha tienen un impacto devastador en las vidas de los pacientes con EP. El miedo a caer en sí mismo puede tener un efecto incapacitante en los pacientes con EP y puede resultar en aislamiento social dejando a los pacientes en gran medida aislados, lo que lleva a la depresión . La inmovilidad también puede conducir a la osteoporosis , que a su vez facilita el desarrollo de futuras fracturas. Esto luego se convierte en un círculo vicioso en el que las caídas conducen a la inmovilidad y la inmovilidad facilita futuras caídas. Las fracturas de cadera por caídas son la forma más común de fractura entre los pacientes con EP. Las fracturas aumentan los costos de tratamiento asociados con los gastos de atención médica en la EP. [17] Además, cuando la marcha se ve afectada, a menudo anuncia la aparición de la demencia por cuerpos de Lewy . [52] [53] [54]