La hipocinesia es una de las clasificaciones de los trastornos del movimiento , y se refiere a la disminución del movimiento corporal. [1] La hipocinesia se caracteriza por una pérdida parcial o completa del movimiento muscular debido a una alteración en los ganglios basales . [ cita necesaria ] La hipocinesia es un síntoma de la enfermedad de Parkinson que se muestra como rigidez muscular e incapacidad para producir movimiento. También se asocia con trastornos de salud mental e inactividad prolongada debido a enfermedades, entre otras enfermedades.
La otra categoría de trastorno del movimiento es la hipercinesia que presenta una exageración de movimientos no deseados, como espasmos o contorsiones en la enfermedad de Huntington o el síndrome de Tourette . [2]
La hipocinesia describe una variedad de trastornos más específicos:

La causa más común de hipocinesia es la enfermedad de Parkinson y las afecciones relacionadas con la enfermedad de Parkinson.
Otras condiciones también pueden causar lentitud de movimientos. Estos incluyen hipotiroidismo y depresión severa. Estas condiciones deben descartarse cuidadosamente antes de realizar un diagnóstico de parkinsonismo.
El resto de este artículo describe la hipocinesia asociada con la enfermedad de Parkinson y las condiciones relacionadas con la enfermedad de Parkinson.
dopamina
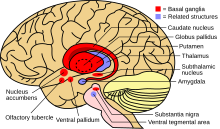
El principal neurotransmisor que se cree que participa en la hipocinesia es la dopamina . [11] [12] Esencial para el bucle talamocortical ganglionar basal, que procesa la función motora, el agotamiento de dopamina es común en estas áreas de pacientes hipoquinésicos. [12] La bradicinesia se correlaciona con el agotamiento dopaminérgico lateralizado en la sustancia negra . [12] La vía de la dopamina en la sustancia negra es esencial para la función motora y comúnmente una lesión en esta área se correlaciona con hipocinesia manifestada. [12] [13] Sin embargo, el temblor y la rigidez parecen deberse sólo parcialmente a déficits de dopamina en la sustancia negra, lo que sugiere que otros procesos están involucrados en el control motor. [12] Los tratamientos para la hipocinesia a menudo intentan prevenir la degradación de la dopamina por la MAO-B o aumentar la cantidad de neurotransmisor presente en el sistema. [12] [13]
GABA y glutamato
El neurotransmisor inhibidor GABA y el glutamato excitador se encuentran en muchas partes del sistema nervioso central , incluidas las vías motoras que implican hipocinesia. En una vía, el glutamato en la sustancia negra excita la liberación de GABA en el tálamo, que luego inhibe la liberación de glutamato en la corteza y, por lo tanto, reduce la actividad motora. Si inicialmente hay demasiado glutamato en la sustancia negra, a través de la interacción con GABA en el tálamo y el glutamato en la corteza, los movimientos se reducirán o no se producirán en absoluto. [14]
Otra vía directa desde los ganglios basales envía mensajes inhibidores de GABA al globo pálido y a la sustancia negra, que luego envían GABA al tálamo. En la vía indirecta, los ganglios basales envían GABA al globo pálido que luego lo envía al núcleo subtalámico, que luego desinhibido envía glutamato a las estructuras de salida de los ganglios basales. La inhibición de la liberación de GABA podría alterar el circuito de retroalimentación de los ganglios basales y producir movimientos hipoquinésicos. [15]
El GABA y el glutamato a menudo interactúan entre sí y directamente con la dopamina. En los ganglios basales, la vía nigroestriatal es donde el GABA y la dopamina se alojan en las mismas neuronas y se liberan juntas. [dieciséis]
Los síntomas hipocinéticos surgen del daño a los ganglios basales, que desempeñan un papel en la producción de fuerza y calculan el esfuerzo necesario para realizar un movimiento. [17] Dos posibles vías neurales permiten que los ganglios basales produzcan movimiento. Cuando se activa, la vía directa envía información sensorial y motora desde la corteza cerebral a la primera estructura de los ganglios basales, el putamen . Esa información inhibe directamente el globo pálido interno y permite el libre movimiento. La vía indirecta, que viaja a través del putamen, el globo pálido externo y el núcleo subtalámico, activa el umbral interno del globo pálido e inhibe la comunicación del tálamo con la corteza motora, lo que produce síntomas hipocinéticos. [17]
Cuando los niveles de dopamina disminuyen, el patrón normal de activación de ondas de las oscilaciones neurales de los ganglios basales cambia y la tendencia a las oscilaciones aumenta, particularmente en la onda beta de los ganglios basales. [18] Investigaciones recientes indican que, cuando las oscilaciones se disparan simultáneamente, el procesamiento se interrumpe en el tálamo y la corteza, lo que afecta actividades como la planificación motora y el aprendizaje de secuencias, además de provocar temblores hipocinéticos. [17]
Los fármacos dopaminérgicos se utilizan habitualmente en las primeras etapas de la hipocinesia para tratar a los pacientes. [13] Sin embargo, con una mayor ingesta, pueden volverse ineficaces debido al desarrollo de lesiones noradrenérgicas . [13] Si bien inicialmente los fármacos dopaminérgicos pueden ser eficaces, estas lesiones noradrenérgicas se asocian con el desarrollo posterior de un trastorno hipoquinésico de la marcha. [12] [13]
Algunos pacientes de Parkinson no pueden moverse durante el sueño, lo que lleva al diagnóstico de "hipocinesia nocturna". Los médicos han tenido éxito en el tratamiento de este trastorno del sueño con fármacos dopaminérgicos de liberación lenta o nocturnos y, en algunos casos, estimulación continua mediante el agonista de la dopamina rotigotina . A pesar de la mejora de la movilidad durante el sueño, muchos pacientes de Parkinson informan de una experiencia de sueño extremadamente incómoda incluso después de tratamientos dopaminérgicos. [19]
Una vez que la reacción a los fármacos dopaminérgicos comienza a fluctuar en los pacientes de Parkinson, la estimulación cerebral profunda (ECP) del núcleo subtalámico y el globo pálido interno se utiliza a menudo para tratar la hipocinesia. [13] [20] [21] La estimulación cerebral profunda, al igual que los fármacos dopaminérgicos, inicialmente proporciona alivio, pero el uso crónico provoca una peor hipocinesia y congelación de la marcha. [13] [22] Se ha demostrado que la ECP de baja frecuencia en patrones irregulares es más efectiva y menos perjudicial en el tratamiento. [21] [22]

La palidotomía posteroventral (PVP) es un tipo específico de ECP que destruye una pequeña parte del globo pálido al cicatrizar el tejido neural, lo que reduce la actividad cerebral y, por lo tanto, los temblores y la rigidez. Se sospecha que la PVP recalibra la actividad de los ganglios basales en la vía talamocortical. Se ha informado que la PVP en el hemisferio dominante altera las capacidades de procesamiento verbal de la función ejecutiva, y la PVP bilateral puede alterar los procesos de atención enfocada. [17]
Muchos pacientes con acinesia también desarrollan una acinesia lingüística en la que su capacidad para producir movimientos verbales refleja sus síntomas de acinesia física, especialmente después de una PVP fallida. [23] Los pacientes generalmente pueden mantener niveles normales de fluidez, pero a menudo se detienen a mitad de la frase, incapaces de recordar o producir la palabra deseada. [23] Según un estudio de pacientes de Parkinson con hipocinesia articulatoria, [24] los sujetos con velocidades de habla más rápidas experimentaron más problemas al tratar de producir lenguaje conversacional que aquellos que normalmente hablaban a velocidades más lentas. [25]
El metilfenidato , comúnmente utilizado para tratar el TDAH, se ha utilizado junto con levodopa para tratar la hipocinesia a corto plazo. [13] Los dos trabajan juntos para aumentar los niveles de dopamina en el cuerpo estriado y la corteza prefrontal . [13] El metilfenidato inhibe principalmente la recaptación de dopamina y noradrenalina al bloquear los transportadores presinápticos, y la levodopa aumenta la cantidad de dopamina, mejorando generalmente la marcha hipoquinésica. [13] [26] Sin embargo, algunos pacientes tienen reacciones adversas como náuseas y dolor de cabeza al tratamiento y aún es necesario evaluar los efectos a largo plazo del tratamiento farmacológico. [13]
Los nuevos tratamientos incluyen aumentar la cantidad de células de dopamina mediante el trasplante de células madre en los ganglios basales o estimulando la producción y el movimiento de células madre endógenas hacia los ganglios basales. [27] La integración exitosa de células madre puede aliviar los síntomas hipocinéticos y disminuir la dosis necesaria de fármacos dopaminérgicos. Sin embargo, son posibles una variedad de complicaciones, incluida la posible formación de tumores, migración celular inapropiada, rechazo de células por parte del sistema inmunológico y hemorragia cerebral , lo que hace que muchos médicos crean que los riesgos superan los posibles beneficios. [28]
Otro tratamiento, aún en etapa experimental, es la administración de antagonistas del receptor del péptido FQ (NOP) de la nocicepción . Se ha demostrado que este tratamiento reduce la hipocinesia en estudios con animales al aumentar la nocicepción FQ en la sustancia negra y el núcleo subtalámico. Se pueden tomar dosis bajas con tratamiento dopaminérgico para disminuir la cantidad de L-dopa necesaria, lo que puede reducir sus efectos secundarios a largo plazo y mejorar el rendimiento motor. [29]
También se ha demostrado que la danzaterapia reduce los movimientos hipoquinésicos y la rigidez, aunque se centra más en los aspectos musculares del trastorno que en la actividad neuronal. [30]
Se ha demostrado que la bradicinesia precede al deterioro de las funciones ejecutivas, la memoria de trabajo y la atención. [11] [31] Estas deficiencias cognitivas pueden estar relacionadas con la falta de función de los ganglios basales y la corteza prefrontal , que también está relacionada con la disfunción motora de la hipocinesia. [11] El temblor y la rigidez no han tenido conexiones observables con los deterioros cognitivos, lo que apoya la idea de que no están tan involucrados en la vía de la dopamina en el circuito ganglionar-talamocortical basal. [11] [12] Los tratamientos dopaminérgicos han mostrado una mejora en las funciones cognitivas asociadas con la hipocinesia, lo que sugiere que también dependen de los niveles de dopamina en el sistema. [31]
A menudo se debate si la eficiencia, el vigor y la velocidad de los movimientos en pacientes con hipocinesia están relacionados con la motivación para recompensar y contra estímulos castigadores. Los ganglios basales se han relacionado con los incentivos detrás del movimiento, lo que sugiere que un análisis de costo/beneficio del movimiento planificado podría verse afectado en la hipocinesia. No se ha demostrado que las recompensas cambien los aspectos del movimiento de un individuo hipoquinésico. [32] De hecho, la planificación y el control motor de un paciente con hipocinesia ya es lo más eficiente posible (como lo demuestra un movimiento ligeramente más rápido, pero generalmente el mismo, después de la estimulación cerebral profunda del núcleo subtalámico ). [33] Esto sugiere que los individuos hipocinéticos simplemente tienen un rango de movimiento más estrecho que no aumenta en relación con la motivación. [32] [34]
Otros estudios han llegado a la misma conclusión sobre las recompensas y la hipocinesia, pero han demostrado que los estímulos aversivos pueden, de hecho, reducir el movimiento hipoquinésico. La dopamina participa menos o tiene un papel más complejo en la respuesta al castigo que a las recompensas, ya que el cuerpo estriado hipodopaminérgico permite más movimiento en respuesta a estímulos aversivos. [35]
Género
Más hombres que mujeres suelen desarrollar hipocinesia, lo que se refleja en poblaciones jóvenes y de mediana edad donde las mujeres han mostrado niveles más altos de dopamina nigroestriatal que los hombres. En los ancianos, sin embargo, esta diferenciación no está presente. Por lo general, las mujeres exhiben más temblores al comienzo del desarrollo de la hipocinesia. En este trastorno, los hombres tienden a mostrar más rigidez y las mujeres un comportamiento motor más bradiquinésico. [36]
Edad de inicio
La hipocinesia se muestra en el cerebro y exteriormente es ligeramente diferente dependiendo de cuándo un individuo se ve afectado por primera vez. En la hipocinesia de inicio joven (antes de los 45 años de edad), normalmente se produce una pérdida de células ligeramente mayor en la sustancia negra con más distonía y rigidez muscular. En la hipocinesia de inicio antiguo (mayores de 70 años), generalmente se observa más marcha hipoquinésica y dificultad para caminar, y no se observa distonía. Ambos inicios pueden mostrar temblor en reposo, aunque se encuentra más generalmente en casos de inicio antiguo. [37]
El estrés provoca alteraciones de la circulación cerebral , aumentando el flujo sanguíneo en la circunvolución supramarginal y angular del lóbulo parietal , el lóbulo frontal y la circunvolución temporal superior del hemisferio izquierdo. Además, se produce un aumento de la actividad cardíaca y un cambio en el tono de los vasos cardíacos, lo que es un indicio elemental del desarrollo del estrés. En pacientes con estrés normal, la activación del sistema nervioso simpático suele desencadenar una respuesta adaptativa de lucha o huida . Los pacientes con hipocinesia experimentan estos síntomas típicos de estrés de forma regular debido al daño en el sistema de ganglios basales. Por lo tanto, cuando una víctima de hipocinesia está bajo estrés, no muestra una respuesta típica de lucha o huida, lo que coloca al paciente en mayor peligro ante estímulos potencialmente dañinos. [38] El ejercicio de bajo impacto, la eliminación del consumo de drogas y alcohol y la meditación regular pueden ayudar a restaurar las respuestas normales al estrés en pacientes con hipocinesia. [39]
Aunque suele estar más asociada con la enfermedad de Parkinson, la hipocinesia puede estar presente en una amplia variedad de otras afecciones.
... el deterioro del equilibrio que compromete la capacidad de mantener o cambiar de postura, como pararse y caminar.
... se observó una mayor discapacidad y más depresión en pacientes con EP con inestabilidad postural predominante y trastorno de la marcha que aquellos que tenían EP con temblor dominante.
Además, no sólo se correlaciona con las caídas sino también con el miedo a caídas futuras, que pueden ser incapacitantes por sí mismas.