Un ion metálico en solución acuosa o ion agua es un catión , disuelto en agua , de fórmula química [M(H 2 O) n ] z+ . El número de solvatación , n , determinado mediante una variedad de métodos experimentales es 4 para Li + y Be 2+ y 6 para la mayoría de los elementos en los períodos 3 y 4 de la tabla periódica . Los iones agua de lantánido y actínido tienen números de solvatación más altos (a menudo de 8 a 9), siendo el más alto conocido 11 para Ac 3+ . La fuerza de los enlaces entre el ion metálico y las moléculas de agua en la capa de solvatación primaria aumenta con la carga eléctrica, z , en el ion metálico y disminuye a medida que aumenta su radio iónico , r . Los iones de agua están sujetos a hidrólisis. El logaritmo de la primera constante de hidrólisis es proporcional a z 2 / r para la mayoría de los iones de agua.
El ion agua está asociado, a través de enlaces de hidrógeno, con otras moléculas de agua en una capa de solvatación secundaria. Las moléculas de agua en la primera capa de hidratación se intercambian con moléculas en la segunda capa de solvatación y moléculas en el líquido a granel. El tiempo de residencia de una molécula en la primera capa varía entre los elementos químicos desde unos 100 picosegundos hasta más de 200 años. Los iones de agua son prominentes en la electroquímica .
La mayoría de los elementos químicos son metálicos . Los compuestos de elementos metálicos suelen formar iones de agua simples con la fórmula [M(H 2 O) n ] z+ en estados de oxidación bajos . Con los estados de oxidación más altos, los iones de agua simples se disocian perdiendo iones de hidrógeno para producir complejos que contienen moléculas de agua e iones de hidróxido u óxido, como las especies de vanadio (IV) [VO(H 2 O) 5 ] 2+ . En los estados de oxidación más altos solo se encuentran los oxianiones , como el ion permanganato (VII), MnO.−
4, son conocidos. No se sabe que algunos elementos metálicos que se encuentran comúnmente sólo en estados de oxidación altos, como el niobio y el tantalio , formen cationes acuáticos; cerca del límite metal-no metal, el arsénico y el telurio sólo se conocen como especies hidrolizadas. Algunos elementos, como el estaño y el antimonio , son claramente metales, pero forman sólo compuestos covalentes en los estados de oxidación más altos: sus cationes acuáticos están restringidos a sus estados de oxidación más bajos. [1] El germanio es un semiconductor más que un metal, pero parece formar un catión acuático; De manera similar, el hidrógeno forma un catión acuático como los metales, a pesar de ser un gas. Las transactínidas han aparecido atenuadas debido a la falta de datos experimentales. Para algunos elementos altamente radiactivos, se ha realizado química experimental y es posible que se hayan formado cationes acuáticos, pero no hay información experimental disponible sobre la estructura de esos supuestos iones acuáticos.


En solución acuosa, se dice que las moléculas de agua directamente unidas al ion metálico pertenecen a la primera esfera de coordinación , también conocida como primera capa de solvatación o primaria. El enlace entre una molécula de agua y el ion metálico es un enlace covalente dativo , en el que el átomo de oxígeno dona ambos electrones al enlace. Cada molécula de agua coordinada puede estar unida mediante enlaces de hidrógeno a otras moléculas de agua. Se dice que estos últimos residen en la segunda esfera de coordinación. La segunda esfera de coordinación no es una entidad bien definida para iones con carga 1 o 2. En soluciones diluidas se fusiona con la estructura del agua en la que existe una red irregular de enlaces de hidrógeno entre las moléculas de agua. [2] En el caso de los iones tripositivos, la alta carga del catión polariza las moléculas de agua en la primera capa de solvatación hasta tal punto que forman enlaces de hidrógeno lo suficientemente fuertes con las moléculas de la segunda capa para formar una entidad más estable. [3]
La fuerza del enlace metal-oxígeno se puede estimar de varias maneras. La entalpía de hidratación, aunque se basa indirectamente en mediciones experimentales, es la medida más fiable. La escala de valores se basa en un cero elegido arbitrariamente, pero esto no influye en las diferencias entre los valores de dos metales. Otras medidas incluyen la frecuencia de vibración M – O y la longitud del enlace M – O. La fuerza del enlace MO tiende a aumentar con la carga y a disminuir a medida que aumenta el tamaño del ion metálico. De hecho, existe una muy buena correlación lineal entre la entalpía de hidratación y la relación entre la carga al cuadrado y el radio iónico, z 2 /r. [4] Para iones en solución, el "radio iónico efectivo" de Shannon es la medida más utilizada. [5]
Las moléculas de agua en la primera y segunda capa de solvatación pueden intercambiar lugares. El tipo de cambio varía enormemente, dependiendo del metal y su estado de oxidación. Los iones de agua metálicos siempre van acompañados en solución de aniones solvatados, pero se sabe mucho menos sobre la solvatación aniónica que sobre la solvatación catiónica. [6]
Se ayuda a comprender la naturaleza de los iones de agua al tener información sobre la naturaleza de los cationes solvatados en solventes mixtos [7] y solventes no acuosos , como amoníaco líquido , metanol , dimetilformamida y dimetilsulfóxido , por mencionar algunos. [8]
Los iones de agua están presentes en la mayoría de las aguas naturales. [9] Na + , K + , Mg 2+ y Ca 2+ son componentes principales del agua de mar .
Muchos otros iones de agua están presentes en el agua de mar en concentraciones que van desde ppm hasta ppt . [9] Las concentraciones de sodio, potasio, magnesio y calcio en la sangre son similares a las del agua de mar. La sangre también tiene concentraciones más bajas de elementos esenciales como el hierro y el zinc. La bebida deportiva está diseñada para ser isotónica y también contiene minerales que se pierden con la transpiración .
Los iones de magnesio y calcio son componentes comunes del agua doméstica y son responsables de la dureza permanente y temporal , respectivamente. A menudo se encuentran en el agua mineral .
La información obtenida sobre la naturaleza de los iones en solución varía según la naturaleza del método experimental utilizado. Algunos métodos revelan propiedades del catión directamente, otros revelan propiedades que dependen tanto del catión como del anión. Algunos métodos proporcionan información de naturaleza estática, una especie de instantánea de las propiedades medias, otros proporcionan información sobre la dinámica de la solución.
Los iones cuya tasa de intercambio de agua es lenta en la escala de tiempo de RMN dan picos separados para las moléculas en la primera capa de solvatación y para otras moléculas de agua. El número de solvatación se obtiene como una proporción de las áreas de los picos. Aquí se refiere al número de moléculas de agua en la primera capa de solvatación. Las moléculas de la segunda capa de solvatación se intercambian rápidamente con las moléculas de disolvente, dando lugar a un pequeño cambio en el valor de desplazamiento químico de las moléculas de agua no coordinadas con respecto al del agua misma. La principal desventaja de este método es que requiere soluciones bastante concentradas, con el riesgo asociado de formación de pares iónicos con el anión.
Una solución que contiene un ion agua no tiene el orden de largo alcance que estaría presente en un cristal que contenga el mismo ion, pero sí tiene un orden de corto alcance. La difracción de rayos X en soluciones produce una función de distribución radial a partir de la cual se puede derivar el número de coordinación del ion metálico y la distancia metal-oxígeno. Con iones agua de alta carga se obtiene cierta información sobre la segunda capa de solvatación. [11] [12]
Esta técnica requiere el uso de soluciones relativamente concentradas. Los electrones dispersan los rayos X, por lo que el poder de dispersión aumenta con el número atómico. Esto hace que los átomos de hidrógeno sean casi invisibles a la dispersión de rayos X.
Se ha utilizado la dispersión de rayos X de gran ángulo para caracterizar la segunda capa de solvatación con iones trivalentes como Cr 3+ y Rh 3+ . Se encontró que la segunda capa de hidratación de Cr 3+ tenía13 ± 1 moléculas a una distancia promedio de402 ± 20 hs . Esto implica que cada molécula en la primera capa de hidratación está unida por enlaces de hidrógeno a dos moléculas en la segunda capa. [13]
La difracción de neutrones también da una función de distribución radial . A diferencia de la difracción de rayos X, los neutrones se dispersan por los núcleos y no existe ninguna relación con el número atómico. [14] De hecho, se puede aprovechar el hecho de que diferentes isótopos del mismo elemento pueden tener poderes de dispersión muy diferentes. En un experimento clásico, se realizaron mediciones en cuatro soluciones de cloruro de níquel utilizando combinaciones de isótopos 58 Ni, 60 Ni, 35 Cl y 37 Cl para producir una imagen muy detallada de la solvatación de cationes y aniones. [15] Los datos de varias sales metálicas muestran cierta dependencia de la concentración de sal.
La mayoría de estos datos se refieren a soluciones concentradas en las que hay muy pocas moléculas de agua que no estén en las esferas de hidratación primaria del catión o anión, lo que puede explicar parte de la variación del número de solvatación con la concentración, incluso si no hay ión de contacto. emparejamiento. El ángulo θ da el ángulo de inclinación de las moléculas de agua con respecto a un plano en el ion agua. Este ángulo se ve afectado por los enlaces de hidrógeno formados entre las moléculas de agua en las capas de solvatación primaria y secundaria.
El número de solvatación medido es un valor promediado en el tiempo para la solución en su conjunto. Cuando un número de solvatación primario medido es fraccionario, hay dos o más especies con números de solvatación integrales presentes en equilibrio entre sí. Esto también se aplica a los números de solvatación que son números enteros, dentro del error experimental. Por ejemplo, el número de solvatación de 5,5 para una solución de cloruro de litio podría interpretarse como debido a la presencia de dos iones de agua diferentes con concentraciones iguales.
Otra posibilidad es que exista interacción entre un catión solvatado y un anión, formando un par iónico . Esto es particularmente relevante cuando las mediciones se realizan en soluciones salinas concentradas. Por ejemplo, un número de solvatación de 3 para una solución de cloruro de litio podría interpretarse como debido al equilibrio
mintiendo totalmente a favor del par iónico.
Los espectros infrarrojos y los espectros Raman se pueden utilizar para medir la frecuencia de estiramiento de MO en iones metálicos acuáticos. La espectroscopia Raman es particularmente útil porque el espectro Raman del agua es débil mientras que el espectro infrarrojo del agua es intenso. La interpretación de las frecuencias de vibración es algo complicada por la presencia, en iones octaédricos y tetraédricos, de dos vibraciones, una simétrica medida en el espectro Raman y otra antisimétrica, medida en el espectro infrarrojo.
Aunque la relación entre la frecuencia de vibración y la constante de fuerza no es simple, la conclusión general que se puede sacar de estos datos es que la fuerza del enlace MO aumenta al aumentar la carga iónica y disminuir el tamaño iónico. La frecuencia de estiramiento de MO de un ion agua en solución se puede comparar con su contraparte en un cristal de estructura conocida. Si las frecuencias son muy similares se puede concluir que el número de coordinación del ion metálico es el mismo en solución que en un compuesto en estado sólido.
Datos como la conductividad , la movilidad eléctrica y la difusión se relacionan con el movimiento de los iones a través de una solución. Cuando un ion se mueve a través de una solución, tiende a llevarse consigo la primera y la segunda capa de solvatación. Por tanto, los números de solvatación medidos a partir de propiedades dinámicas tienden a ser mucho más altos que los obtenidos a partir de propiedades estáticas.

El hidrógeno no es un metal, pero al igual que ellos tiende a perder su electrón de valencia en las reacciones químicas, formando un catión H + . En solución acuosa, esto se adhiere inmediatamente a una molécula de agua, [20] formando una especie generalmente simbolizada como H 3 O + (a veces escrita libremente H + ). Tal hidratación forma cationes que en esencia pueden considerarse como [H(OH 2 ) n ] + . [21]
La solvatación de H + en agua no está completamente caracterizada y se han sugerido muchas estructuras diferentes. Dos estructuras muy conocidas son el catión Zundel y el catión Eigen . La estructura de solvatación propia tiene el ion hidronio en el centro de un H 9 O+4complejo en el que el hidronio está fuertemente unido por enlaces de hidrógeno a tres moléculas de agua vecinas. En el Zundel H 5 O+2complejo: el protón es compartido equitativamente por dos moléculas de agua en un enlace de hidrógeno simétrico . [22] [23] [24] [25] [26]
El catión de litio hidratado en agua es probablemente tetraédrico y tiene cuatro coordenadas. [27] Lo más probable es que haya seis moléculas de agua en la esfera de solvatación primaria del ion sodio octaédrico . [27] [28] El potasio tiene siete coordenadas, y el rubidio y el cesio son probablemente antiprismáticos cuadrados de ocho coordenadas. [27] No se dispone de datos sobre el francio .
El catión berilio [Be(H 2 O) 4 ] 2+ tiene una capa de solvatación primaria muy bien definida con un núcleo tetraédrico de BeO 4 . [29] Para el magnesio , [Mg(H 2 O) 6 ] 2+ también es una especie bien caracterizada, con un núcleo octaédrico de MgO 6 . [29] La situación del calcio es más complicada. Los datos de difracción de neutrones dieron un número de solvatación para el cloruro de calcio, CaCl 2 , que depende en gran medida de la concentración:10,0 ± 0,6 a 1 mol·dm −3 , disminuyendo a6,4 ± 0,3 a 2,8 mol · dm −3 . La entalpía de solvatación disminuye al aumentar el radio iónico. Se conocen varios hidratos sólidos con coordinación 8 en antiprisma cuadrado y geometría dodecaédrica . [30] En el agua, el calcio y el estroncio son muy probablemente antiprismáticos cuadrados de ocho coordenadas (aunque actualmente no se puede excluir la coordinación de siete para el calcio). El bario no está tan bien estudiado: parece tener un número de coordinación de ocho o nueve. La simulación teórica del radio sugiere que su catión acuático tiene diez coordenadas. [27]
El escandio (III) y el itrio (III) tienen ocho coordenadas, pero tienen estructuras diferentes: el escandio tiene una estructura prismática triangular dicada inusual (con una ubicación de tapa vacía), mientras que el itrio es antiprismático cuadrado. El lutecio (III) es un prismático triangular triple, pero tiene un déficit de agua significativo: una de las moléculas de agua que lo cubren está significativamente más cerca del lutecio que las restantes y el número de coordinación promedio es solo 8,2 en lugar de 9. Según su radio iónico, lawrencium (III) es probablemente un prismático triangular tríptico de nueve coordenadas sin déficit de agua. [27]
Los iones de lantánido trivalentes disminuyen constantemente de tamaño desde lantano hasta lutecio , un efecto conocido como contracción de lantánido . [31] Desde el lantano hasta el disprosio , el número de coordinación se mantiene en 9 con una estructura prismática trigonal tricapeada, aunque a partir del samario las moléculas de agua que las cubren ya no están unidas con la misma fuerza. Entonces aparece un déficit de agua desde el holmio hasta el lutecio, con el número de coordinación promedio cayendo a 8,2 en el lutecio (III). La configuración se mantiene a pesar del pequeño tamaño de los cationes y del déficit de agua, probablemente debido a los fuertes enlaces de hidrógeno. [32] El europio (II) tiene siete coordenadas y el cerio (IV) se hidroliza al dímero con puente de oxígeno [(H 2 O) 7 Ce–O–Ce(OH 2 ) 7 ] 6+ . [27]
El actinio (III) tiene once coordenadas en solución acuosa. El torio (IV) es un prismático trigonal tricapé de nueve coordenadas, y se supone que lo mismo ocurre con los otros cationes actínidos (IV) en soluciones acuosas (ya que esa es también su configuración de estado sólido). Los estudios sobre el número y/o la estructura de coordinación de los actínidos (III) hasta la fecha se extienden únicamente al californio . [32] [33] Sin embargo, dado que el lawrencio (III) tiene un radio iónico similar al disprosio (III), es probable que el uranio (III) hasta el lawrencio (III) sean prismáticos triangulares tricados de nueve coordenadas con las posiciones de cobertura completamente. ocupado. [32] [27] No hay datos disponibles para fermio (II), mendelevio (II) o nobelio (II).

Los iones de estos metales en los estados de oxidación +2 y +3 tienen un número de solvatación de 6. Todos tienen una estructura octaédrica regular, excepto los iones agua de cromo (II) y cobre (II), que están sujetos a la distorsión de Jahn-Teller . En el caso del cobre, las dos distancias axiales de Cu-O son 238 pm, mientras que las cuatro distancias ecuatoriales de Cu-O son 195 pm en el estado sólido. [35] Sin embargo, no está claro si Cu 2+ tiene un número de solvatación de 5 o 6 en solución acuosa, con informes experimentales contradictorios. [32] No se ha determinado la estructura del cobalto (III) en solución acuosa. [27] Se estima que el cobre (I) es un tetraédrico de cuatro coordenadas. [27]
Un número de solvatación de 6 con una estructura octaédrica está bien establecido para el zinc (II) y el cadmio (II) en soluciones diluidas. En soluciones concentradas, el ion Zn 2+ puede adoptar una estructura tetraédrica de 4 coordenadas, pero la evidencia no es concluyente debido a la posibilidad de apareamiento iónico y/o hidrólisis. [36] Lo más probable es que el número de solvatación del mercurio (II) sea 6. [37] El zinc (II) es octaédrico de seis coordenadas, pero el cadmio (II) puede estar en equilibrio entre seis y siete coordenadas. Mercurio (II) es un octaedro pseudo-Jahn-Teller distorsionado. [27] La estructura bis agua del ion mercurio(I), [(H 2 O)-Hg-Hg-(OH 2 )] + , que se encuentra en compuestos sólidos, [38] no es la misma que la que se encuentra en solución. que involucra tres moléculas de agua coordinadas a cada mercurio completando una disposición tetraédrica distorsionada. [27] Otra especie acuática en la que existe un enlace metal-metal es la especie de molibdeno (II) formulada como [(H 2 O) 4 Mo≣Mo(H 2 O) 4 ] 4+ . [39] Cada molibdeno está rodeado por cuatro moléculas de agua en una disposición plana cuadrada, en una estructura similar a la de la estructura conocida del complejo de cloro [Mo 2 Cl 8 ] 4− . [40]
Hay algunos iones agua divalentes y trivalentes de metales de transición en la segunda y tercera serie de transición: rutenio (II) y (III), rodio (III) e iridio (III), todos octaédricos. (Las estructuras de rutenio e iridio sólo se han examinado en estado sólido, pero se supone que son iguales en solución acuosa). [27] El molibdeno (III) es cuestionable (y puede hidrolizarse fuertemente en solución acuosa), y el molibdeno (II) se dimeriza y cada molibdeno se une a cuatro moléculas de agua. [27] [32] Originalmente se pensaba que los iones agua de paladio (II) y platino (II) eran planos cuadrados, pero en realidad son piramidales cuadrados u octaédricos fuertemente alargados tetragonalmente con una o dos moléculas de agua adicionales unidas de manera extremadamente débil. [27] La estructura de la plata (I) es controvertida: puede tener dos coordenadas o puede tener cuatro coordenadas con dos moléculas de agua adicionales unidas muy débilmente. [27] El oro (III) es un cuadrado plano de cuatro coordenadas en estado sólido y se supone que tiene la misma estructura en solución acuosa. [27] La distorsión se produce en metales de baja coordinación con fuertes tendencias covalentes debido al efecto Jahn-Teller de segundo orden. Sin embargo, en el estado de oxidación 4, las únicas especies no hidrolizadas son el circonio antiprismático cuadrado (IV), [Zr(H 2 O) 8 ] 4+ , y el hafnio (IV), [Hf(H 2 O) 8 ] 4+ . e incluso ellos son extremadamente propensos a la hidrólisis. [32] Un catión de circonio de este tipo sólo se forma en soluciones diluidas de Zr IV en ácido fuerte y, en la práctica, las especies catiónicas encontradas de circonio y hafnio son polinucleares. [41]
El boro no es un metal y el boro (III) es demasiado ácido para que exista un ion agua: la desprotonación llega hasta el ácido bórico , los boratos y los hidroxiboratos. [42] El ion agua aluminio (III), [Al(H 2 O) 6 ] 3+ está muy bien caracterizado en solución y en estado sólido. El núcleo de AlO 6 tiene simetría octaédrica, grupo de puntos Oh . Los iones agua de galio (III), indio (III) y talio (III) también son octaédricos de seis coordenadas. [27] La geometría de coordinación del talio (I) no se conoce experimentalmente, pero es probable que esté hemidirigida con una gran brecha en la esfera de coordinación. [27]
El silicio tampoco es un metal y el silicio (IV) es un ácido lo suficientemente fuerte como para desprotonar el OH − unido . Así se forman diversas formas de sílice hidratada ( ácido silícico ). [43] Existe cierta evidencia de que se pueden formar iones de agua de germanio (II) en medios de ácido perclórico . [44] Los cálculos de mecánica cuántica sugieren que el ion acuático germanio (II) muestra una distorsión extrema de la primera esfera de coordinación debido a la alta densidad de carga y los pares solitarios estereoquímicamente activos. Se calcula que la primera capa suele tener un número de solvatación de 6, pero también son posibles los números 4 a 7 y la capa se divide en dos con diferentes distancias del Ge 2+ central . [45] Sin embargo, el germanio (II) se oxida fácilmente a germanio (IV), [46] para lo cual solo se esperan especies hidrolizadas. [47] Las especies importantes de germanio (IV) son especies mixtas aniónicas oxo-hidroxo, por lo que muestran un comportamiento intermedio entre el silicio y el estaño: las especies principales parecen ser [GeO(OH) 3 ] − y las octaméricas [Ge 8 O 16 ( OH) 3 ] 3− , donde [GeO 2 (OH) 2 ] 2− ocurre en cantidades más pequeñas. [43] El estaño (II) tiene 3 coordenadas hemidirigidas [48] [49] con una brecha muy grande en la esfera de coordinación del estaño (II). [27] El número de hidratación del plomo (II) no está bien establecido y podría oscilar entre cinco y siete. [27] En la práctica, estos cationes tienden a ser polinucleares. [46] Para el estaño (IV) y el plomo (IV) solo existen especies hidrolizadas. [47]
Se calcula que el arsénico (III) forma especies hidrolizadas únicamente. [47] Se calcula que la especie catiónica estable de arsénico (III) en el agua es [As(OH) 2 ] + , [50] aunque la hidrólisis generalmente continúa hasta llegar a especies neutras y aniónicas. [51] Los iones de agua de antimonio (III) pueden existir en soluciones diluidas de antimonio (III) en ácidos concentrados. [51] [52] Los cálculos de la mecánica cuántica revelan un número de solvatación de 8, con la primera esfera de coordinación dividiéndose en dos hemisferios de hidratación con 4 moléculas de agua cada uno. [53] El bismuto (III) es un antiprismático cuadrado de ocho coordenadas en solución acuosa, aunque en estado sólido es un prismático triangular tricático de nueve coordenadas. [27] Aunque las estructuras del talio (I), germanio (II), estaño (II), plomo (II) y antimonio (III) se ven afectadas por los pares libres, no ocurre lo mismo con el bismuto (III). [32]
El selenio (IV) está presente principalmente como ácido selenoso (H 2 SeO 3 ) por debajo de pH 2; a un pH más alto, esto se desprotona a HSeO 3 − y luego SeO 3 2− . [54] El teluro catiónico (IV) parece ser [Te(OH) 3 ] + ; predomina en soluciones diluidas por debajo de pH 2. Por encima de pH 4, la especie dominante se convierte en TeO(OH) 3 − y por encima de pH 8 se convierte en TeO 2 (OH) 2 2− . [55] El polonio (IV) debería ser similar al teluro (IV), aunque un poco más débil, en su tendencia a la hidrólisis. [56] La estructura del polonio (II) no parece haber sido estudiada.
Los halógenos , al ser fuertemente no metálicos, prefieren formar aniones antes que cationes en solución acuosa. [57] La solvatación de aniones es complicada porque las moléculas de agua apuntan en dirección opuesta: los cationes se unen al átomo de oxígeno del agua, con los hidrógenos mirando hacia afuera, mientras que los aniones prefieren unirse asimétricamente a solo uno de los átomos de hidrógeno en una molécula de agua cercana. Esto da como resultado una importante formación de enlaces de hidrógeno agua-agua y de redes ya dentro de la primera capa de hidratación, en un grado que no ocurre con la solvatación de cationes. Estas interacciones son mayores para los haluros más pesados y grandes; La fuerza del enlace de hidrógeno disminuye a medida que se pasa del yoduro al fluoruro , debido al aumento de la carga negativa en las moléculas de agua, el efecto inductivo creciente que surge de los campos eléctricos más altos y la tensión geométrica cada vez mayor para el enlace de hidrógeno. [58] El astato , raro y extremadamente radiactivo, parece ser más metálico: una especie de astato catiónico (I) se infiere a partir de experimentos a escala de trazas en soluciones ácidas, y a veces se simboliza como At + , pero su estructura no ha sido determinada. [59]
Los gases nobles no reaccionan con el agua, pero su solubilidad en agua aumenta a medida que descienden de grupo. Los átomos de argón en el agua parecen tener una primera capa de hidratación compuesta por 16 ± 2 moléculas de agua a una distancia de 280 a 540 pm, y una segunda capa de hidratación más débil se encuentra a 800 pm. Se han encontrado esferas de hidratación similares para los átomos de criptón y xenón en el agua. [60]
Algunos elementos en estados de oxidación superiores a 3 forman iones oxo acuosos estables. Ejemplos bien conocidos son los iones vanadilo (IV) y uranilo (VI). Pueden verse como productos de hidrólisis particularmente estables en una reacción hipotética como
El vanadio tiene un entorno octaédrico distorsionado ( grupo puntual C 4v ) de un ion óxido y 5 moléculas de agua. [61] El titanilo, TiO 2+ , tiene una estructura similar. [32] Se cree que el vanadio (V) existe como ion dioxo [VO 2 (H 2 O) 4 ] + a un pH inferior a 2, pero la evidencia de este ion depende de la formación de complejos, como los complejos de oxalato. que se ha demostrado que tienen el VO+
2unidad, con enlaces cis -VO, en estado sólido. [62] El ion cromo (IV) [CrO(H 2 O) 5 ] 2+ , similar al ion vanadio, se ha propuesto sobre la base de evidencia indirecta. [63]
El ion uranilo, UO2+
2, tiene una estructura trans . El ion acuático UO2+
2(aq) tiene cinco moléculas de agua en el plano perpendicular al eje OUO en una estructura bipiramidal pentagonal , grupo de puntos D 5h . Neptunilo y plutonilo tienen la misma estructura. No se sabe nada de las estructuras actínidas (V). [27]
El principal objetivo de la termodinámica en este contexto es derivar estimaciones de cantidades termodinámicas de un solo ión, como la entalpía de hidratación y la entropía de hidratación . Estas cantidades se relacionan con la reacción.
La entalpía de esta reacción no se puede medir directamente, porque todas las mediciones utilizan soluciones salinas que contienen tanto cationes como aniones. La mayoría de las mediciones experimentales se relacionan con el calor desprendido cuando una sal se disuelve en agua, lo que da la suma de las entalpías de solvatación de cationes y aniones. Luego, al considerar los datos de diferentes aniones con el mismo catión y diferentes cationes con el mismo anión, se derivan valores de ión único relativos a un cero arbitrario.
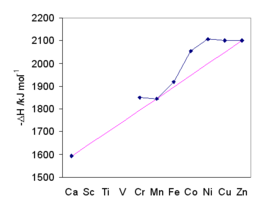
Otros valores incluyen Zn 2+ -2044,3, Cd 2+ -1805,8 y Ag + -475,3 kJ mol −1 .
Existe una excelente correlación lineal entre la entalpía de hidratación y la relación entre la carga al cuadrado, z 2 , y la distancia MO, r eff . [sesenta y cinco]
Los valores de los metales de transición se ven afectados por la estabilización del campo cristalino . La tendencia general se muestra por la línea magenta que pasa por Ca 2+ , Mn 2+ y Zn 2+ , para los cuales no hay estabilización en un campo cristalino octaédrico. La energía de hidratación aumenta a medida que disminuye el tamaño. La división del campo cristalino confiere estabilidad adicional al ion agua. La energía máxima de estabilización del campo cristalino se produce en Ni 2+ . La concordancia de las entalpías de hidratación con las predicciones proporcionó una base para la aceptación general de la teoría del campo cristalino. [66]
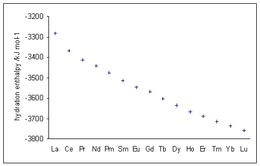
Las entalpías de hidratación de los iones lantánidos trivalentes muestran valores cada vez más negativos a medida que aumenta el número atómico, en línea con la disminución del radio iónico conocida como contracción de los lantánidos .
Se puede derivar la entropía de hidratación de un solo ion. Los valores se muestran en la siguiente tabla. Cuanto más negativo es el valor, más orden hay en la formación del ion agua. Es de destacar que los metales alcalinos pesados tienen valores de entropía bastante pequeños, lo que sugiere que tanto la primera como la segunda capa de solvatación son algo confusas.
Hay dos formas de considerar un equilibrio que implica la hidrólisis de un ion agua. Considerando el equilibrio de disociación
la actividad del producto de la hidrólisis, omitiendo las moléculas de agua, viene dada por
La alternativa es escribir el equilibrio como una reacción de complejación o sustitución.
En ese caso
La concentración de iones de hidrógeno e hidróxido está relacionada por la autoionización del agua , K w = {H + } {OH − } por lo que las dos constantes de equilibrio están relacionadas como
En la práctica, la primera definición es más útil porque las constantes de equilibrio se determinan a partir de mediciones de las concentraciones de iones hidrógeno. En general,
los cargos se omiten en aras de la generalidad y las actividades se han sustituido por concentraciones. son constantes de hidrólisis acumulativa .
El modelado de las reacciones de hidrólisis que ocurren en solución generalmente se basa en la determinación de constantes de equilibrio a partir de datos de titulación potenciométrica (pH). El proceso dista mucho de ser sencillo por diversas razones. [68] A veces, las especies en solución pueden precipitarse como sales y su estructura puede confirmarse mediante cristalografía de rayos X. En otros casos, las sales precipitadas no guardan relación con lo que se postula que están en solución, porque una sustancia cristalina particular puede tener tanto una baja solubilidad como una concentración muy baja en las soluciones.
El logaritmo de la constante de hidrólisis, K 1,-1 , para la eliminación de un protón de un ion agua.
muestra una relación lineal con la relación entre carga y distancia MO, z/d. Los iones se dividen en cuatro grupos. La pendiente de la línea recta es la misma para todos los grupos, pero la intersección, A, es diferente. [69]
Los cationes más resistentes a la hidrólisis por su tamaño y carga son los iones de metales duros previos a la transición o los iones lantánidos. El grupo ligeramente menos resistente incluye los iones de metales de transición. El tercer grupo contiene principalmente iones blandos de metales post-transición. Los iones que muestran mayor tendencia a hidrolizarse por su carga y tamaño son Pd 2+ , Sn 2+ y Hg 2+ . [69] Esto se debe al bajo número de coordinación de los iones en esta parte de la tabla periódica (que también incluye Ag + y Au + ), por lo que hay menos moléculas de agua presentes alrededor del catión y experimentan más fuerza electrostática de lo normal. Una situación similar afecta al Be 2+ , el catión acuático más pequeño, que también es más ácido de lo que normalmente se esperaría. [70]
El cambio de entalpía estándar para el primer paso de hidrólisis generalmente no es muy diferente del de la disociación del agua pura. En consecuencia, el cambio de entalpía estándar para la reacción de sustitución
es cercano a cero. Esto es típico de reacciones entre un catión duro y un anión duro, como el ion hidróxido. [71] Significa que la carga de entropía estándar es el principal contribuyente al cambio de energía libre estándar y, por tanto, a la constante de equilibrio.
El cambio en la carga iónica es responsable del efecto, ya que el ion agua tiene un mayor efecto de ordenamiento en la solución que el complejo hidroxo menos cargado.


La hidrólisis del berilio muestra muchas de las características típicas de reacciones de hidrólisis múltiples. Las concentraciones de diversas especies, incluidas las especies polinucleares con iones de hidróxido puente, cambian en función del pH hasta la precipitación de un hidróxido insoluble. La hidrólisis del berilio es inusual porque la concentración de [Be(H 2 O) 3 (OH)] + es demasiado baja para medirla. En su lugar se forma un trímero ([Be 3 (H 2 O) 6 (OH 3 )) 3+ , cuya estructura ha sido confirmada en sales sólidas. La formación de especies polinucleares está impulsada por la reducción de la densidad de carga dentro de la molécula en su conjunto. El entorno local de los iones de berilio se aproxima a [Be(H 2 O) 2 (OH) 2 ] + . La reducción de la carga efectiva libera energía libre en forma de una disminución de la entropía de orden en los centros de carga. [72]
El producto de hidrólisis del aluminio formulado como [Al 13 O 4 (OH) 24 (H 2 O) 12 ] 7+ está muy bien caracterizado y puede estar presente en la naturaleza en agua a un pH ca. 5.4. [74]
La reacción general por la pérdida de dos protones de un ion agua se puede escribir como
Sin embargo, la constante de equilibrio para la pérdida de dos protones se aplica igualmente al equilibrio
porque se supone que la concentración de agua es constante. Esto se aplica en general: cualquier constante de equilibrio es igualmente válida para un producto con un ion óxido como para un producto con dos iones hidroxilo. Las dos posibilidades sólo pueden distinguirse determinando la estructura de una sal en estado sólido. Los puentes oxo tienden a ocurrir cuando el estado de oxidación del metal es alto. [75] Un ejemplo lo proporciona el complejo de molibdeno (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+ en el que hay un triángulo de átomos de molibdeno unidos por enlaces σ- con un puente de óxido en cada borde de el triángulo y un cuarto óxido que forma un puente con los tres átomos de Mo. [76]
Hay muy pocos iones oxo-agua de metales en estado de oxidación +5 o superior. Más bien, las especies que se encuentran en solución acuosa son oxianiones monoméricos y poliméricos. Los oxianiones pueden considerarse como el producto final de la hidrólisis, en la que no hay moléculas de agua unidas al metal, sólo iones de óxido.
Una molécula de agua en la primera capa de solvatación de un ion agua puede intercambiar lugares con una molécula de agua en el disolvente a granel. Generalmente se supone que el paso determinante de la velocidad es una reacción de disociación .
El símbolo * significa que este es el estado de transición en una reacción química. La velocidad de esta reacción es proporcional a la concentración del ion agua, [A].
La constante de proporcionalidad, k , se denomina constante de velocidad de primer orden a temperatura T. La unidad de velocidad de reacción para el intercambio de agua generalmente se toma como mol dm −3 s −1 .
La vida media de esta reacción es igual a log e 2 / k. Esta cantidad con dimensión de tiempo es útil porque es independiente de la concentración. La cantidad 1/k, también con dimensión de tiempo, igual a la vida media dividida por 0,6932, se conoce como tiempo de residencia o constante de tiempo . [77]
El tiempo de residencia para el intercambio de agua varía desde aproximadamente 10 −10 s para Cs + hasta aproximadamente 10 +10 s (más de 200 y ) para Ir 3+ . Depende de factores como el tamaño y la carga del ion y, en el caso de los iones de metales de transición, los efectos del campo cristalino . Las reacciones muy rápidas y muy lentas son difíciles de estudiar. La mayor parte de la información sobre la cinética de un intercambio de agua proviene de sistemas con un tiempo de residencia entre aproximadamente 1 μs y 1 s. La entalpía y entropía de activación, ΔH ‡ y ΔS ‡ se pueden obtener observando la variación de la velocidad constante con la temperatura.
Obsérvese el aumento general en el tiempo de residencia del vanadio al níquel, que refleja la disminución del tamaño del ion con el aumento del número atómico, que es una tendencia general en la tabla periódica , aunque recibe un nombre específico sólo en el caso de la contracción de los lantánidos . Los efectos de la energía de estabilización del campo cristalino se superponen a la tendencia periódica.
El intercambio de disolventes es generalmente más lento para los iones trivalentes que para los divalentes, ya que la mayor carga eléctrica del catión genera enlaces M-OH 2 más fuertes y, en consecuencia, una mayor energía de activación para el paso de reacción disociativa, [M(H 2 O) n ] 3+ → [M(H 2 O) n-1 ] 3+ + H 2 O. Los valores de la tabla muestran que esto se debe tanto a la entalpía de activación como a los factores de entropía. [79]
El ion [Al(H 2 O) 6 ] 3+ es relativamente inerte a las reacciones de sustitución porque sus electrones están efectivamente en una configuración electrónica de capa cerrada, [Ne]3s 2 3p 6 , lo que hace que la disociación sea una reacción costosa en energía. Cr 3+ , que tiene una estructura octaédrica y configuración electrónica ad 3 , también es relativamente inerte, al igual que Rh 3+ e Ir 3+ que tienen una configuración d 6 de bajo espín .
Los iones de agua metálicos suelen participar en la formación de complejos . La reacción se puede escribir como
En realidad, se trata de una reacción de sustitución en la que una o más moléculas de agua de la primera capa de hidratación del ion metálico son reemplazadas por ligandos, L. El complejo se describe como un complejo de esfera interna. Un complejo como [ML] (pq)+ puede describirse como un par de iones de contacto .
Cuando las moléculas de agua de la segunda capa de hidratación son reemplazadas por ligandos, se dice que el complejo es un complejo de esfera externa o un par iónico compartido por un solvente. La formación de pares iónicos de contacto o compartidos por disolvente es particularmente relevante para la determinación de los números de solvatación de iones de agua mediante métodos que requieren el uso de soluciones concentradas de sales, ya que el emparejamiento iónico depende de la concentración. Considere, por ejemplo, la formación del complejo [MgCl] + en soluciones de MgCl 2 . La constante de formación K del complejo es aproximadamente 1 pero varía con la fuerza iónica. [80] La concentración del complejo bastante débil aumenta desde aproximadamente el 0,1 % para una solución 10 mM hasta aproximadamente el 70 % para una solución 1 M (1 M = 1 mol dm −3 ).
El potencial de electrodo estándar para el equilibrio de media celda M z+ + z e − ⇌ M( s ) se ha medido para todos los metales excepto para los elementos transuránicos más pesados.
Como el potencial del electrodo estándar es más negativo, el ion agua es más difícil de reducir . Por ejemplo, comparando los potenciales del zinc (-0,75 V) con los del hierro (Fe(II) -0,47 V, Fe(III) -0,06 V) se ve que los iones de hierro se reducen más fácilmente que los iones de zinc. Esta es la base para utilizar zinc para brindar protección anódica a grandes estructuras hechas de hierro o para proteger estructuras pequeñas mediante galvanización .