Las enterobacterias resistentes a los carbapenémicos ( CRE ) o enterobacterias productoras de carbapenemasas ( CPE ) son bacterias gramnegativas que son resistentes a los antibióticos de la clase carbapenémica , considerados los medicamentos de último recurso para tales infecciones. Son resistentes porque producen una enzima llamada carbapenemasa que desactiva la molécula del fármaco. La resistencia puede variar de moderada a severa. Las enterobacterias son comensales comunes y agentes infecciosos. Los expertos temen que las CRE sean la nueva " superbacteria ". [1] Las bacterias pueden matar hasta la mitad de los pacientes que contraen infecciones del torrente sanguíneo . [2] Tom Frieden , ex director de los Centros para el Control y la Prevención de Enfermedades, se ha referido a las CRE como "bacterias de pesadilla". [2] [3] Ejemplos de enzimas que se encuentran en ciertos tipos de CRE son KPC ( carbapenemasa de Klebsiella pneumoniae ) y NDM (metalo-beta-lactamasa de Nueva Delhi). La KPC y la NDM son enzimas que degradan los carbapenémicos y los vuelven ineficaces. Ambas enzimas, así como la enzima VIM (metalo-β-lactamasa mediada por integrón de Verona) también se han descrito en Pseudomonas . [4]
Las enterobacterias resistentes a carbapenémicos (ERC) se han definido como Escherichia coli , Enterobacter aerogenes , Enterobacter cloacae complex, Klebsiella pneumoniae o Klebsiella oxytoca no susceptibles a carbapenémicos y resistentes a cefalosporinas de espectro extendido . Algunos excluyen la resistencia a ertapenémicos de la definición. [5]
Los hospitales son los principales sitios de transmisión de infecciones basadas en CRE. Hasta el 75% de las admisiones hospitalarias atribuidas a CRE fueron de centros de atención a largo plazo o transferidas de otro hospital. [6] Las prácticas de mantenimiento subóptimas son la principal causa de transmisión de CRE. Esto incluye la falta de limpieza y desinfección adecuadas de los botiquines, otras superficies en las habitaciones de los pacientes y el equipo médico portátil, como las máquinas de rayos X y ultrasonido que se utilizan tanto para pacientes con CRE como sin CRE. [7] Hasta ahora, las CRE han sido principalmente agentes infecciosos nosocomiales . Casi todas las infecciones por CRE ocurren en personas que reciben atención médica importante en hospitales, centros de atención aguda a largo plazo o residencias de ancianos. [2] Los factores de riesgo independientes para la infección por CRE incluyen el uso de antibióticos betalactámicos y el uso de ventilación mecánica . También se ha demostrado que los pacientes con diabetes tienen un riesgo elevado de contraer infecciones por CRE. [7] En comparación con otros pacientes hospitalizados, los ingresados de centros de atención aguda a largo plazo (LTAC) tienen una incidencia significativamente mayor de colonización y tasas de infección. [8] Otro estudio multicéntrico de 2012 encontró que más del 30% de los pacientes con exposición reciente a LTAC estaban colonizados o infectados con CRE. [9] Una persona susceptible a la transmisión de CRE tiene más probabilidades de ser mujer, tener un mayor número de días de nutrición parenteral (es decir, días en los que la persona recibió nutrición a través del torrente sanguíneo) y haber tenido un número significativo de días respirando a través de un respirador. [7] Las infecciones con Klebsiella pneumoniae resistente a carbapenémicos se asociaron con trasplante de órganos/células madre, ventilación mecánica, exposición a antimicrobianos y, en general, una mayor duración de la estancia en los hospitales. [10] Las personas con más probabilidades de adquirir bacterias resistentes a carbapenémicos son las que ya reciben atención médica. [10] En un estudio realizado en el centro médico Sheba, hubo una tendencia hacia peores puntuaciones de comorbilidad de Charleson en pacientes que adquirieron CRKP durante la estancia en la UCI. [11] Los pacientes que corren mayor riesgo son aquellos que reciben un implante de un órgano o de células madre, que utilizan ventilación mecánica o que deben permanecer en el hospital durante un período prolongado y estar expuestos a antimicrobianos. Un estudio realizado en Singapur sobre la adquisición de enterobacterias resistentes a ertapenem y la adquisición de CRE. [12]Se ha demostrado que la exposición a antibióticos, especialmente fluoroquinolonas, y la hospitalización previa aumentan drásticamente el riesgo de contraer bacterias resistentes a los carbapenémicos. Este estudio encontró que la adquisición de resistencia a los carbapenémicos tiene una tasa de mortalidad significativamente mayor y una respuesta clínica más pobre en comparación con la adquisición de resistencia a ertapenem. [ cita requerida ]
La bacteriuria (también conocida como infección del tracto urinario ) causada por CRKp y CSKp tiene factores de riesgo similares. Estos incluyen el uso previo de antibióticos, el ingreso a una UCI, el uso de un catéter urinario permanente y procedimientos u operaciones invasivas anteriores. Un estudio retrospectivo de pacientes con infección por CRKp y CSKp afirmó que el uso de cefalosporinas (una clase de antibióticos β-lactámicos) utilizadas antes de procedimientos invasivos fue mayor en pacientes con infección por CRKp, lo que sugiere que es un factor de riesgo. [13]
En un estudio de tres años, se demostró que la prevalencia de CRE era proporcional a la duración de la estancia de los pacientes en esos hospitales. También se observaron políticas relativas a la precaución de contacto para pacientes infectados o colonizados por patógenos gramnegativos en los hospitales que informaron de disminuciones en la prevalencia de CRE. [14]
Un estudio de caso demostró que los pacientes con una respuesta inmunitaria comprometida son especialmente susceptibles tanto a la exposición como a la infección por CRE. En un estudio, un paciente de edad avanzada con leucemia linfoblástica aguda que estaba siendo tratado en un centro de cuidados a largo plazo contrajo una infección por CRE. [15] Su edad y condición, combinadas con su entorno y la regulación por un catéter y ventilación mecánica, contribuyeron a una mayor susceptibilidad. Esto resalta la importancia de encontrar la fuente de las bacterias, ya que los miembros de esta clase de pacientes corren un riesgo continuo de infección. [10] El control de infecciones y la prevención de CRE deben ser el enfoque principal en el manejo de pacientes con alto riesgo. [ cita requerida ]
Otro factor de riesgo importante es vivir en un país donde la distribución de antibióticos no está regulada. En países donde los antibióticos se pueden adquirir sin receta médica, la incidencia y prevalencia de infecciones por CRE eran mayores. Un estudio realizado en Japón determinó que el 6,4% de los adultos sanos eran portadores de cepas productoras de ESBL (principalmente cefotaximasas), en comparación con el 58,4% en Tailandia, donde los antibióticos se pueden adquirir sin receta médica. Un grupo de investigación egipcio determinó que el 63,3% de los adultos sanos estaban colonizados. [9]
En febrero de 2015, la FDA informó sobre un riesgo de transmisión cuando las personas se someten a un procedimiento de gastroenterología llamado colangiopancreatografía retrógrada endoscópica , donde un endoscopio ingresa a la boca, pasa por el estómago y termina en el duodeno ; si no se desinfecta por completo, el dispositivo puede transmitir CRE de un paciente a otro. [16] La comunicación de seguridad de la FDA se produjo un día después de que el Sistema de Salud de la UCLA , Los Ángeles, notificara a más de 100 pacientes que podrían haber sido infectados con CRE durante endoscopias entre octubre de 2014 y enero de 2015. [17] La FDA había emitido su primer aviso sobre los dispositivos en 2009. [18]
Debido a que la propagación de la bacteria CRE de los animales a los humanos puede convertirse en un problema en el futuro, se recomienda monitorear la CRE en el ganado, así como en los humanos. [ cita requerida ]
La familia de moléculas antibióticas β-lactámicas consta de cuatro grupos: penicilinas, cefalosporinas, carbapenémicos (como imipenem, ertapenem, meropenem y doripenem) y monobactámicos. [19]
Estos antibióticos comparten una estructura y un mecanismo de acción comunes. Entran en el espacio periplásmico a través de las porinas , donde luego inhiben las transpeptidasas (que también se conocen como proteínas de unión a la penicilina (PBP)), enzimas que facilitan los enlaces cruzados de péptidos durante la síntesis de la pared celular. Su unión al sitio activo de las PBP se facilita en parte por su estructura común, que es similar a la de la D -alanil- D -alanina. La D -alanil- D -alanina es un residuo de la subunidad peptídica NAM involucrada en la construcción de peptidoglicano . [19] El carbapenem se une covalentemente a las PBP, lo que hace que las transpeptidasas pierdan irreversiblemente su actividad catalítica. [19] La inhibición de las transpeptidasas previene la formación de enlaces cruzados entre polímeros de peptidoglicano y causa una acumulación de precursores de peptidoglicano. El peptidoglicano recién formado se debilita por la ausencia de enlaces cruzados. La actividad continua de las autolisinas , que funcionan como lisozimas y rompen los enlaces glucosídicos y peptídicos del peptidoglicano en el periplasma, debilita la pared celular y conduce al estallido osmótico de la célula bacteriana. [ cita requerida ]
Una cualidad única de los carbapenémicos es su resistencia a la hidrólisis por plásmidos bacterianos y β-lactamasas de espectro extendido (ESBL) mediadas por cromosomas. [20]
En general, el carbapenem, un antibiótico β-lactámico , actúa sobre las células inhibiendo las transpeptidasas (proteínas que se unen a la penicilina). Esto impide la síntesis de peptidoglicano , un componente estructural necesario, lo que conduce a la lisis celular. La resistencia al carbapenem entre las enterobacterias y otras bacterias gramnegativas puede adquirirse a través de varios mecanismos.
La Pseudomonas aeruginosa CR está presente con frecuencia en las unidades de cuidados intensivos y puede provocar infecciones peligrosas. [30] En los hospitales tailandeses, de 261 muestras multirresistentes de P. aeruginosa (que no forma parte de las Enterobacteriaceae) recolectadas, el 71,65 % eran resistentes a los carbapenémicos. [30]
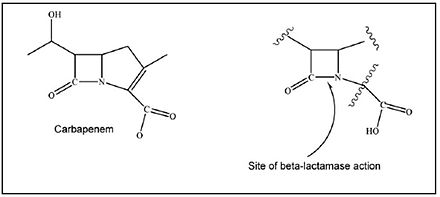
Las bacterias gramnegativas pueden desarrollar y transferir resistencia a las β-lactamasas (incluida la resistencia a los carbapenémicos) de muchas maneras. Pueden generar nuevas β-lactamasas de espectro extendido (ESBL) a partir del espectro existente de β-lactamasas mediadas por plásmidos mediante la sustitución de aminoácidos. Pueden adquirir genes que codifican ESBL de bacterias ambientales. Pueden aumentar la expresión de genes de β-lactamasa codificados por cromosomas ( genes bla ) debido a modificaciones de la secuencia de genes reguladores y promotores. Pueden movilizar genes bla a través de integrones o transferencia horizontal de islas genómicas a otras especies y cepas gramnegativas. [31] [32] Pueden diseminar carbapenemasas mediadas por plásmidos. Finalmente, pueden disminuir o incluso inhibir la expresión de genes de porina. [33]
Tres clases principales de enzimas están involucradas en la resistencia a los carbapenémicos: carbapenemasas de clase A, metalo-β-lactamasas de clase B (MBL) y β-lactamasas de clase D (OXA). Los cuatro grupos conocidos de carbapenemasas de clase A son: SME (tres tipos asociados con S. marcescens ), IMI (presente en E. cloacae ), GES (16 variantes encontradas hasta ahora en P. aeruginosa predominantemente pero también encontradas en K. pneumoniae y E. coli ) y KPC (10 tipos de carbapenemasas de K. pneumoniae ). [33] En el Centro Médico UVA, se descubrió un mecanismo de transferencia de resistencia a carbapenémicos dependiente de KPC en la transmisión de un plásmido que lleva el transposón (Tn4401), que contiene el gen KPC ( bla KPC ), a varias bacterias, incluidas Enterobacter cloacae , Klebsiella oxytoca , E. coli y Citrobacter freundii . [34] Las metalo-β-lactamasas de clase B (MBL) se encuentran principalmente en bacterias gramnegativas y bacterias ambientales. Las subclases de enzimas MBL son B1, B2 y B3. Las MBL tienen diversas funciones enzimáticas y tienen la capacidad de hidrolizar antibióticos β-lactámicos. Las β-lactamasas de clase D (OXA), que hidrolizan oxacilina, proporcionan un buen ejemplo de la variedad de mecanismos que se pueden utilizar para transferir resistencia. Los genes bla OXA que codifican las β-lactamasas OXA se encuentran tanto en cromosomas como en plásmidos, y tienen su reservorio natural en bacterias ambientales y en la microflora de aguas profundas. Se ha demostrado que las inserciones en la proximidad de estos genes aumentan la fuerza de sus promotores y aumentan la resistencia. Debido a estas características, se ha producido una amplia diseminación geográfica de la resistencia a las carbapenemasas OXA en particular. [33]
La propagación facilitada de la resistencia a los carbapenémicos parece tener múltiples orígenes y la introducción repetida en el Reino Unido de bacterias con el gen bla OXA-48 a través de la transferencia horizontal de plásmidos similares a pOXA-48a. Un estudio reciente en el Reino Unido examinó 26 aislamientos de Enterobacteriaceae que consistían en un conjunto diverso de tipos de secuencia (ST) de K. pneumoniae , E. coli y Enterobacter cloacae que producen carbapenemasas similares a OXA-48. [ cita requerida ] Sus hallazgos incluyeron:
Las vesículas de membrana externa (VME), que pueden transferir ADN entre células bacterianas, son producidas por células bacterianas metabólicamente activas y no son el resultado de la lisis celular o la muerte celular. Las cepas patógenas pueden producir alrededor de 10 a 25 veces más vesículas que una cepa no patógena, lo que hace que esto sea muy relevante para la transferencia de resistencia a carbapenémicos. [36] Las VME protegen a los plásmidos de ser digeridos extracelularmente por nucleasas que pueden encontrarse en el medio ambiente, lo que favorece la transferencia horizontal de genes . [36]
Se observan variaciones en los medios utilizados para la inoculación. Muchos estudios utilizan medios con 1 a 2 mg/L de imipenem. Sin embargo, las bacterias que producen OXA-48 u OXA-181 dan lugar a una resistencia de bajo nivel, que no se puede detectar de manera eficiente debido a la alta concentración. [37] Por lo tanto, los medios de detección más recientes utilizan caldo que contiene 0,5–1 mg/L de imipenem o 0,5 mg/L de ertapenem . Las desventajas de este enfoque incluyen el retraso en los resultados de la inoculación y la incapacidad de identificar el tipo de carbapenemasa. [ cita requerida ]
El método de difusión en disco puede ser utilizado por los laboratorios hospitalarios para detectar CRE. En esta técnica, los discos de antibióticos se colocan en placas de agar Mueller Hinton que ya han sido inoculadas con la cepa de muestra. Luego, las placas se incuban durante la noche a 37 °C. Después de la incubación, se miden las zonas de inhibición que rodean los diversos discos de antibióticos y se comparan con las pautas del Clinical and Laboratory Standard Institute. La identificación de KPC, MBL y OXA se puede lograr demostrando la inhibición sinérgica con ácido fenilborónico , EDTA o ninguno, respectivamente. [38]
En un estudio sobre CRE en entornos hospitalarios realizado en Tailandia, la resistencia a los carbapenémicos se definió como cualquier cepa que muestre resistencia a al menos uno de los tres antibióticos carbapenémicos evaluados. [30]
Se están desarrollando metodologías de detección basadas en PCR para varios genes responsables de la resistencia. Estas aceleran la detección y pueden diferenciar fácilmente entre genes de carbapenamasa, a veces en un formato multiplex. Los costos de las pruebas de PCR están disminuyendo y la confiabilidad de las pruebas moleculares se relaciona más con la presencia y la expresión de genes para la producción de la carbapenamasa relevante. La PCR arbitraria anidada (ARB-PCR) se utilizó durante un brote de CRE en 2007 en el Centro Médico de la Universidad de Virginia para identificar el plásmido bla KPC específico involucrado en la transmisión de la infección, y los investigadores sugieren que la ARB-PCR también puede usarse para identificar otros métodos de propagación de CRE. [34]
Otro estudio utilizó espectrometría de masas con desorción láser asistida por matriz y tiempo de vuelo (MALDI-TOF MS) para determinar patrones de resistencia en bacterias de hemocultivos recién positivos. [ cita requerida ] La MALDI-TOF MS puede detectar cambios en las relaciones masa-carga. Las bacterias resistentes a cabapenem a menudo emplean β-lactamasas, que alteran físicamente la estructura de los antibióticos β-lactámicos. Dado que esto provoca un cambio en la masa del antibiótico, las bacterias resistentes son detectables mediante MALDI-TOF MS. Las pruebas clínicas aceptadas a menudo requieren una incubación durante la noche antes de leer el resultado, pero la MALDI-TOF MS puede devolver resultados en solo 4 a 5 horas. [ cita requerida ]
La prueba MALDI-TOF no puede detectar bacterias resistentes, que no alteran físicamente el antibiótico β-lactámico, es decir, donde no se produce ningún cambio de masa. Por lo tanto, el método sirve mejor como una primera prueba de detección para los pacientes ingresados en el hospital, pero debe seguirse con pruebas secundarias. [39]
Los investigadores encontraron reservorios ambientales de bacterias CRE en los lavabos y desagües de la UCI. A pesar de múltiples intentos de esterilizar estos lavabos y desagües, utilizando detergentes y vapor, el personal del hospital no tuvo éxito en deshacerse de las CRE. Debido a la resistencia bacteriana a las medidas de limpieza, el personal debe extremar las precauciones para mantener ambientes estériles en hospitales que aún no estén infectados con bacterias resistentes a las CRE. [40]
Un medio importante de transmisión son los lavabos, por lo que el personal debe tomar precauciones adicionales para mantener las condiciones estériles. Los hospitales podrían reducir la transmisión creando lavabos con diseños que pudieran reducir las salpicaduras. Otro método para reducir la transmisión de un lavabo a otro es tener cepillos para lavabos en cada habitación que se utilizarían únicamente para limpiar ese lavabo individual. El personal del hospital debe recibir capacitación para no desechar nunca desechos clínicos en los lavabos de las habitaciones de los pacientes. Un hospital en Melbourne, Australia, implementó estrategias similares a estas para reducir la transmisión y prevenir una mayor infección de más pacientes de la UCI. Armados con el conocimiento de su condición de sitios de transmisión de CRE, los hospitales deben tener especial cuidado para monitorear los brotes de CRE dentro de sus salas. La detección eficiente y precisa de CRE es el primer paso. Las enterobacterias se encuentran más comúnmente en la flora intestinal. El uso de hisopos de heces y rectales son, por lo tanto, los métodos más confiables para probar la resistencia. [40]
No existe ningún código de facturación para CRE bajo Medicare o Medicaid , lo que dificulta su seguimiento a nivel nacional en los EE. UU. Otro desafío que enfrentan los esfuerzos para controlar la transmisión es el hecho de que, si bien los centros de atención a largo plazo han sido ampliamente señalados como los principales centros de incidencia, amplificación y propagación de CRE, los estudios que han controlado esta transmisión aún han encontrado que CRE se propaga en otros hospitales afiliados, lo que indica que los centros de atención aguda a largo plazo probablemente no sean los únicos culpables de la propagación de CRE y otros organismos resistentes a múltiples fármacos. [7]
Un método que se ha demostrado eficaz es examinar y aislar a los pacientes que llegan de otras instalaciones y renovar el enfoque en el lavado de manos . No se están desarrollando nuevos medicamentos para la bacteria y la rápida adaptación de la bacteria a los nuevos medicamentos hace que la inversión en su desarrollo no sea rentable, ya que el nuevo medicamento se volvería rápidamente inútil. [1] Los estudios han demostrado que la incidencia y la prevalencia de CRE se pueden reducir mediante la aplicación de intervenciones específicas que incluyen mayores medidas de higiene y esterilización de equipos, incluso en poblaciones donde la prevalencia de la infección supera el 50% de los pacientes. [7] Sin embargo, no se ha verificado mediante ensayos controlados que se realice una limpieza ambiental adicional para controlar la transmisión. [41] La participación de las autoridades de salud pública locales y nacionales probablemente será fundamental para garantizar una implementación más amplia y sostenible de estas medidas. [ cita requerida ]
La prevención es una prioridad máxima para reducir la transmisión de CRE de persona a persona. Esto es especialmente cierto porque las opciones de tratamiento disponibles para usar después de que se desarrolla resistencia a los carbapenémicos son limitadas. La mayoría de las investigaciones actuales exigen un enfoque coordinado y multifacético para la prevención y contención de infecciones, y los Centros para el Control y la Prevención de Enfermedades han publicado directrices preliminares para el control de la transmisión de CRE. [42] Los expertos abogan por un enfoque proactivo, basándose en la creencia de que será más rentable combatir el problema antes de que se establezca. Sin embargo, cuando los recursos financieros y de personal inmediatos son limitados, los administradores de atención médica pueden verse obligados a responder de manera reactiva, con el objetivo de reducir cualquier transmisión adicional. [43]
Aunque existe un consenso sobre la necesidad de protocolos de prevención, las prácticas de control de infecciones a menudo varían entre hospitales, incluso dentro de un área geográfica cercana. En una encuesta de 15 hospitales dentro del área de Toronto, muchos hospitales emplearon diferentes combinaciones de prácticas básicas de control de infecciones. Se observaron ocho prácticas diferentes entre los 15 hospitales, algunas de las cuales se incluyeron en la publicación más reciente de pautas de la Agencia de Salud Pública de Canadá . [44] Algunas de estas recomendaciones incluyen pruebas de laboratorio, vigilancia activa, detección (hisopado rectal, cultivo de orina), higiene de manos, equipo de protección personal , limpieza ambiental, gestión de residuos de lavandería y aislamiento con equipo dedicado y personal de enfermería. Sin embargo, solo cinco hospitales tenían políticas escritas que describían cómo responder a un brote. [45] Muchas iniciativas de salud pública están avanzando hacia un enfoque más estandarizado en múltiples niveles: entre las instalaciones locales (especialmente atención a largo plazo y aguda), hospitales regionales, instituciones nacionales y prácticas globales. [ cita requerida ] Un enfoque estandarizado de prevención puede ayudar a reducir de manera más efectiva la aparición de CRE. [ cita requerida ]
En el Centro Médico Kaplan de Israel se puso en marcha un plan de control de infecciones para controlar un brote hospitalario de K. pneumoniae resistente a los carbapenémicos. El plan integral incluía directrices para agrupar a los pacientes en lugares separados, limpiar con hipoclorito de 1000 ppm , detectar aislamientos en hisopos rectales y distribuir hojas de instrucciones educativas, charlas para todo el personal médico y formación. El hospital también puso en marcha un sistema informático automatizado que actualizaba las historias clínicas de los pacientes cuando se notificaban nuevos casos, si los pacientes eran portadores y qué precauciones se debían tomar al tratar con dichos pacientes. Este plan se evaluó en un estudio cuasiexperimental a través de la incidencia de casos clínicos, la tasa de infección cruzada y la tasa de detección de portadores en pacientes ingresados con mayor riesgo de ser portadores. El estudio tuvo una disminución de 16 veces en la incidencia de K. pneumoniae resistente , que se mantuvo durante 30 meses. El plan puede proporcionar un modelo para que otros hospitales contengan brotes de bacterias resistentes a los carbapenémicos. [46] Una reducción en el uso de dispositivos invasivos innecesarios, incluidos los catéteres urinarios, podría ayudar a reducir la transmisión de CRE. [7]
Se han probado varios métodos para determinar su eficacia a la hora de mejorar la higiene ambiental de las unidades de cuidados intensivos. Un estudio realizado en 2010 en 3532 superficies ambientales de alto riesgo en 260 habitaciones de unidades de cuidados intensivos de 27 hospitales de cuidados agudos (UCI) evaluó la consistencia con la que estas superficies cumplían con los estándares de limpieza básicos. Solo el 49,5% de las superficies de objetos de alto riesgo cumplían con este criterio básico. Los objetos menos limpiados fueron los interruptores de luz del baño, los pomos de las puertas de las habitaciones y los limpiadores de cuñas. Se lograron mejoras significativas en la limpieza de las habitaciones de la UCI mediante un enfoque estructurado que incorporó un método simple y altamente objetivo de selección de superficies y una retroalimentación repetida del desempeño al personal de superficies ambientales. Los métodos específicos incluyeron la implementación de un proceso de evaluación objetivo, la educación del personal de superficies ambientales, la retroalimentación programática y la capacitación continua para minimizar la propagación de infecciones asociadas al hospital. Los autores observaron una mejora en la minuciosidad de la limpieza del 71% desde el inicio para todo el grupo de hospitales involucrados. [47]
Se han probado varios fármacos antimicrobianos para el tratamiento eficaz de la CRE. La fosfomicina es un agente antimicrobiano que actúa inhibiendo la UDP-N-acetilglucosamina enolpiruvil transferasa (MurA), que cataliza uno de los primeros pasos de la síntesis de la pared celular bacteriana, y es eficaz contra bacterias aerobias gramnegativas y grampositivas, como la CRE. Un metaanálisis de 17 estudios que investigaban la eficacia clínica de la fosfomicina en cuatro cepas de enterobacterias resistentes a múltiples fármacos encontró 11 que informaron que más del 90% de los aislamientos bacterianos eran susceptibles a la fosfomicina. [ cita requerida ]
El elevado nivel de actividad antimicrobiana de la fosfomicina se puede atribuir al hecho de que la resistencia a este antibiótico en las enterobacterias está codificada cromosómicamente y no mediada por plásmidos. Esto provoca una disminución de la capacidad de supervivencia de las bacterias. Las bacterias que son naturalmente resistentes a la fosfomicina son menos robustas y menos patógenas. [48]
La tigeciclina , un miembro de los antibióticos glicilciclínicos, ha demostrado ser una terapia eficaz contra las Enterobacteriaceae que típicamente muestran resistencia a la tetraciclina , [49] porque la tigeciclina tiene una mayor afinidad de unión con los sitios ribosómicos que la tetraciclina. [ cita requerida ] La tigeciclina es capaz de matar casi todas las ESBL y los aislamientos de E. coli resistentes a múltiples fármacos (MDR) y la gran mayoría de los aislamientos ESBL y MDR de especies de Klebsiella . [ cita requerida ]
Una revisión de 2008 de 42 estudios de susceptibilidad in vitro de bacterias a la tigeciclina mostró que K. pneumoniae y E. coli resistentes a carbapenémicos , incluidas las resistentes a carbapenémicos, fueron susceptibles más del 90% de las veces. Se ha tratado a un número limitado de pacientes con tigeciclina, pero la FDA la ha aprobado en ciertos casos con sinergias de otros fármacos. El número limitado de pacientes indica que se necesitan más ensayos para determinar la eficacia clínica general. [50]
Aunque la tigeciclina es una de las primeras líneas de defensa contra los aislados productores de carbapenemasas, se han producido resultados clínicos negativos con ella. Tanto las infecciones del tracto urinario como las infecciones sanguíneas primarias pueden hacer que la tigeciclina sea ineficaz, porque tiene una penetración limitada y una difusión tisular rápida después de ser infundida por vía intravenosa, respectivamente. [51]
Las alternativas a la fosfomicina incluyen nitrofurantoína , pivmecilinam y co-amoxiclav en el tratamiento oral de infecciones del tracto urinario asociadas con betalactamasa de espectro extendido. [48]
En un estudio separado, se trató a CRE con colistina , amikacina y tigeciclina, y se enfatiza la importancia de usar gentamicina en pacientes sometidos a procedimientos de quimioterapia o terapia con células madre. [15] Si bien la colistina había mostrado una actividad prometedora contra los aislamientos productores de carbapenemasas, datos más recientes sugieren que ya está surgiendo una resistencia a ella y pronto se volverá ineficaz. [51]
El uso concomitante de otro antibiótico con carbapenem puede ayudar a prevenir el desarrollo de resistencia a carbapenem. Un estudio específico mostró una mayor tasa de resistencia a carbapenem cuando se usa meropenem solo en comparación con la terapia combinada con moxifloxacino . [52]
Además, se probaron varios medicamentos para medir su eficacia contra las infecciones por CRE. Los estudios in vitro han demostrado que la rifampicina tiene actividad sinérgica contra E. coli y K. pneumoniae resistentes a carbapenémicos . Sin embargo, se necesitan más datos para determinar si la rifampicina es eficaz en un entorno clínico. [51]
Se están desarrollando varios agentes nuevos. Las áreas principales en las que se están centrando los científicos son los nuevos inhibidores de la β-lactamasa con actividad contra las carbapenemasas. Algunos de ellos incluyen MK-7655, NXL104 y 6-alquilidenepenam sulfonas. Se desconoce la forma exacta en que afectan a las carbapenemasas. Otro agente experimental con actividad contra CRE es la eravaciclina . [51]
Antes de 1992, las CRE eran relativamente poco comunes en los EE. UU. Según datos del Servicio Nacional de Infecciones Nosocomiales, entre 1986 y 1990, solo el 2,3% de los 1.825 aislamientos de Enterobacteriaceae muestreados resultaron ser resistentes. [10]
Según los Centros para el Control y Prevención de Enfermedades de Estados Unidos, las CRE productoras de lo que era el tipo más común de enzima destructora de carbapenémicos en 2001 se detectaron por primera vez en un hospital de Carolina del Norte en 1996. [53] [54] Desde entonces, se han identificado en centros de atención médica en otros 41 estados. En 2012, el 3% de los pacientes en las UCI del área de Chicago eran portadores de CRE. [1] Los mismos datos [ ¿cuáles? ] indicaron una tasa de colonización del 30% en centros de atención a largo plazo (por ejemplo, hogares de ancianos), donde los pacientes no presentan síntomas . Durante solo la primera mitad de 2012, casi 200 hospitales y centros de atención aguda a largo plazo trataron al menos a un paciente infectado con estas bacterias. [2]
Las CRE se han vuelto cada vez más comunes en los EE. UU. El Programa de Recopilación de Información sobre Pruebas de Susceptibilidad Anuales a Meropenem observó que la resistencia solo en K. pneumoniae aumentó del 0,6 % en 2004 al 5,6 % en 2008. [10] El primer brote que involucró a K. pneumoniae resistente a la colistina y resistente a los carbapenémicos (CRKP) en los EE. UU. se descubrió en Detroit , Michigan, en 2009, y afectó a tres instituciones de atención médica diferentes. [55] En un estudio de vigilancia activa en siete estados de los EE. UU. durante dos años, la incidencia general bruta de CRE fue de 2,93 por 100 000 habitantes. Georgia y Maryland tuvieron una incidencia significativamente mayor que la prevista ajustada por edad y raza. [5]
Los aumentos de CRE no se han limitado a los EE. UU. En 2011, se informó de CRE en al menos 22 países. [10] Entre 2009 y 2012, se documentaron 10 casos de infecciones por CRE en pacientes de la UCI en un hospital de Melbourne, Australia. [40]
Algunos casos de CRE están asociados con la recepción de atención médica en los EE. UU. Las cepas encontradas en Israel tenían similitud genética con las cepas de los EE. UU. [40] Se descubrió que las estaciones de lavado de manos de los hospitales eran reservorios ambientales de CRE después de examinar todas las ubicaciones de áreas húmedas, incluidos lavabos, fuentes de agua y máquinas de hielo. Los principales reservorios de CRE fueron los lavabos de la UCI, y los métodos de limpieza inadecuados explicaron la transmisión de un lavabo a otro. Las cepas de CRE en los lavabos y las cepas que infectaron a los pacientes de la UCI fueron idénticas según el análisis genético. Los pacientes en riesgo se infectaron en el entorno hospitalario. [40]
La resistencia a CRE depende de una serie de factores, como la salud del paciente, si el paciente se ha sometido recientemente a un trasplante, el riesgo de coinfección y el uso de múltiples antibióticos. [56] Los resultados de las concentraciones inhibitorias mínimas (CIM) de carbapenem pueden ser más predictivos de los resultados clínicos del paciente que la clasificación categórica actual de las CIM que se enumeran como susceptibles, intermedias o resistentes. [57] El estudio tuvo como objetivo definir un punto de corte de mortalidad hospitalaria por todas las causas para las CIM de carbapenem que se ajustaron para los factores de riesgo. Otro objetivo fue determinar si existía un punto de corte similar para los resultados indirectos, como el tiempo hasta la muerte y la duración de la estadía después de la infección para los sobrevivientes. Se incluyeron setenta y un pacientes, de los cuales 52 pacientes sobrevivieron y 19 pacientes murieron. El análisis del árbol de clasificación y regresión determinó una división de la CIM del organismo entre 2 y 4 mg/litro y predijo diferencias en la mortalidad (16,1% para 2 mg/litro frente a 76,9% para 4 mg/litro). En la regresión logística que controlaba los factores de confusión, cada dilución de duplicación de la CMI de imipenem duplicaba la probabilidad de muerte. Este esquema de clasificación predijo correctamente el 82,6 % de los casos. En consecuencia, los pacientes se estratificaron en CMI de ≤2 mg/litro (58 pacientes) y ≥4 mg/litro (13 pacientes). Los pacientes del grupo con una CMI de ≥4 mg/litro tendían a estar más enfermos. Los resultados secundarios también fueron similares entre los grupos. Los pacientes con organismos que tenían una CMI de ≥4 mg/litro tuvieron peores resultados que aquellos con aislados de una CMI de ≤2 mg/litro. [57]
En el New York Presbyterian Hospital , parte del Columbia University Medical Center en Nueva York, NY, se realizó un estudio sobre el aumento significativo de la resistencia a los carbapenémicos en K. pneumoniae entre 1999 y 2007. Después de un hemocultivo positivo de un paciente, la mortalidad general fue del 23 % en 7 días, del 42 % en 30 días y del 60 % al final de la hospitalización. La tasa general de mortalidad hospitalaria fue del 48 %. [58]
En el Soroka Medical Center , un hospital universitario israelí, se realizó un estudio entre octubre de 2005 y octubre de 2008 para determinar la tasa de mortalidad directa asociada con infecciones del torrente sanguíneo por K. pneumoniae resistente a carbapenémicos . La tasa bruta de mortalidad para aquellos con bacteriemia resistente fue del 71,9%, y la tasa de mortalidad atribuible se determinó en un 50% con un intervalo de confianza del 95%. La tasa bruta de mortalidad para los sujetos de control fue del 21,9%. Como resultado del estudio, el Soroka Medical Center inició un programa intensivo diseñado para prevenir la propagación de K. pneumoniae resistente a carbapenémicos. [59]
Un estudio retrospectivo de 2013 en el Centro Médico Shaare Zedek de pacientes con infecciones del tracto urinario (bacteriuria) causadas por Klebsiella pneumoniae resistente a carbapenémicos (CRKp) no mostró diferencias estadísticamente significativas en las tasas de mortalidad de los pacientes con bacteriuria causada por K. pneumoniae sensible a carbapenémicos (CSKp). Se observó una tasa de mortalidad del 29% en pacientes con infección por CRKp en comparación con una tasa de mortalidad del 25% en pacientes con infecciones por CSKp que producían betalactamasa de espectro extendido (ESBL). Ambas tasas de mortalidad fueron considerablemente más altas que las de los pacientes con urosepsis sensible a fármacos . [13] La mayoría de los pacientes del estudio tenían otras enfermedades, como demencia , compromiso inmunológico , insuficiencia renal o diabetes mellitus . El principal factor de riesgo de muerte encontrado por el estudio fue estar postrado en cama, lo que aumentó significativamente la probabilidad de muerte. Esto sugiere que las muertes se debieron a razones distintas a la bacteriuria. La duración total de la hospitalización fue algo más larga en los pacientes con infecciones por CRKp (28 ± 33 días en comparación con 22 ± 28 días para los pacientes con infección por CSKp). [13]
En un estudio de casos y controles de 99 pacientes en comparación con 99 controles en el Hospital Mount Sinai (Manhattan) , un hospital universitario de atención terciaria de 1.171 camas, el 38% de los pacientes en cuidados a largo plazo que fueron afectados por CRE murieron a causa de la infección por K. pneumoniae . Los pacientes tenían factores de riesgo que incluían diabetes, infección por VIH, enfermedad cardíaca, enfermedad hepática, enfermedad renal crónica , uno era receptor de trasplante. El 72% de los pacientes que fueron dados de alta del hospital con CRE fueron readmitidos dentro de los 90 días. [60] Un estudio de 2008 en Mount Sinai identificó los resultados asociados con las infecciones por Klebsiella pneumoniae resistente a carbapenémicos , en los que los pacientes que necesitaban trasplantes de órganos o células madre, ventilación mecánica, hospitalización prolongada o tratamiento previo con carbapenémicos, tenían una mayor probabilidad de infección con K. pneumoniae resistente a carbapenémicos . Una combinación de antibióticos funcionó para tratar la infección y las tasas de supervivencia de los pacientes infectados aumentaron cuando se eliminó el foco de infección. [61]
Las infecciones por CRE pueden aparecer aproximadamente 12 días después del trasplante de hígado, y el 18% de esos pacientes murieron un año después del trasplante en un estudio de 2012. [62]
Los estudios han demostrado una viabilidad prolongada de las bacterias en superficies de acero inoxidable a temperatura ambiente. En un estudio específico, se inoculó acero inoxidable con 10 7 UFC/cm 2 de E. coli y K. pneumoniae , que contenían bla CTX-M-15 y bla NDM-1 (genes resistentes a los antibióticos) respectivamente. Treinta días después (a temperatura ambiente, 22˚ C), quedaban 10 4 células viables; y, después de 100 días, quedaban 100 UFC/cm 2 de E. coli . [63]
Por el contrario, en las superficies de cobre y aleaciones de cobre, se puede observar una muerte rápida de las cepas bacterianas resistentes a los antibióticos, así como la destrucción del ADN genómico y plasmídico. Los estudios sugieren que la exposición a superficies de cobre secas inhibe la respiración y el crecimiento de los productores al liberar iones de cobre. [63]
En las superficies de acero inoxidable se observa un aumento de la transferencia horizontal de genes (HGT) simultáneamente con la viabilidad celular. La HGT es uno de los principales factores responsables de la creación de resistencia a los antibióticos en las bacterias. Esto sugiere que la descontaminación inmediata de las superficies es importante para prevenir la propagación de genes de resistencia a los antibióticos. También se ha demostrado que la transferencia horizontal de genes de β-lactamasa resistentes a los antibióticos no se produce en superficies de cobre antimicrobiano. A medida que las superficies de cobre degradan el ADN desnudo (y el ADN plasmídico en E. coli y K. pneumoniae resistentes a los antibióticos ), las superficies de cobre detendrían la HGT. [63]
Se ha demostrado que la transferencia horizontal de genes ocurre fácilmente en superficies secas como el acero inoxidable, pero no en superficies de cobre y aleaciones de cobre. La tasa de muerte bacteriana aumentó proporcionalmente con el porcentaje de cobre en la superficie de la aleación de cobre. Esto puede ser muy importante en futuros entornos clínicos y comunitarios, ya que un aumento en el uso de cobre en el equipo de las habitaciones del hospital podría ayudar a reducir en gran medida la propagación de infecciones resistentes a los antibióticos y la transferencia horizontal de genes de esta resistencia a los antibióticos. [63]
Durante solo la primera mitad de 2012, casi 200 hospitales y centros de cuidados intensivos a largo plazo trataron al menos a un paciente infectado con estas bacterias.
{{cite journal}}: |first5=tiene nombre genérico ( ayuda )