
El retículo endoplásmico ( RE ) es parte del sistema de transporte de la célula eucariota y tiene muchas otras funciones importantes, como el plegamiento de proteínas . Es un tipo de orgánulo formado por dos subunidades: el retículo endoplasmático rugoso ( RER ) y el retículo endoplasmático liso ( SER ). El retículo endoplasmático se encuentra en la mayoría de las células eucariotas y forma una red interconectada de sacos aplanados rodeados de membranas conocidos como cisternas (en el RER) y estructuras tubulares en el SER. Las membranas del RE se continúan con la membrana nuclear externa . El retículo endoplasmático no se encuentra en los glóbulos rojos ni en los espermatozoides .
Los dos tipos de ER comparten muchas de las mismas proteínas y participan en ciertas actividades comunes, como la síntesis de ciertos lípidos y colesterol . Los diferentes tipos de células contienen diferentes proporciones de los dos tipos de ER según las actividades de la célula. El RER se encuentra principalmente hacia el núcleo de la célula y el SER hacia la membrana celular o la membrana plasmática de la célula.
La cara exterior ( citosólica ) del RER está repleta de ribosomas que son los sitios de síntesis de proteínas . El RER es especialmente prominente en células como los hepatocitos . El SER carece de ribosomas y funciona en la síntesis de lípidos pero no en el metabolismo , la producción de hormonas esteroides y la desintoxicación . [1] El SER es especialmente abundante en el hígado y las células de las gónadas de los mamíferos .
El RE fue observado mediante microscopía óptica por Garnier en 1897, quien acuñó el término ergastoplasma . [2] [3] Las membranas de encaje del retículo endoplásmico fueron vistas por primera vez mediante microscopía electrónica en 1945 por Keith R. Porter , Albert Claude y Ernest F. Fullam. [4] Posteriormente, la palabra retículo , que significa "red", fue aplicada por Porter en 1953 para describir este tejido de membranas. [5]
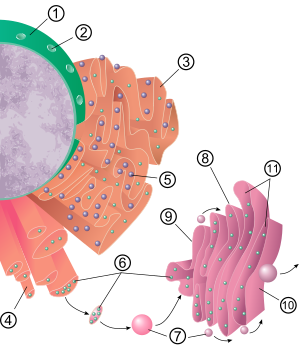

La estructura general del retículo endoplásmico es una red de membranas llamadas cisternas . Estas estructuras en forma de saco se mantienen unidas por el citoesqueleto . La membrana de fosfolípidos encierra el espacio cisternal (o luz), que es continuo con el espacio perinuclear pero separado del citosol . Las funciones del retículo endoplásmico se pueden resumir como la síntesis y exportación de proteínas y lípidos de membrana, pero varían entre el RE y el tipo y función celular. La cantidad de retículo endoplásmico tanto rugoso como liso en una célula puede intercambiar lentamente de un tipo a otro, dependiendo de las cambiantes actividades metabólicas de la célula. La transformación puede incluir la incorporación de nuevas proteínas en la membrana, así como cambios estructurales. Pueden ocurrir cambios en el contenido de proteínas sin cambios estructurales perceptibles. [6] [7]
La superficie del retículo endoplásmico rugoso (a menudo abreviado RER o ER rugoso ; también llamado retículo endoplásmico granular ) está tachonada de ribosomas que fabrican proteínas , lo que le da una apariencia "rugosa" (de ahí su nombre). [8] El sitio de unión del ribosoma en el retículo endoplásmico rugoso es el translocón . [9] Sin embargo, los ribosomas no son una parte estable de la estructura de este orgánulo, ya que están constantemente unidos y liberados de la membrana. Un ribosoma solo se une al RER una vez que se forma un complejo específico de proteína y ácido nucleico en el citosol. Este complejo especial se forma cuando un ribosoma libre comienza a traducir el ARNm de una proteína destinada a la vía secretora . [10] Los primeros 5 a 30 aminoácidos polimerizados codifican un péptido señal , un mensaje molecular que es reconocido y unido por una partícula de reconocimiento de señal (SRP). La traducción se detiene y el complejo ribosomal se une al translocón del RER , donde la traducción continúa con la proteína naciente (nueva) que se forma en la luz y/o la membrana del RER. La proteína es procesada en la luz del RE por una enzima (una peptidasa señal ), que elimina el péptido señal. En este punto, los ribosomas pueden volver a liberarse al citosol; sin embargo, también se sabe que los ribosomas no traducibles permanecen asociados con translocones. [11]
La membrana del retículo endoplásmico rugoso tiene la forma de grandes láminas de doble membrana que se encuentran cerca de la capa exterior de la envoltura nuclear y se continúan con ella . [12] Las láminas de doble membrana se apilan y conectan a través de varias rampas helicoidales a derechas o izquierdas, las "rampas de Terasaki", dando lugar a una estructura que se asemeja a un estacionamiento . [13] [14] Aunque no existe una membrana continua entre el retículo endoplásmico y el aparato de Golgi , las vesículas de transporte unidas a la membrana transportan proteínas entre estos dos compartimentos. [15] Las vesículas están rodeadas por proteínas de recubrimiento llamadas COPI y COPII. COPII dirige las vesículas al aparato de Golgi y COPI las marca para que sean devueltas al retículo endoplásmico rugoso. El retículo endoplasmático rugoso trabaja en conjunto con el complejo de Golgi para dirigir nuevas proteínas a sus destinos adecuados. El segundo método de transporte fuera del retículo endoplásmico involucra áreas llamadas sitios de contacto con la membrana , donde las membranas del retículo endoplásmico y otros orgánulos se mantienen estrechamente unidos, permitiendo la transferencia de lípidos y otras moléculas pequeñas. [16] [17]
El retículo endoplasmático rugoso es clave en múltiples funciones:

En la mayoría de las células el retículo endoplasmático liso (abreviado SER ) es escaso. En cambio, hay áreas donde el RE es en parte liso y en parte rugoso; esta área se llama RE de transición. La sala de emergencias de transición recibe su nombre porque contiene sitios de salida de la sala de emergencias. Estas son áreas donde las vesículas de transporte que contienen lípidos y proteínas producidas en el RE se desprenden del RE y comienzan a moverse hacia el aparato de Golgi . Las células especializadas pueden tener una gran cantidad de retículo endoplasmático liso y en estas células el RE liso tiene muchas funciones. [6] Sintetiza lípidos , fosfolípidos , [19] [20] [21] y esteroides . Las células que secretan estos productos, como las de los testículos , los ovarios y las glándulas sebáceas, tienen abundante retículo endoplasmático liso. [22] También lleva a cabo el metabolismo de los carbohidratos, la desintoxicación de los productos naturales del metabolismo y del alcohol y las drogas, la unión de receptores a las proteínas de la membrana celular y el metabolismo de los esteroides . [23] En las células musculares, regula la concentración de iones de calcio . El retículo endoplasmático liso se encuentra en una variedad de tipos de células (tanto animales como vegetales) y cumple diferentes funciones en cada una. El retículo endoplasmático liso también contiene la enzima glucosa-6-fosfatasa , que convierte la glucosa-6-fosfato en glucosa, un paso en la gluconeogénesis . Está conectado a la envoltura nuclear y consta de túbulos que se encuentran cerca de la periferia celular. Estos tubos a veces se ramifican formando una red de apariencia reticular. [12] En algunas células, hay áreas dilatadas como los sacos del retículo endoplásmico rugoso. La red de retículo endoplásmico liso permite dedicar una mayor superficie a la acción o almacenamiento de enzimas clave y los productos de estas enzimas. [ cita necesaria ]

El retículo sarcoplásmico (SR), del griego σάρξ sarx ("carne"), es un RE liso que se encuentra en las células musculares . La única diferencia estructural entre este orgánulo y el retículo endoplásmico liso es la composición de proteínas que tienen, unidas a sus membranas y a la deriva dentro de los límites de sus luces. Esta diferencia fundamental es indicativa de sus funciones: el retículo endoplásmico sintetiza moléculas, mientras que el retículo sarcoplásmico almacena iones de calcio y los bombea al sarcoplasma cuando se estimula la fibra muscular. [24] [25] Después de su liberación del retículo sarcoplásmico, los iones de calcio interactúan con proteínas contráctiles que utilizan ATP para acortar la fibra muscular. El retículo sarcoplásmico juega un papel importante en el acoplamiento excitación-contracción . [26]
El retículo endoplasmático cumple muchas funciones generales, incluido el plegamiento de moléculas de proteínas en sacos llamados cisternas y el transporte de proteínas sintetizadas en vesículas al aparato de Golgi . El retículo endoplasmático rugoso también participa en la síntesis de proteínas. El plegamiento correcto de proteínas recién creadas es posible gracias a varias proteínas chaperonas del retículo endoplásmico , incluida la proteína disulfuro isomerasa (PDI), ERp29, el miembro de la familia Hsp70 BiP/Grp78 , calnexina , calreticulina y la familia de peptidilprolil isomerasa. Sólo las proteínas plegadas correctamente se transportan desde el RE rugoso al aparato de Golgi; las proteínas desplegadas provocan una respuesta de proteína desplegada como respuesta al estrés en el RE. Las alteraciones en la regulación redox , la regulación del calcio, la privación de glucosa y la infección viral [27] o la sobreexpresión de proteínas [28] pueden conducir a una respuesta al estrés del retículo endoplásmico (estrés ER), un estado en el que el plegamiento de las proteínas se ralentiza, lo que lleva a a un aumento de las proteínas desplegadas . Este estrés está surgiendo como una causa potencial de daño en hipoxia/isquemia, resistencia a la insulina y otros trastornos. [29]
Las proteínas secretoras, principalmente glicoproteínas , se mueven a través de la membrana del retículo endoplásmico. Las proteínas que son transportadas por el retículo endoplásmico a través de la célula están marcadas con una etiqueta de dirección llamada secuencia señal . El extremo N (un extremo) de una cadena polipeptídica (es decir, una proteína) contiene algunos aminoácidos que funcionan como una etiqueta de dirección, que se eliminan cuando el polipéptido llega a su destino. Los péptidos nacientes llegan al RE a través del translocón , un complejo multiproteico integrado en la membrana. Las proteínas que están destinadas a lugares fuera del retículo endoplásmico se empaquetan en vesículas de transporte y se mueven a lo largo del citoesqueleto hacia su destino. En los fibroblastos humanos, el RE siempre está codistribuido con los microtúbulos y la despolimerización de estos últimos provoca su coagregación con las mitocondrias, que también están asociadas con el RE. [30]
El retículo endoplasmático también forma parte de una vía de clasificación de proteínas. Es, en esencia, el sistema de transporte de la célula eucariota. La mayoría de sus proteínas residentes se retienen en su interior mediante un motivo de retención . Este motivo está compuesto por cuatro aminoácidos al final de la secuencia de la proteína. Las secuencias de retención más comunes son KDEL para proteínas ubicadas en la luz y KKXX para proteínas transmembrana. [31] Sin embargo, se producen variaciones de KDEL y KKXX, y otras secuencias también pueden dar lugar a retención del retículo endoplásmico. No se sabe si dicha variación puede conducir a localizaciones sub-ER. Hay tres receptores KDEL ( 1 , 2 y 3 ) en células de mamíferos y tienen un grado muy alto de identidad de secuencia. Las diferencias funcionales entre estos receptores aún están por establecerse. [32]

El retículo endoplasmático no alberga una maquinaria de regeneración de ATP y, por lo tanto, requiere la importación de ATP desde las mitocondrias. El ATP importado es vital para que la sala de emergencias lleve a cabo sus funciones celulares internas, como el plegamiento y el tráfico de proteínas. [33]
El transportador de ATP del RE, SLC35B1/AXER, fue clonado y caracterizado recientemente, [34] y las mitocondrias suministran ATP al RE a través de un mecanismo de transporte antagonizado por Ca 2+ hacia el RE ( CaATiER ). [35] El mecanismo CaATiER muestra sensibilidad al Ca 2+ citosólico que va desde un rango alto de nM a un rango bajo de μM, y el elemento sensor de Ca 2+ aún no se ha identificado y validado. [ cita necesaria ]
El estrés aumentado y suprafisiológico del RE en las células β pancreáticas altera la secreción normal de insulina, lo que lleva a hiperinsulinemia [36] y, en consecuencia, resistencia periférica a la insulina asociada con la obesidad en humanos. [37] Los ensayos clínicos en humanos también sugirieron un vínculo causal entre el aumento de la secreción de insulina inducido por la obesidad y la resistencia periférica a la insulina. [38]
Las anomalías en XBP1 conducen a una mayor respuesta al estrés del retículo endoplásmico y, posteriormente, provocan una mayor susceptibilidad a procesos inflamatorios que incluso pueden contribuir a la enfermedad de Alzheimer . [39] En el colon , las anomalías de XBP1 se han relacionado con enfermedades inflamatorias del intestino, incluida la enfermedad de Crohn . [40]
La respuesta de proteína desplegada (UPR) es una respuesta de estrés celular relacionada con el retículo endoplásmico. [41] La UPR se activa en respuesta a una acumulación de proteínas desplegadas o mal plegadas en la luz del retículo endoplásmico. La UPR funciona para restaurar la función normal de la célula deteniendo la traducción de proteínas , degradando las proteínas mal plegadas y activando las vías de señalización que conducen a aumentar la producción de chaperonas moleculares involucradas en el plegamiento de proteínas . La sobreactivación sostenida de la UPR se ha implicado en enfermedades priónicas , así como en otras enfermedades neurodegenerativas , y la inhibición de la UPR podría convertirse en un tratamiento para esas enfermedades. [42]