El herpesvirus humano 6 ( HHV-6 ) es el nombre colectivo común para el betaherpesvirus humano 6A (HHV-6A) y el betaherpesvirus humano 6B (HHV-6B). Estos virus estrechamente relacionados son dos de los nueve herpesvirus conocidos que tienen al ser humano como su huésped principal. [1]
El HHV-6A y el HHV-6B son virus de ADN bicatenario de la subfamilia Betaherpesvirinae y del género Roseolovirus . El HHV-6A y el HHV-6B infectan a casi todas las poblaciones humanas que se han estudiado. [2]
Se ha descrito que el HHV-6A es más neurovirulento [ 3] y, como tal, se encuentra con mayor frecuencia en pacientes con enfermedades neuroinflamatorias como la esclerosis múltiple [4] . Los niveles de HHV-6 (y HHV-7) en el cerebro también están elevados en personas con enfermedad de Alzheimer [5] .
La infección primaria por HHV-6B es la causa de la enfermedad infantil común llamada exantema súbito (también conocida como roséola infantil o sexta enfermedad). Se transmite de un niño a otro. Es poco común que los adultos contraigan esta enfermedad, ya que la mayoría de las personas la han tenido en el jardín de infantes y, una vez contraída, surge la inmunidad y previene la reinfección futura. Además, la reactivación del HHV-6B es común en los receptores de trasplantes, lo que puede causar varias manifestaciones clínicas como encefalitis , supresión de la médula ósea y neumonitis . [6]
Para la detección del HHV-6 se utilizan diversas pruebas, algunas de las cuales no diferencian las dos especies. [7]
Ambos virus pueden causar infección transplacentaria y transmitirse al recién nacido. [8]
Un estudio de 2016 mostró que el 43% de las mujeres con infertilidad inexplicable dieron positivo en la prueba del HHV-6A, en comparación con el 0% en el grupo de control fértil. El HHV-6A se encontró presente en las células epiteliales endometriales de las mujeres con infertilidad inexplicable, pero no en su sangre. En el contexto de la infertilidad, este descubrimiento subraya la importancia de realizar pruebas específicas para el HHV-6A en el entorno uterino, ya que el virus no se detectó en el torrente sanguíneo de las personas afectadas. Por lo tanto, un diagnóstico eficaz requiere pruebas que sean capaces de distinguir entre infecciones activas y latentes por HHV-6A específicamente en el tejido endometrial, lo que destaca la necesidad de métodos de detección viral específicos del tejido para evaluar y tratar la infertilidad asociada al HHV-6A. [9]
Un estudio de 2018 encontró que el 37 % de las mujeres que experimentaron fallas recurrentes de implantación después de FIV/TE tenían HHV-6A en sus biopsias endometriales, en comparación con el 0 % en los grupos de control. [10]
Un estudio de 2019 confirmó la presencia de infección por HHV-6A en el 40 % de las mujeres con infertilidad idiopática. Identificar el efecto de la infección por HHV-6A en el estado inmunológico del endometrio abre nuevas perspectivas en el cuidado de la fertilidad. Es posible elegir terapias antivirales y enfoques no hormonales para mujeres con infertilidad inexplicable caracterizada por HHV-6A para aumentar su tasa de embarazo. [11]
La siguiente tabla presenta una descripción general completa de las distintas pruebas diagnósticas utilizadas para detectar el virus del herpes humano 6 (HHV-6), y detalla su capacidad para distinguir entre infecciones activas y latentes. [12] También incluye información sobre la interpretación de los resultados de las pruebas, identifica a los proveedores que ofrecen estas pruebas e indica qué métodos son adecuados para detectar el HHV-6A en el revestimiento endometrial, una consideración importante para evaluar las posibles causas de infertilidad en las mujeres. La tabla sirve como guía para que los profesionales de la salud seleccionen las pruebas diagnósticas adecuadas para el HHV-6.

En 1986, Syed Zaki Salahuddin, Dharam Ablashi y Robert Gallo cultivaron células mononucleares de sangre periférica de pacientes con SIDA y enfermedades linfoproliferativas . Se documentaron células grandes, refractarias y de vida corta que frecuentemente contenían cuerpos de inclusión intranucleares y/o intracitoplasmáticos. La microscopía electrónica reveló un nuevo virus al que llamaron virus linfotrópico B humano (HBLV). [13] [14]
Poco después de su descubrimiento, Ablashi et al. describieron cinco líneas celulares que pueden ser infectadas por el recién descubierto HBLV. Publicaron que HSB-2, una línea particular de células T, es altamente susceptible a la infección. La investigación pionera de Ablashi concluyó sugiriendo que el nombre del virus se cambiara de HBLV a HHV-6, de acuerdo con la clasificación provisional publicada de los virus del herpes. [15] [16]
Años después, el HHV-6 se dividió en subtipos. Las primeras investigaciones (1992) describieron dos variantes muy similares, pero únicas: HHV-6A y HHV-6B. La distinción se justificaba debido a las escisiones de las endonucleasas de restricción, las reacciones de los anticuerpos monoclonales [17] y los patrones de crecimiento únicos. [18]
El HHV-6A incluye varias cepas derivadas de adultos y su espectro patológico no está bien definido, aunque algunos creen que es más neurovirulento. [19] [20] El HHV-6B se detecta comúnmente en niños con roséola infantil , ya que es el agente etiológico de esta afección. Entre estos dos virus hay una homología de secuencia del 95 %. [21]
En 2012, HHV-6A y HHV-6B fueron reconocidos oficialmente como especies distintas. [1]
El Comité Internacional de Taxonomía de Virus (ICTV) reconoció al HHV-6A y al HHV-6B como especies distintas en 2012. Los roseolovirus humanos incluyen al HHV-6A, al HHV-6B y al HHV-7. [1]
Herpesvirus fue establecido como género en 1971 en el primer informe del ICTV. Este género constaba de 23 virus en 4 grupos. [22] En 1976, se publicó un segundo informe del ICTV en el que este género fue elevado al nivel de familia: los herpetoviridae . Debido a una posible confusión con virus derivados de reptiles, el nombre de la familia se cambió en el tercer informe (1979) a herpesviridae . En este informe, la familia Herpesviridae se dividió en 3 subfamilias ( alphaherpesvirinae , betaherpesvirinae y gammaherpesvirinae ) y 5 géneros sin nombre; 21 virus fueron reconocidos como miembros de la familia. [23]
En 2009 se creó el orden Herpesvirales , debido al descubrimiento de que los virus del herpes de los peces y los moluscos están relacionados de manera distante con los de las aves y los mamíferos. El orden Herpesvirales contiene tres familias: Herpesviridae , que incluye los herpesvirus de mamíferos, aves y reptiles, reconocidos desde hace mucho tiempo, y dos nuevas familias: la familia Alloherpesviridae , que incluye los herpesvirus de los peces óseos y las ranas, y la familia Malacoherpesviridae , que incluye los virus de los moluscos. [24]
A partir de 2012, este orden actualmente tiene 3 familias, 4 subfamilias (1 no asignada), 18 géneros (4 no asignados) y 97 especies. [1]
El diámetro de un virión HHV-6 es de aproximadamente 2000 angstroms. [14] La porción externa del virión consiste en una membrana de bicapa lipídica que contiene glicoproteínas virales y se deriva de la del huésped. Debajo de esta envoltura de membrana hay un tegumento que rodea una cápside icosaédrica , compuesta por 162 capsómeros . La cápside protectora del HHV-6 contiene ADN lineal de doble cadena.
Durante la maduración de los viriones del HHV-6, las membranas celulares humanas se utilizan para formar envolturas lipídicas virales (como es característico de todos los virus con envoltura). Durante este proceso, el HHV-6 utiliza balsas lipídicas , que son microdominios membranosos enriquecidos con colesterol , esfingolípidos y proteínas ancladas a glicosilfosfatidilinositol . [25] Los primeros investigadores sospecharon que los viriones del HHV-6 maduran en el núcleo; algunos incluso publicaron esto incorrectamente, ya que generalizaron y aplicaron al HHV-6 lo que se sabía sobre otros virus. Sin embargo, una investigación publicada en 2009 sugiere que el virus HHV-6 utiliza vesículas derivadas de la red trans-Golgi para el ensamblaje. [25]
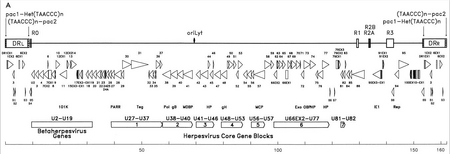
El material genético del HHV-6 está compuesto de ADN lineal (circular durante una infección activa), de doble cadena, que contiene un origen de replicación , dos extremos repetidos directos izquierdo y derecho de 8 a 10 kb y un segmento único de 143 a 145 kb. [27]
El origen de replicación (a menudo etiquetado como "oriLyt" en la literatura) es donde comienza la replicación del ADN. [26] Los extremos de repetición directa (DR L y DR R ) poseen una secuencia TTAGGG repetida, idéntica a la de los telómeros humanos . Se observa una variabilidad en el número de repeticiones teloméricas en el rango de 15 a 180. [28] [29] Estos extremos también contienen señales de escisión y empaquetamiento de pac-1 y pac-2 que se conservan entre los herpesvirus.
El segmento único contiene siete bloques de genes principales (U27–U37, U38–U40, U41–U46, U48–U53, U56–U57, U66EX2–U77 y U81–U82), [26] lo que también es característico de los herpesvirus. Estos genes conservados codifican proteínas que están involucradas en la replicación, escisión y empaquetamiento del genoma viral en un virión maduro. [28] Además, codifican varias proteínas inmunomoduladoras. El segmento único también posee un bloque de genes (U2–U19) que se conservan entre HHV-6, HHV-7 y citomegalovirus (los betaherpesvirus). Varios de los genes del segmento único están asociados, por ejemplo, con la familia HCMV US22 ( InterPro : IPR003360 ). La siguiente tabla describe algunas de sus propiedades conocidas. [26]
Cuando un virión extracelular del HHV-6 se encuentra con células humanas, se encuentra con el grupo de proteínas receptoras humanas de diferenciación 46 ( CD46 ), que desempeña un papel en la regulación del sistema del complemento. La proteína CD46 posee una única región variable, como resultado del splicing alternativo . Como tal, existen al menos catorce isoformas de CD46, todas las cuales se unen al HHV-6a. [33]
La región extracelular de CD46 contiene cuatro repeticiones de consenso cortas de aproximadamente 60 aminoácidos que se pliegan en un dominio de barril beta compacto rodeado de bucles flexibles. [28] Como se ha demostrado para CD46 con otros ligandos, la estructura de la proteína CD46 se linealiza al unirse a HHV-6. Si bien su interacción precisa aún no se ha determinado, se ha demostrado que el segundo y tercer dominios SCR son necesarios para la unión al receptor HHV-6 y la entrada celular.
Mori et al. identificaron por primera vez el producto génico gQ1, una glicoproteína exclusiva del HHV-6, y descubrieron que forma un complejo con las glicoproteínas gH y gL. [17] [34] Creían que este complejo heterotrimérico servía como ligando viral para CD46. [27] Poco después, se identificó otra glicoproteína llamada gQ2 y se descubrió que formaba parte del complejo de ligando gH/gL/gQ1, formando un heterotetrámero que se identificó positivamente como el ligando viral CD46. [34] El proceso exacto de entrada aún no se entiende bien.
Las glándulas salivales se han descrito como un reservorio in vivo de la infección por HHV-6. [28]
Los investigadores [35] realizaron un estudio para demostrar que las células T son altamente infectables por HHV-6.
Durante el año 2011, investigadores de los Institutos Nacionales de Salud intentaron dilucidar el método, entonces desconocido, por el cual el HHV-6a logra ingresar al sistema nervioso. Para ello, realizaron autopsias a los cerebros de alrededor de 150 sujetos. Cuando se analizaron varias regiones anatómicas para determinar su carga viral, se descubrió que los tejidos olfativos tenían el contenido más alto de HHV-6. Concluyeron que estos tejidos son el punto de entrada del HHV-6a. [21]
Los resultados anteriores son consistentes con los de estudios previos que involucraron HSV-1 (y varios otros virus), que también se disemina al SNC a través del tejido olfativo. [36]
Los investigadores también plantearon la hipótesis de que las células envolventes olfatorias (OEC), un grupo de células gliales especializadas que se encuentran en la cavidad nasal, pueden tener un papel en la infectividad del HHV-6. [21] Sospecharon esta asociación como resultado de que las OEC tienen propiedades similares a las de los astrocitos , otro tipo de célula glial que se identificó previamente como susceptible a la infección por HHV-6. [37] La investigación continuó infectando OEC in vitro con ambos tipos de HHV-6. Finalmente, solo las OEC en las que se utilizó HHV-6a dieron positivo para signos de síntesis viral de novo, como también es característico de los astrocitos. [37]
Una vez dentro, se han descrito dos resultados: infecciones activas e inactivas.
Las infecciones activas implican la circularización del genoma dsADN lineal mediante enlaces covalentes de extremo a extremo . Este proceso se informó por primera vez en el caso del virus del herpes simple . [29] Una vez circularizado, el HHV-6 comienza a expresar lo que se conoce como genes "tempranos inmediatos". Se cree que estos productos genéticos son activadores de la transcripción [7] y pueden estar regulados por la expresión de micro ARN virales . [31] Luego se produce la expresión posterior de "genes tempranos" y se activan, por ejemplo, las ADN polimerasas virales . Los genes tempranos también están involucrados en la replicación en círculo rodante que sigue. [28]
La replicación del HHV-6 da como resultado la formación de concatémeros , que son moléculas largas que contienen varias repeticiones de una secuencia de ADN. [38] Estos concatémeros largos luego se escinden entre las regiones pac-1 y pac-2 para el empaquetamiento del genoma en viriones individuales. [29]
No todas las células recién infectadas comienzan la replicación en círculo rodante. Los herpesvirus pueden entrar en una fase latente, infectando de forma inactiva a su huésped humano. Desde su descubrimiento en 1993, este fenómeno se ha detectado en todos los betaherpesvirus . [39]
Otros betaherpesvirus establecen la latencia como un episoma nuclear , que es una molécula de ADN circular (análoga a los plásmidos ). En el caso del HHV-6, se cree que la latencia se produce exclusivamente a través de la integración de repeticiones teloméricas virales en regiones subteloméricas humanas. [20] Solo se sabe que otro virus, el virus de la enfermedad de Marek , logra la latencia de esta manera. [7] Este fenómeno es posible como resultado de las repeticiones teloméricas que se encuentran dentro de los extremos de repetición directa del genoma del HHV-6.
El extremo repetido directo derecho se integra en 5 a 41 repeticiones de telómeros humanos, y lo hace preferentemente en el extremo proximal [40] de los cromosomas 9, 17, 18, 19 y 22, pero también se ha encontrado ocasionalmente en los cromosomas 10 y 11. [38] Se sospecha que casi 70 millones de personas son portadoras de HHV-6 integrado cromosómicamente. [20] [38]
Varios genes expresados por el HHV-6 son exclusivos de su etapa de latencia inactiva. Estos genes implican el mantenimiento del genoma y evitar la destrucción de la célula huésped. [40] Por ejemplo, se cree que la proteína U94 reprime los genes que participan en la lisis celular (apoptosis) y también puede ayudar en la integración telomérica. [28] Una vez almacenado en los telómeros humanos, el virus se reactiva de forma intermitente. [40]
No se conocen bien los factores desencadenantes específicos de la reactivación. Algunos investigadores han sugerido que podrían estar involucrados una lesión, estrés físico o emocional y desequilibrios hormonales. [41]
En 2011, los investigadores descubrieron que la reactivación puede ser desencadenada positivamente in vitro por inhibidores de la histona desacetilasa . Una vez que comienza la reactivación, se inicia el proceso de círculo rodante y se forman los concatémeros como se describió anteriormente. [28]
Un estudio publicado en The Journal of Infectious Diseases en 2024 investigó la reactivación del virus del herpes humano 6 cromosómicamente integrado heredado (iciHHV-6B) en un receptor de trasplante de hígado y su impacto en el injerto. La investigación, realizada por Hannolainen et al., utilizó la secuenciación de captura híbrida y varias técnicas moleculares para analizar las secuencias virales y la respuesta inmunitaria del huésped. Los hallazgos demostraron una replicación activa de iciHHV-6B y una activación inmunitaria significativa, lo que sugiere el impacto patológico de la reactivación viral en los resultados del trasplante. El estudio enfatiza la importancia de monitorear la reactivación de iciHHV-6 en pacientes trasplantados. [42]
El virus del herpes humano 6 vive principalmente en humanos y, aunque las variantes del virus pueden causar enfermedades leves a fatales, puede vivir de forma comensal en su huésped. [18] Se ha demostrado que el HHV-6 promueve la progresión del VIH-1 tras la coinfección en las células T. [43] El HHV-6 regula positivamente la expresión del receptor primario del VIH CD4, ampliando así el rango de células susceptibles al VIH. Varios estudios también han demostrado que la infección por HHV-6 aumenta la producción de citocinas inflamatorias que mejoran la expresión in vitro del VIH-1, como el TNF-alfa, [44] la IL-1 beta y la IL-8. [45] Un estudio in vivo más reciente muestra que la coinfección con HHV-6A acelera drásticamente la progresión del VIH al SIDA en macacos de cola de cerdo. [46]
También se ha demostrado que el HHV-6 transactiva el virus de Epstein-Barr. [36]
Los humanos adquieren el virus a una edad temprana, algunos incluso antes de un mes de edad. Las infecciones primarias por HHV-6 representan hasta el 20% de las visitas a salas de emergencia de bebés por fiebre en los Estados Unidos [47] [48] y están asociadas con varias complicaciones más graves, como encefalitis , linfadenopatía , miocarditis y mielosupresión . La prevalencia del virus en el cuerpo aumenta con la edad (las tasas de infección son más altas entre los bebés de entre 6 y 12 meses de edad) y se plantea la hipótesis de que esto se debe a la pérdida de anticuerpos maternos en un niño que lo protegen de las infecciones. [18]
Existen inconsistencias con las correlaciones entre la edad y la seropositividad : según algunos informes, hay una disminución de la seropositividad con el aumento de la edad, mientras que otros indican que no hay una disminución significativa y otros informan de un aumento de la tasa de seropositividad para personas de 62 años o más. Después de la infección primaria, la latencia se establece en las glándulas salivales, las células madre hematopoyéticas y otras células, y existe durante la vida del huésped.
Se sabe que el virus está muy extendido en todo el mundo. Se ha informado de una tasa de infección por HHV-6 del 64 al 83 % a los 13 meses de edad en países como Estados Unidos, Reino Unido, Japón y Taiwán. [18] [49] Los estudios han encontrado que la seroprevalencia varía "de aproximadamente el 39 al 80 % entre las poblaciones adultas étnicamente diversas de Tanzania, Malasia, Tailandia y Brasil". [18] No hay diferencias significativas entre los grupos étnicos que viven en la misma ubicación geográfica o entre sexos. Si bien el HHV-6B está presente en casi todas las poblaciones del mundo, el HHV-6A parece ser menos frecuente en Japón, América del Norte y Europa. [18]
Se cree que la transmisión ocurre con mayor frecuencia a través de la liberación de partículas virales en la saliva. Tanto el HHV-6B como el HHV-7 se encuentran en la saliva humana, siendo el primero con una frecuencia menor. Los estudios informan tasas variables de prevalencia del HHV-6 en la saliva (entre el 3 y el 90 %) [18] y también han descrito las glándulas salivales como un reservorio in vivo para el HHV-6. El virus infecta las glándulas salivales, establece un período de latencia y se reactiva periódicamente para propagar la infección a otros huéspedes [28] .
También se ha descrito la transmisión vertical , que ocurre aproximadamente en el 1% de los nacimientos en los Estados Unidos. [7] [50] Esta forma es fácilmente identificable ya que el genoma viral está contenido dentro de cada célula de un individuo infectado.
El diagnóstico de la infección por HHV-6 se realiza tanto por métodos serológicos como directos. La técnica más destacada es la cuantificación del ADN viral en sangre, otros fluidos corporales y órganos mediante PCR en tiempo real . [51]
La presentación clásica de la infección primaria por HHV-6b es como exantema súbito (ES) o "roséola", que se caracteriza por una temperatura alta que dura de 3 a 5 días seguida de una erupción en el torso, el cuello o la cara y, a veces, convulsiones febriles; sin embargo, los síntomas no siempre se presentan juntos. Sin embargo, un estudio (1997) indicó que una erupción no es una característica distintiva de la infección por HHV-6, con tasas similares a las infecciones no HHV-6 (10-20% de los niños febriles en ambos grupos). Las infecciones HHV-6 se presentan con mayor frecuencia con temperaturas altas (más de 40 °C), a una tasa de alrededor de dos tercios en comparación con menos de la mitad en los pacientes no HHV-6. Se observaron diferencias significativas similares en el malestar, la irritabilidad y la inflamación de la membrana timpánica. [18]
La infección primaria en adultos tiende a ser más grave. [18]
El diagnóstico del virus, en particular del HHV-6B, es vital para el paciente debido a los efectos adversos de la infección. Los síntomas que apuntan a esta infección, como las erupciones cutáneas, pasan desapercibidos en pacientes que reciben antibióticos porque pueden malinterpretarse como un efecto secundario del medicamento. [18] Además del exantema súbito, se sabe que el HHV-6B está asociado con la hepatitis, las convulsiones febriles y la encefalitis.
El virus se reactiva periódicamente desde su estado latente, y el ADN del HHV-6 es detectable en el 20-25% de los adultos sanos en los Estados Unidos. En el entorno inmunocompetente, estas reactivaciones suelen ser asintomáticas, pero en individuos inmunodeprimidos puede haber complicaciones graves. La reactivación del HHV-6 causa una enfermedad grave en los receptores de trasplantes y puede conducir al rechazo del injerto, a menudo en conjunción con otros betaherpesviridae. Del mismo modo, en el VIH/SIDA , las reactivaciones del HHV-6 causan infecciones diseminadas que conducen a la enfermedad del órgano terminal y la muerte. Aunque hasta el 100% de la población está expuesta (seropositiva) al HHV-6, la mayoría a los 3 años de edad, hay casos raros de infecciones primarias en adultos. En los Estados Unidos, estos se han relacionado más con el HHV-6a, que se cree que es más patógeno y más neurotrópico y se ha relacionado con varios trastornos relacionados con el sistema nervioso central .
Se ha informado de la presencia de HHV-6 en pacientes con esclerosis múltiple [52] y se lo ha implicado como cofactor en varias otras enfermedades, incluido el síndrome de fatiga crónica , [53] el SIDA , [54] y la epilepsia del lóbulo temporal . [55]
La esclerosis múltiple (EM) es un trastorno autoinmune e inflamatorio del sistema nervioso que provoca la desmielinización de los axones del cerebro y la médula espinal. El primer estudio que investigó específicamente la desmielinización relacionada con el HHV-6 apareció en la literatura en 1996, cuando un niño de 19 meses previamente sano desarrolló una encefalopatía aguda . Los niveles de proteína básica de mielina estaban elevados en su líquido cefalorraquídeo , lo que sugería que se estaba produciendo una desmielinización. [56] Este vínculo casi se olvidó, hasta que cuatro años después se publicó un estudio relacionado con la EM que mostraba una prevalencia del HHV-6 del 90% entre los tejidos cerebrales desmielinizados. En comparación, solo un 13% de los tejidos cerebrales libres de enfermedad poseían el virus. [57]
La hipótesis del mimetismo molecular, según la cual las células T están confundiendo una proteína viral HHV-6 con una proteína básica de la mielina, apareció por primera vez en esta época. Al principio del desarrollo de esta hipótesis (2002), investigadores italianos utilizaron la variante HHV-6a junto con la proteína básica de la mielina bovina para generar líneas de células T con reactividad cruzada. Se compararon con las células T de individuos con EM y con las de los controles, y no se encontró ninguna diferencia significativa entre las dos. Sus primeras investigaciones sugirieron que el mimetismo molecular podría no ser un mecanismo que esté involucrado en la EM. [58]
Posteriormente se realizaron varios estudios similares. Un estudio de octubre de 2014 respaldó el papel de la infección prolongada por HHV-6 con desmielinización en las enfermedades neurológicas progresivas. [59]
El síndrome de fatiga crónica (SFC) es una enfermedad debilitante, [60] cuya causa se desconoce. Los pacientes con SFC presentan alteraciones neurológicas, inmunológicas y metabólicas.
En muchos pacientes que cumplen los criterios del SFC, pero no en todos, la enfermedad comienza con un síndrome agudo parecido a una infección. Los casos de SFC pueden aparecer tras infecciones bien documentadas con varios agentes infecciosos. [61] En un estudio de 259 pacientes con una enfermedad "similar al SFC" publicado poco después de que se descubriera el HHV-6, se utilizaron cultivos primarios de linfocitos para identificar a las personas con replicación activa del HHV-6. Dicha replicación activa se encontró en el 70% de los pacientes frente al 20% de los sujetos de control ( ). [62] La pregunta que se planteó, pero no se respondió en este estudio, fue si la enfermedad causaba una deficiencia inmunitaria sutil que conducía a la reactivación del HHV-6, o si la reactivación del HHV-6 conducía a los síntomas de la enfermedad.
Estudios posteriores que emplearon únicamente técnicas serológicas que no distinguen la infección activa de la latente han producido resultados mixtos: la mayoría, pero no todos, han encontrado una asociación entre el SFC y la infección por HHV-6. [61] [63] [64]
Otros estudios han empleado ensayos que pueden detectar la infección activa: cultivo celular primario, PCR de suero o plasma, o ensayos de anticuerpos anti-IgM de antígeno temprano. La mayoría de estos estudios han demostrado una asociación entre el SFC y la infección activa por HHV-6, [63] [65] [66] [67] [68] [69] aunque algunos no lo han hecho. [64] [70]
En resumen, la infección activa por HHV-6 está presente en una fracción sustancial de pacientes con SFC. Además, se sabe que el HHV-6 infecta células del sistema nervioso y del sistema inmunitario, sistemas orgánicos con anomalías demostrables en el SFC. A pesar de esta asociación, sigue sin demostrarse que la infección reactivada por HHV-6 sea una causa del SFC.
La tiroiditis de Hashimoto es la enfermedad tiroidea más común y se caracteriza por un infiltrado linfocítico abundante y deterioro de la función tiroidea. Investigaciones recientes sugieren un posible papel del HHV-6 (posiblemente la variante A) en el desarrollo o desencadenamiento de la tiroiditis de Hashimoto. [71]
Se ha estudiado el papel del HHV-6 durante el embarazo que conduce a la inflamación en la cavidad amniótica . [72]
Se encontró ADN del HHV-6A en el endometrio de casi la mitad de un grupo de mujeres infértiles, pero no en ninguna del grupo de control fértil. También se encontraron células asesinas naturales específicas para el HHV-6A y altos niveles uterinos de ciertas citocinas en el endometrio de las mujeres infértiles positivas para el HHV-6A. Los autores sugieren que el HHV-6A puede resultar un factor importante en la infertilidad femenina . [73]
Se han identificado muchos virus oncogénicos humanos. Por ejemplo, el HHV-8 está relacionado con el sarcoma de Kaposi , [74] el virus de Epstein-Barr con el linfoma de Burkitt y el VPH con el cáncer de cuello uterino . De hecho, la Organización Mundial de la Salud estimó (2002) que el 17,8% de los cánceres humanos eran causados por infecciones. [75] Los métodos típicos por los cuales los virus inician la oncogénesis implican suprimir el sistema inmunológico del huésped, causar inflamación o alterar genes.
Se ha detectado el HHV-6 en linfomas , leucemias , cánceres de cuello uterino y tumores cerebrales . [19] Se ha demostrado que varias líneas celulares de meduloblastoma , así como las células de otros tumores cerebrales, expresan el receptor CD46. También se ha identificado ADN viral en muchos otros tejidos cerebrales no patológicos, pero los niveles son más bajos. [19]
La proteína humana P53 funciona como un supresor tumoral. Las personas que no producen adecuadamente esta proteína experimentan una mayor incidencia de cáncer, un fenómeno conocido como síndrome de Li-Fraumeni . Uno de los productos genéticos del HHV-6, la proteína U14, se une a la P53 y la incorpora a los viriones . Otro producto genético, la proteína ORF-1, también puede unirse a la P53 e inactivarla. Se ha demostrado incluso que las células que expresan el gen ORF-1 producen fibrosarcomas cuando se inyectan en ratones. [19]
Se ha demostrado que otro producto del HHV-6, la proteína temprana inmediata U95, se une al factor nuclear kappa B. La desregulación de este factor está asociada con el cáncer. [19]
Se han notificado tres casos de inflamación ocular inducida por HHV-6. Los tres casos se notificaron en personas mayores, dos en 2007 y uno en 2011. Los dos primeros casos se notificaron en Japón y Francia, y el más reciente en Japón. [76] [77] [78]
Se cree que estos se produjeron como resultado de una reactivación, ya que los niveles de anticuerpos IgM anti-HHV-6 eran bajos. [78]
La epilepsia del lóbulo temporal mesial está asociada con la infección por HHV-6. Dentro de esta región del cerebro existen tres estructuras: la amígdala , el hipocampo y el giro parahipocampal . La epilepsia del lóbulo temporal mesial (MTLE) es la forma más común de epilepsia crónica y su mecanismo subyacente no se comprende por completo. [79]
Los investigadores informan constantemente que han encontrado ADN de HHV-6 en tejidos extraídos de pacientes con MTLE. Los estudios han demostrado una tendencia del HHV-6 a acumularse en el lóbulo temporal, [80] con las concentraciones más altas en los astrocitos del hipocampo. [79]
Sin embargo, un grupo de investigadores finalmente concluyó que el HHV-6 puede no estar involucrado en la MTLE relacionada con la esclerosis temporal mesial . [81]
El virus es una causa común de disfunción hepática e insuficiencia hepática aguda en los receptores de trasplantes de hígado, y recientemente se lo ha vinculado con la necrosis confluente periportal. Además, el ADN del HHV-6 suele detectarse solo en los tejidos de biopsia, ya que los niveles de ADN caen por debajo del nivel de detección en sangre en los casos persistentes. [82]
No existen fármacos aprobados específicamente para el tratamiento de la infección por HHV-6, aunque el uso de tratamientos contra el citomegalovirus ( valganciclovir , ganciclovir , [83] cidofovir y foscarnet ) ha demostrado cierto éxito. [7] Estos fármacos se administran con la intención de inhibir la polimerización adecuada del ADN compitiendo con los nucleótidos desoxitrifosfato [83] o inactivando específicamente las polimerasas del ADN viral. [2]
Encontrar un tratamiento puede ser difícil cuando la reactivación del HHV-6 ocurre después de una cirugía de trasplante porque los medicamentos para el trasplante incluyen inmunosupresores. [84]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )