Imatinib , vendido bajo las marcas Gleevec y Glivec (ambas comercializadas en todo el mundo por Novartis ), entre otras, es un medicamento de terapia dirigida oral que se usa para tratar el cáncer . [2] Imatinib es un inhibidor de moléculas pequeñas que se dirige a múltiples tirosina quinasas como CSF1R , ABL , c-KIT , FLT3 y PDGFR-β . [6] [7] Específicamente, se usa para la leucemia mielógena crónica (LMC) y la leucemia linfocítica aguda (LLA) que son positivas para el cromosoma Filadelfia (Ph + ), ciertos tipos de tumores del estroma gastrointestinal (GIST), síndrome hipereosinofílico (HES), leucemia eosinofílica crónica (CEL), mastocitosis sistémica y síndrome mielodisplásico . [2]
Los efectos secundarios comunes incluyen vómitos, diarrea, dolor muscular, dolor de cabeza y sarpullido. Los efectos secundarios graves pueden incluir retención de líquidos , sangrado gastrointestinal , supresión de la médula ósea , problemas hepáticos e insuficiencia cardíaca . El uso durante el embarazo puede resultar perjudicial para el bebé. El imatinib actúa deteniendo la tirosina quinasa Bcr-Abl . Esto puede ralentizar el crecimiento o provocar la muerte celular programada de ciertos tipos de células cancerosas. [2]
El imatinib fue aprobado para uso médico en los Estados Unidos en 2001. [2] Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [8] Una versión genérica estuvo disponible en el Reino Unido a partir de 2017. [9]
El imatinib se utiliza para tratar la leucemia mieloide crónica (LMC), los tumores del estroma gastrointestinal (GIST) y otras enfermedades malignas . En 2006, la FDA amplió el uso aprobado para incluir el dermatofibrosarcoma protuberans (DFSP), las enfermedades mielodisplásicas /mieloproliferativas (SMD/MPD) y la mastocitosis sistémica agresiva (ASM). [10]
Se considera que el imatinib es un tratamiento muy eficaz para la leucemia mieloide crónica y se ha demostrado que mejora los resultados en las personas con este tipo de leucemia. También se puede utilizar para tratar algunos tipos de leucemia linfoblástica aguda, pero no se considera un tratamiento estándar para la leucemia linfoblástica aguda. En muchos casos, el imatinib puede inducir una respuesta citogenética completa (CCyR) y una respuesta molecular mayor (MMR) y muchos pacientes pueden tener una remisión a largo plazo. También se utiliza para mantener la remisión en pacientes con leucemia mieloide crónica en fase crónica.
Si bien el imatinib es un tratamiento muy eficaz para la leucemia mieloide crónica y algunos tipos de leucemia linfoblástica aguda, no cura la leucemia. En cambio, es una "terapia crónica" que ayuda a controlar la enfermedad y evitar que progrese. Algunos pacientes pueden necesitar seguir tomando imatinib durante un período prolongado para mantener la remisión, y algunos pacientes pueden eventualmente requerir opciones de tratamiento adicionales.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha aprobado el imatinib como tratamiento de primera línea para la leucemia mieloide crónica (LMC) con cromosoma Filadelfia positivo, tanto en adultos como en niños. El fármaco está aprobado en múltiples contextos de LMC con cromosoma Filadelfia positivo, incluso después de un trasplante de células madre, en crisis blástica y en casos de diagnóstico reciente. [11]
Debido en parte al desarrollo del imatinib y de fármacos relacionados, la tasa de supervivencia a cinco años de las personas con leucemia mieloide crónica aumentó del 31 % en 1993 al 59 % en 2009 [12] y al 70 % en 2016 [13]. Para 2023, la tasa de supervivencia a cinco años de las personas con leucemia mieloide crónica había aumentado al 90 % [ 14] . A partir de 2011, quedó claro que los pacientes con LMC que siguen respondiendo al imatinib tienen la misma o casi la misma esperanza de vida que la población general [15] .
La FDA otorgó por primera vez la aprobación para pacientes con GIST avanzado en 2002. El 1 de febrero de 2012, se aprobó el uso de imatinib después de la extirpación quirúrgica de tumores KIT -positivos para ayudar a prevenir la recurrencia. [16] El fármaco también está aprobado para GIST KIT-positivos irresecables. [11]
La FDA otorgó la aprobación para el tratamiento de pacientes con dermatofibrosarcoma protuberans (DFSP) en 2006. [10] Específicamente, pacientes adultos con dermatofibrosarcoma protuberans (DFSP) irresecable, recurrente y/o metastásico . Antes de la aprobación, se consideraba que el DFSP no respondía a los tratamientos de quimioterapia .
La FDA ha aprobado el uso de imatinib en adultos con leucemia linfoblástica aguda con cromosoma Filadelfia positivo (LLA Ph+) recidivante o refractaria, enfermedades mielodisplásicas / mieloproliferativas asociadas con reordenamientos del gen del receptor del factor de crecimiento derivado de plaquetas , mastocitosis sistémica agresiva sin mutación D816V c-KIT o con una mutación desconocida, síndrome hipereosinofílico y/o leucemia eosinofílica crónica que tienen la quinasa de fusión FIP1L1-PDGFRα (deleción del alelo CHIC2) o dermatofibrosarcoma protuberans metastásico, irresecable, recurrente y/o no resecable o con quinasa de fusión FIP1L1-PDGFRα negativa o desconocida. [11] El 25 de enero de 2013, se aprobó el uso de Gleevec en niños con LLA Ph+. [17]
Para el tratamiento de neurofibromas plexiformes progresivos asociados con neurofibromatosis tipo I , las primeras investigaciones han demostrado potencial para utilizar las propiedades bloqueadoras de la tirosina quinasa c-KIT del imatinib. [18] [19] [20] [21] Se han realizado varios ensayos de fase 2 de imatinib para fibromatosis agresiva . [22] [23]
La única contraindicación conocida del imatinib es la hipersensibilidad al mismo. [24] Las precauciones incluyen: [25]

Los efectos secundarios más comunes incluyen náuseas, vómitos, diarrea, dolores de cabeza, dolores/calambres en las piernas, retención de líquidos, alteraciones visuales, picazón, menor resistencia a las infecciones, hematomas o sangrado, pérdida de apetito, [26] aumento de peso, reducción del número de células sanguíneas ( neutropenia , trombocitopenia , anemia ) y edema . [27]
En algunas personas, se ha informado de que el uso de imatinib se asoció con disfunción ventricular izquierda que a veces progresó a insuficiencia cardíaca congestiva a pesar de la ausencia de cardiopatía previa. Los ensayos clínicos de imatinib no informaron efectos adversos cardíacos, pero sí una incidencia notablemente alta de edema periférico, con algunos casos clasificados como graves. [28]
Las biopsias de pacientes, así como los ratones tratados con grandes dosis de imatinib, mostraron signos celulares de cardiotoxicidad . Los efectos cardiotóxicos parecieron estar mediados por la inhibición de la tirosina quinasa ABL1 citoplasmática . [28]
Varios estudios en humanos y animales sugieren que si se utiliza imatinib en niños prepúberes, puede retrasar el crecimiento normal (más específicamente, la elongación de los huesos), aunque algunos pueden experimentar al menos una recuperación parcial del crecimiento durante la pubertad . [29]
La razón de este efecto secundario no está clara; puede estar implicada una interferencia con una vía relacionada con la hormona del crecimiento (GH) (el crecimiento prepuberal depende de la GH, mientras que el crecimiento puberal es promovido sinérgicamente tanto por la GH como por las hormonas sexuales). [29]
El uso de imatinib puede causar aclaramiento/despigmentación u oscurecimiento/repigmentación del cabello (como es el caso con algunos otros inhibidores de la tirosina quinasa) y/o la piel, así como hiperpigmentación de las encías . La mediana de aparición del cambio de color del cabello es de 4 semanas después del inicio de la terapia (pero puede ocurrir más de un año después del inicio), depende de la dosis y es reversible tras la interrupción del tratamiento o la reducción de la dosis. [30]
Los receptores C-kit , uno de los objetivos biológicos del imatinib, son expresados por los melanocitos. [30]
La experiencia médica con sobredosis de imatinib es limitada. [31] El tratamiento es de soporte. [31] El imatinib se une en gran medida a las proteínas plasmáticas: [31] es poco probable que la diálisis sea útil para eliminar el imatinib.
Se desaconseja su uso en personas que toman inhibidores potentes del CYP3A4 como claritromicina , cloranfenicol , ketoconazol , ritonavir y nefazodona debido a su dependencia del CYP3A4 para su metabolismo. [25] Asimismo, es un inhibidor del CYP3A4 , CYP2D6 y CYP2C9 y, por tanto, el tratamiento concurrente con sustratos de cualquiera de estas enzimas puede aumentar las concentraciones plasmáticas de dichos fármacos. [25] Dado que el imatinib se metaboliza principalmente a través de la enzima hepática CYP3A4, las sustancias que influyen en la actividad de esta enzima cambian la concentración plasmática del fármaco. Un ejemplo de fármaco que aumenta la actividad del imatinib y, por tanto, los efectos secundarios al bloquear el CYP3A4 es el ketoconazol . Lo mismo podría ocurrir con el itraconazol , la claritromicina , el zumo de pomelo , entre otros. Por el contrario, los inductores del CYP3A4 como la rifampicina y la hierba de San Juan reducen la actividad del fármaco, con el riesgo de que la terapia fracase. El imatinib también actúa como inhibidor del CYP3A4, 2C9 y 2D6, aumentando las concentraciones plasmáticas de varios otros fármacos como la simvastatina , la ciclosporina , la pimozida , la warfarina , el metoprolol y posiblemente el paracetamol . El fármaco también reduce los niveles plasmáticos de levotiroxina a través de un mecanismo desconocido. [27]
Al igual que con otros inmunosupresores, la aplicación de vacunas vivas está contraindicada porque los microorganismos presentes en ellas podrían multiplicarse e infectar al paciente. Las vacunas inactivadas y toxoides no presentan este riesgo, pero pueden no ser eficaces en el tratamiento con imatinib. [32]
Se desaconseja enfáticamente comer pomelo y beber jugo de pomelo, ya que aumenta la concentración de imatinib en la sangre. [33]
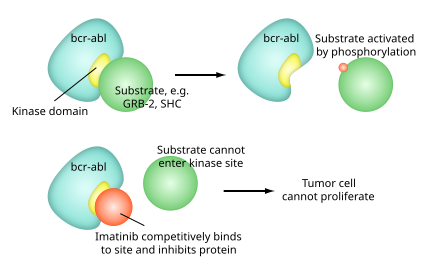
El imatinib es un derivado de la 2- fenilaminopirimidina que actúa como inhibidor específico de varias enzimas tirosina quinasas. Ocupa el sitio activo de la tirosina quinasa , lo que provoca una disminución de la actividad.
En el organismo hay una gran cantidad de enzimas TK , incluido el receptor de insulina . El imatinib es específico para el dominio TK en abl (el protooncogén de Abelson), c-kit y PDGF-R ( receptor del factor de crecimiento derivado de plaquetas ).
En la leucemia mieloide crónica , el cromosoma Filadelfia conduce a una proteína de fusión de abl con bcr ( región de punto de ruptura ), denominada bcr-abl . Como ahora se trata de una tirosina quinasa constitutivamente activa , se utiliza imatinib para disminuir la actividad de bcr-abl .
Los sitios activos de las tirosina quinasas tienen cada uno un sitio de unión para ATP . La actividad enzimática catalizada por una tirosina quinasa es la transferencia del fosfato terminal del ATP a los residuos de tirosina en sus sustratos , un proceso conocido como fosforilación de la proteína tirosina . El imatinib funciona uniéndose cerca del sitio de unión de ATP de bcr-abl , bloqueándolo en una conformación cerrada o autoinhibida y, por lo tanto, inhibiendo la actividad enzimática de la proteína de forma semicompetitiva . [35] Este hecho explica por qué muchas mutaciones de BCR-ABL pueden causar resistencia al imatinib al cambiar su equilibrio hacia la conformación abierta o activa. [36]
El imatinib es bastante selectivo para bcr-abl , aunque también inhibe otros objetivos mencionados anteriormente (c-kit y PDGF-R), así como las tirosina quinasas ABL2 (ARG) y DDR1 y NQO2, una oxidorreductasa. [37] El imatinib también inhibe la proteína abl de las células no cancerosas, pero estas células normalmente tienen tirosina quinasas redundantes adicionales, lo que les permite seguir funcionando incluso si la tirosina quinasa abl está inhibida. Sin embargo, algunas células tumorales tienen una dependencia de bcr-abl . [38] La inhibición de la tirosina quinasa bcr-abl también estimula su entrada al núcleo, donde no puede realizar ninguna de sus funciones antiapotópicas normales , lo que lleva a la muerte de la célula tumoral. [39]
La vía Bcr-Abl tiene muchas vías posteriores, entre ellas [40]
El imatinib se absorbe rápidamente cuando se administra por vía oral y tiene una alta biodisponibilidad : el 98% de una dosis oral llega al torrente sanguíneo. El metabolismo del imatinib se produce en el hígado y está mediado por varias isoenzimas del sistema del citocromo P450 , incluidas CYP3A4 y, en menor medida, CYP1A2 , CYP2D6 , CYP2C9 y CYP2C19 . El principal metabolito , el derivado de piperazina N -desmetilado , también es activo. La principal vía de eliminación es la bilis y las heces; solo una pequeña parte del fármaco se excreta en la orina. La mayor parte del imatinib se elimina como metabolitos; solo el 25% se elimina sin cambios. Las semividas del imatinib y su principal metabolito son 18 h y 40 h, respectivamente. Bloquea la actividad de la tirosina quinasa citoplasmática de Abelson (ABL), c-Kit y el receptor del factor de crecimiento derivado de plaquetas (PDGFR). Como inhibidor del PDGFR, el mesilato de imatinib parece tener utilidad en el tratamiento de una variedad de enfermedades dermatológicas. Se ha informado que el imatinib es un tratamiento eficaz para la enfermedad de mastocitos FIP1L1-PDGFRalpha+ , el síndrome hipereosinofílico y el dermatofibrosarcoma protuberans . [41]
El imatinib fue inventado a finales de los años 1990 por científicos de Ciba-Geigy (que se fusionó con Sandoz en 1996 para convertirse en Novartis ), en un equipo dirigido por el bioquímico británico Nicholas Lydon y que incluía a Elisabeth Buchdunger y Jürg Zimmermann, [42] y su uso para tratar la LMC fue impulsado por el oncólogo Brian Druker de la Oregon Health & Science University (OHSU). [43] Otras contribuciones importantes al desarrollo del imatinib fueron realizadas por el biólogo Anthony R. Hunter en el Salk Institute for Biological Studies en La Jolla, California, Carlo Gambacorti-Passerini , médico, científico y hematólogo de la Universidad de Milano Bicocca , Italia, John Goldman en el Hammersmith Hospital de Londres, y más tarde por Charles Sawyers del Memorial Sloan Kettering Cancer Center en Nueva York. [43] [44]
El imatinib se desarrolló mediante un diseño racional de fármacos . Después de que se descubriera la mutación del cromosoma Filadelfia y la proteína bcr-abl hiperactiva, los investigadores examinaron bibliotecas químicas para encontrar un fármaco que inhibiera esa proteína. Con un examen de alto rendimiento , identificaron la 2-fenilaminopirimidina. Luego, este compuesto principal se probó y se modificó mediante la introducción de grupos metilo y benzamida para darle propiedades de unión mejoradas, lo que dio como resultado el imatinib. [45]
Cuando Novartis probó el imatinib en ratas, ratones, conejos, perros y monos en 1996, se descubrió que tenía varios efectos tóxicos; en particular, los resultados que indicaban daño hepático en perros casi detuvieron por completo el desarrollo del fármaco. Sin embargo, los resultados favorables en estudios con monos y células humanas in vitro permitieron continuar las pruebas en humanos. [46] [47] [48]
El primer ensayo clínico de Gleevec tuvo lugar en 1998, después de que Novartis sintetizara y liberara a regañadientes unos pocos gramos del fármaco para Druker, suficientes para que éste realizara un ensayo con unos cien pacientes. [49] Mel Mann, que entró en el ensayo clínico en agosto de 1998, es la persona que más tiempo ha vivido en tratamiento con el fármaco. [50] [51] [52] [53] [54] El fármaco recibió la aprobación de la FDA en mayo de 2001, sólo dos años y medio después de que se presentara la solicitud de nuevo fármaco. [42] [55] Ese mismo mes apareció en la portada de la revista TIME como una "bala" para ser utilizada contra el cáncer. Druker, Lydon y Sawyers recibieron el Premio de Investigación Médica Clínica Lasker-DeBakey en 2009 por "convertir un cáncer mortal en una enfermedad crónica manejable". [43]
Durante la revisión de la FDA, el nombre comercial del medicamento para el mercado estadounidense se cambió de "Glivec" a "Gleevec" a pedido de la FDA, para evitar confusiones con Glyset , un medicamento para la diabetes. [56] [57] [58]
En abril de 1992 se presentó una solicitud de patente suiza sobre imatinib y varias sales, que luego se presentó en la UE, los EE. UU. y otros países en marzo y abril de 1993. [59] [60] y en 1996 las oficinas de patentes de los Estados Unidos y Europa emitieron patentes que incluían a Jürg Zimmermann como inventor. [59] [61]
En julio de 1997, Novartis presentó una nueva solicitud de patente en Suiza sobre la forma beta cristalina del mesilato de imatinib (la sal mesilato de imatinib). La "forma beta cristalina" de la molécula es un polimorfo específico del mesilato de imatinib; una forma específica en la que las moléculas individuales se empaquetan para formar un sólido. Esta es la forma real del fármaco que se vende como Gleevec/Glivec; una sal (mesilato de imatinib) en lugar de una base libre, y la forma beta cristalina en lugar de la alfa u otra forma. [62] : 3 y 4 En 1998, Novartis presentó solicitudes de patente internacionales reivindicando prioridad sobre la presentación de 1997. [63] [64] En 2005 se concedió una patente en Estados Unidos . [65]

En 2013, más de 100 especialistas en cáncer publicaron una carta en Blood diciendo que los precios de muchos nuevos medicamentos contra el cáncer, incluido el imatinib, son tan altos que la gente en los Estados Unidos no puede pagarlos, y que el nivel de precios y ganancias era tan alto que era inmoral. Entre los firmantes de la carta se encontraban Brian Druker, Carlo Gambacorti-Passerini y John Goldman, desarrolladores del imatinib. [66] [67] Escribieron que en 2001, el imatinib tenía un precio de 30.000 dólares (equivalente a 51.622 dólares en 2023) al año, que se basaba en el precio del interferón , entonces el tratamiento estándar, y que a este precio Novartis habría recuperado sus costos iniciales de desarrollo en dos años. Escribieron que después de convertirse inesperadamente en un éxito de ventas, Novartis aumentó el precio a $92,000 (equivalente a $122,098 en 2023) por año en 2012, con ingresos anuales de $4,7 mil millones . Otros médicos se han quejado del costo. [68] [69] [70]
Druker, quien dirigió los estudios clínicos, nunca recibió regalías ni ganancias por el éxito del fármaco. [71]
En 2016, el precio mayorista promedio había aumentado a 120.000 dólares (equivalentes a 152.346 dólares en 2023) al año, según un análisis preparado para The Washington Post por Stacie Dusetzina de la Universidad de Carolina del Norte en Chapel Hill . Cuando los medicamentos competitivos llegaron al mercado, se vendieron a un precio más alto para reflejar la menor población, [ aclaración necesaria ] y Novartis aumentó el precio de Gleevec para igualarlos. [72]
Un análisis económico de 2012 financiado por Bristol-Myers Squibb estimó que el descubrimiento y desarrollo del imatinib y otros fármacos relacionados había creado un valor social de 143.000 millones de dólares a un coste para los consumidores de aproximadamente 14.000 millones de dólares. La cifra de 143.000 millones de dólares se basaba en una ventaja de supervivencia estimada de entre 7,5 y 17,5 años conferida por el tratamiento con imatinib, e incluía el valor (descontado al 3% anual) de los beneficios continuos para la sociedad tras la expiración de la patente del imatinib. [73]
Los precios de una pastilla de 100 mg de Gleevec a nivel internacional varían entre 20 y 30 dólares, [74] aunque el imatinib genérico es más barato, tan solo 2 dólares por pastilla. [75]
Novartis libró una controvertida batalla de siete años para patentar Gleevec en la India, y llevó el caso hasta la Corte Suprema de ese país . La solicitud de patente que es el centro del caso fue presentada por Novartis en la India en 1998, después de que la India aceptara ingresar en la Organización Mundial del Comercio y cumplir con las normas mundiales de propiedad intelectual en virtud del acuerdo sobre los ADPIC . Como parte de este acuerdo, la India realizó cambios en su ley de patentes, el más importante de los cuales fue que antes de estos cambios, las patentes sobre productos no estaban permitidas, mientras que después sí lo estaban, aunque con restricciones. Estos cambios entraron en vigor en 2005, por lo que la solicitud de patente de Novartis esperó en un "buzón" junto con otras hasta entonces, según los procedimientos que la India instituyó para gestionar la transición. La India también aprobó ciertas modificaciones a su ley de patentes en 2005, justo antes de que las leyes entraran en vigor. [76] [77]
La solicitud de patente [64] [78] reivindicó la forma final de Gleevec (la forma cristalina beta del mesilato de imatinib ). [79] : 3 En 1993, durante el tiempo en que India no permitía patentes de productos, Novartis había patentado imatinib, con sales vagamente especificadas, en muchos países, pero no podía patentarlo en India. [59] [61] Las diferencias clave entre las dos solicitudes de patente fueron que la solicitud de patente de 1998 especificaba el contraión (Gleevec es una sal específica: mesilato de imatinib), mientras que la solicitud de patente de 1993 no reivindicaba ninguna sal específica ni mencionaba el mesilato, y la solicitud de patente de 1998 especificaba la forma sólida de Gleevec: la forma en que las moléculas individuales se empaquetan juntas en un sólido cuando se fabrica el medicamento en sí (esto es independiente de los procesos mediante los cuales el medicamento en sí se formula en píldoras o cápsulas), mientras que la solicitud de patente de 1993 no lo hacía. La forma sólida del mesilato de imatinib en Gleevec es beta cristalina. [80]
Como se establece en el acuerdo sobre los ADPIC, Novartis solicitó derechos exclusivos de comercialización (EMR) para Gleevec a la Oficina de Patentes de la India y los EMR le fueron concedidos en noviembre de 2003. [81] Novartis utilizó los EMR para obtener pedidos contra algunos fabricantes de genéricos que ya habían lanzado Gleevec en la India. [82] [83]
Cuando en 2005 se inició el examen de la solicitud de patente de Novartis, ésta fue inmediatamente atacada por las oposiciones iniciadas por las empresas de genéricos que ya vendían Gleevec en la India y por grupos de defensa de los derechos de los consumidores. La solicitud fue rechazada por la oficina de patentes y por una junta de apelaciones. La base clave para el rechazo fue la parte de la ley de patentes india que se creó mediante una enmienda en 2005, que describe la patentabilidad de nuevos usos para medicamentos conocidos y modificaciones de medicamentos conocidos. Esa sección, la 3d, especificaba que esas invenciones son patentables sólo si "difieren significativamente en propiedades con respecto a la eficacia". [82] [84] En un momento dado, Novartis acudió a los tribunales para intentar invalidar la Sección 3d; argumentó que la disposición era inconstitucionalmente vaga y que violaba el Acuerdo sobre los ADPIC. Novartis perdió ese caso y no apeló. [85] Novartis apeló el rechazo de la oficina de patentes ante la Corte Suprema de la India, que tomó el caso.
El caso de la Corte Suprema se basó en la interpretación de la Sección 3d. La Corte Suprema emitió su decisión en 2013, dictaminando que la sustancia que Novartis pretendía patentar era de hecho una modificación de un fármaco conocido (la forma cruda de imatinib, que se divulgó públicamente en la solicitud de patente de 1993 y en artículos científicos), que Novartis no presentó evidencia de una diferencia en la eficacia terapéutica entre la forma final de Gleevec y la forma cruda de imatinib y que, por lo tanto, la solicitud de patente fue rechazada correctamente por la oficina de patentes y los tribunales inferiores. [86]
Un estudio demostró que el mesilato de imatinib fue eficaz en pacientes con mastocitosis sistémica , incluidos aquellos que tenían la mutación D816V en c-KIT. [87] Sin embargo, dado que el imatinib se une a las tirosina quinasas cuando están en la configuración inactiva y el mutante D816V de c-KIT es constitutivamente activo, el imatinib no inhibe la actividad de la quinasa del mutante D816V de c-KIT. Sin embargo, la experiencia ha demostrado que el imatinib es mucho menos eficaz en pacientes con esta mutación, y los pacientes con la mutación comprenden casi el 90% de los casos de mastocitosis.
Inicialmente se pensó que el imatinib tenía un papel potencial en el tratamiento de la hipertensión pulmonar . Se demostró que reducía tanto la hipertrofia del músculo liso como la hiperplasia de la vasculatura pulmonar en una variedad de procesos patológicos, incluida la hipertensión portopulmonar . [88] Sin embargo, un ensayo a largo plazo de imatinib en personas con hipertensión arterial pulmonar no tuvo éxito y se produjeron eventos adversos graves e inesperados con frecuencia. Estos incluyeron 6 hematomas subdurales y 17 muertes durante o dentro de los 30 días posteriores al final del estudio. [89]
En la esclerosis sistémica , se ha probado el fármaco para su posible uso en la ralentización de la fibrosis pulmonar . En el laboratorio, el imatinib se está utilizando como agente experimental para suprimir el factor de crecimiento derivado de plaquetas (PDGF) inhibiendo su receptor (PDGF-Rβ). Uno de sus efectos es retrasar la aterosclerosis en ratones sin [90] o con diabetes . [91]
Los estudios realizados en animales de laboratorio han sugerido que el imatinib y otros medicamentos relacionados pueden ser útiles para tratar la viruela , en caso de que alguna vez se produjera un brote. [92]
Estudios in vitro identificaron que una versión modificada de imatinib puede unirse ala proteína activadora de la gamma-secretasa ( GSAP ). La GSAP aumenta selectivamente la producción y acumulación de placas beta-amiloide neurotóxicas , lo que sugiere que las moléculas que se dirigen a la GSAP y son capaces de cruzar la barrera hematoencefálica son agentes terapéuticos potenciales para tratar la enfermedad de Alzheimer . [93] Otro estudio sugiere que el imatinib puede no necesitar cruzar la barrera hematoencefálica para ser eficaz en el tratamiento del Alzheimer, ya que la investigación indica que la producción de beta-amiloide puede comenzar en el hígado. Las pruebas en ratones indican que el imatinib es eficaz para reducir el beta-amiloide en el cerebro. [94] No se sabe si la reducción de beta-amiloide es una forma factible de tratar el Alzheimer, ya que se ha demostrado que una vacuna anti-beta-amiloide limpia el cerebro de placas sin tener ningún efecto sobre los síntomas del Alzheimer. [95]
Una formulación de imatinib con una ciclodextrina (Captisol) como portador para superar la barrera hematoencefálica ha demostrado revertir la tolerancia a los opioides en un estudio de 2012 en ratas. [96]
El imatinib es un fármaco experimental en el tratamiento del tumor desmoide o fibromatosis agresiva . [97]
La raíz de la palabra -tinib hace referencia a la acción del fármaco como inhibidor de la tirosina quinasa (TYK). [98]