El propileno , también conocido como propeno , es un compuesto orgánico insaturado con la fórmula química CH3CH = CH2 . Tiene un doble enlace y es el segundo miembro más simple de la clase de los alquenos de los hidrocarburos . Es un gas incoloro con un leve olor a petróleo. [3]
El propileno es un producto de la combustión de incendios forestales, humo de cigarrillos y gases de escape de vehículos de motor y aviones. [4] Fue descubierto en 1850 por el capitán estudiante de AW von Hoffman (más tarde General de División [5] ) John Williams Reynolds como el único producto gaseoso de la descomposición térmica del alcohol amílico que reacciona con el cloro y el bromo. [6]
La tecnología dominante para producir propileno es el craqueo con vapor , utilizando propano como materia prima . El craqueo de propano produce una mezcla de etileno , propileno, metano , gas hidrógeno y otros compuestos relacionados. El rendimiento de propileno es de aproximadamente el 15%. La otra materia prima principal es la nafta, especialmente en Medio Oriente y Asia. [7] El propileno puede separarse mediante destilación fraccionada de las mezclas de hidrocarburos obtenidas del craqueo y otros procesos de refinación; El propeno de calidad de refinería es aproximadamente del 50 al 70%. [8] En los Estados Unidos, el gas de esquisto es una fuente importante de propano.
En la tecnología de conversión de triolefinas u olefinas de Phillips , el propileno se interconvierte con etileno y 2-butenos . Se utilizan catalizadores de renio y molibdeno : [9]
La tecnología se basa en una reacción de metátesis de olefinas descubierta en Phillips Petroleum Company . [10] [11] Se logran rendimientos de propileno de aproximadamente el 90% en peso.
Relacionado está el proceso de metanol a olefinas/metanol a propeno . Convierte el gas de síntesis (gas de síntesis) en metanol y luego convierte el metanol en etileno y/o propeno . El proceso produce agua como subproducto. El gas de síntesis se produce a partir de la reformación del gas natural o mediante la reformación inducida por vapor de productos derivados del petróleo como la nafta, o mediante la gasificación del carbón .
El craqueo catalítico de fluidos (FCC) de alta severidad utiliza la tecnología FCC tradicional en condiciones severas (proporciones más altas de catalizador a aceite, tasas de inyección de vapor más altas, temperaturas más altas, etc.) para maximizar la cantidad de propeno y otros productos ligeros. Una unidad FCC de alta severidad generalmente se alimenta con gasóleos (parafinas) y residuos, y produce alrededor del 20 al 25 % (en masa) de propeno en la materia prima junto con mayores volúmenes de gasolina de motor y subproductos destilados. Estos procesos a alta temperatura son costosos y tienen una alta huella de carbono. Por estas razones, las rutas alternativas al propileno siguen atrayendo la atención. [12]
A lo largo del siglo XX se desarrollaron tecnologías de producción de propileno específicas. De ellas, las tecnologías de deshidrogenación de propano, como los procesos CATOFIN y OLEFLEX, se han vuelto comunes, aunque todavía representan una minoría del mercado, y la mayor parte de la olefina proviene de las tecnologías de craqueo antes mencionadas. Los catalizadores de platino, cromia y vanadio son comunes en los procesos de deshidrogenación de propano.
La producción de propeno se ha mantenido estática en alrededor de 35 millones de toneladas (sólo en Europa y América del Norte) entre 2000 y 2008, pero ha ido aumentando en el este de Asia, sobre todo en Singapur y China. [13] La producción mundial total de propeno es actualmente aproximadamente la mitad que la de etileno.
Se ha explorado el uso de enzimas diseñadas, pero no se ha comercializado. [14]
Se están realizando investigaciones sobre el uso de catalizadores portadores de oxígeno para la deshidrogenación oxidativa del propano. Esto plantea varias ventajas, ya que este mecanismo de reacción puede ocurrir a temperaturas más bajas que la deshidrogenación convencional y puede no estar limitado por el equilibrio porque se usa oxígeno para quemar el subproducto de hidrógeno. [15]
El propeno es el segundo producto inicial más importante en la industria petroquímica después del etileno . Es la materia prima de una amplia variedad de productos. Los fabricantes de polipropileno consumen casi dos tercios de la producción mundial. [16] Los usos finales del polipropileno incluyen películas, fibras, contenedores, embalajes y tapas y cierres. El propeno también se utiliza para la producción de importantes sustancias químicas como el óxido de propileno , el acrilonitrilo , el cumeno , el butiraldehído y el ácido acrílico . En el año 2013 se procesaron en todo el mundo alrededor de 85 millones de toneladas de propeno. [dieciséis]
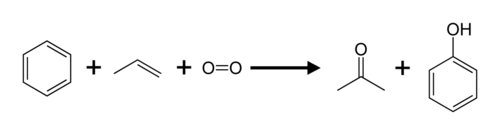
El propeno y el benceno se convierten en acetona y fenol mediante el proceso de cumeno .
El propeno también se utiliza para producir alcohol isopropílico (propan-2-ol), acrilonitrilo , óxido de propileno y epiclorhidrina . [17] La producción industrial de ácido acrílico implica la oxidación catalítica parcial del propeno. [18] El propileno es un intermediario en la oxidación a ácido acrílico.
En la industria y los talleres, el propeno se utiliza como combustible alternativo al acetileno en la soldadura y corte con oxicombustible , la soldadura fuerte y el calentamiento de metales con el fin de doblarlos. Se ha convertido en un estándar en los productos BernzOmatic y otros en los sustitutos de MAPP, [19] ahora que el verdadero gas MAPP ya no está disponible.
El propeno se parece a otros alquenos en que sufre reacciones de adición con relativa facilidad a temperatura ambiente. La relativa debilidad de su doble enlace explica su tendencia a reaccionar con sustancias que pueden lograr esta transformación. Las reacciones de los alquenos incluyen: 1) polimerización , 2) oxidación , 3) halogenación e hidrohalogenación , 4) alquilación , 5) hidratación , 6) oligomerización y 7) hidroformilación .
Los complejos de metal-propileno , que son intermedios en estos procesos, son fundamentales para la hidroformilación, la metátesis de alquenos y la polimerización . El propileno es proquiral , lo que significa que la unión de un reactivo (como un electrófilo metálico) al grupo C=C produce uno de dos enantiómeros .
La mayor parte del propeno se utiliza para formar polipropileno, un termoplástico básico muy importante , mediante polimerización por crecimiento de cadenas . [16] En presencia de un catalizador adecuado (normalmente un catalizador de Ziegler-Natta ), el propeno se polimerizará. Hay varias formas de lograr esto, como usar altas presiones para suspender el catalizador en una solución de propeno líquido o hacer pasar propeno gaseoso a través de un reactor de lecho fluidizado . [20]
En presencia de catalizadores , el propileno se dimeriza para dar 2,3-dimetil-1-buteno y/o 2,3-dimetil-2-buteno . [21]
El propeno es un producto de la combustión de incendios forestales, humo de cigarrillos y gases de escape de vehículos de motor y aviones. [4] Es una impureza en algunos gases de calefacción. Las concentraciones observadas han estado en el rango de 0,1 a 4,8 partes por mil millones ( ppb ) en el aire rural, de 4 a 10,5 ppb en el aire urbano y de 7 a 260 ppb en muestras de aire industrial. [8]
En Estados Unidos y algunos países europeos se estableció un valor límite de 500 partes por millón ( ppm ) para la exposición ocupacional ( promedio ponderado en el tiempo de 8 horas ). Se considera un compuesto orgánico volátil (COV) y sus emisiones están reguladas por muchos gobiernos, pero no figura en la lista de la Agencia de Protección Ambiental de EE. UU. (EPA) como un contaminante atmosférico peligroso según la Ley de Aire Limpio . Con una vida media relativamente corta, no se espera que se bioacumule. [8]
El propeno tiene una baja toxicidad aguda por inhalación y no se considera cancerígeno. Los estudios de toxicidad crónica en ratones no arrojaron pruebas significativas que sugirieran efectos adversos. Los seres humanos expuestos brevemente a 4.000 ppm no experimentaron ningún efecto notable. [22] El propeno es peligroso por su potencial para desplazar el oxígeno como gas asfixiante y por su alto riesgo de inflamabilidad/explosión.
El biopropileno es el propileno de base biológica . [23] [24] Se ha examinado, motivado por diversos intereses, como la huella de carbono . Se ha considerado la producción a partir de glucosa . [25] Las formas más avanzadas de abordar estos problemas se centran en alternativas de electrificación al craqueo con vapor .
El propeno es inflamable. El propeno generalmente se almacena como líquido bajo presión, aunque también es posible almacenarlo de manera segura como gas a temperatura ambiente en contenedores aprobados. [26]
El propeno se detecta en el medio interestelar mediante espectroscopia de microondas. [27] El 30 de septiembre de 2013, la NASA también anunció que la nave espacial orbitadora Cassini, parte de la misión Cassini-Huygens , había descubierto pequeñas cantidades de propeno natural en la atmósfera de Titán mediante espectroscopía. [28] [29]