Las organofosfinas son compuestos organofosforados con la fórmula PR n H 3− n , donde R es un sustituyente orgánico. Estos compuestos se pueden clasificar según el valor de n : fosfinas primarias ( n = 1), fosfinas secundarias ( n = 2), fosfinas terciarias ( n = 3). Todas adoptan estructuras piramidales. [1] Las organofosfinas son generalmente líquidos o sólidos incoloros y lipófilos. [2] El progenitor de las organofosfinas es la fosfina (PH 3 ). [3]
Las organofofinas se clasifican según el número de sustituyentes orgánicos.
Las fosfinas primarias (1°), con la fórmula RPH 2 , se preparan típicamente mediante alquilación de fosfina. Los derivados de alquilo simples como la metilfosfina (CH 3 PH 2 ) se preparan mediante alquilación de derivados de metales alcalinos MPH 2 (M es Li , Na o K ). Otra ruta sintética implica el tratamiento de las clorofosfinas correspondientes con reactivos de hidruro. Por ejemplo, la reducción de diclorofenilfosfina con hidruro de litio y aluminio produce fenilfosfina (PhPH 2 ). [4]

Las fosfinas primarias (RPH 2 ) y secundarias (RRPH y R 2 PH) se añaden a los alquenos en presencia de una base fuerte (p. ej., KOH en DMSO ). Se aplican las reglas de Markovnikov . Ocurren reacciones similares que involucran a los alquinos . [5] No se requiere base para alquenos deficientes en electrones (p. ej., derivados de acrilonitrilo ) y alquinos.
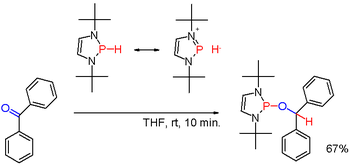
Las fosfinas secundarias (2°), con la fórmula R 2 PH, se preparan de manera análoga a las fosfinas primarias. También se obtienen por escisión reductora de metales alcalinos de triarilfosfinas seguida de hidrólisis de la sal de fosfuro resultante. La última ruta se emplea para preparar difenilfosfina (Ph 2 PH). Los ácidos diorganofosfínicos, R 2 P(O)OH, también se pueden reducir con hidruro de diisobutilaluminio . Las fosfinas secundarias suelen tener un carácter prótico. Pero cuando se modifican con sustituyentes adecuados, como en ciertos diazafosfolenos (raros) ( esquema 3 ), la polaridad del enlace PH se puede invertir (ver: umpolung ) y el hidruro de fosfina resultante puede reducir un grupo carbonilo como en el ejemplo de la benzofenona de otra manera. [6] Las fosfinas secundarias se presentan en formas cíclicas. Los anillos de tres miembros son fosfiranos (insaturados: fosfirenos ), los anillos de cinco miembros son fosfolanos (insaturados: fosfoles ) y los anillos de seis miembros son fosfinanos .
Las fosfinas terciarias (3°), con la fórmula R 3 P, se preparan tradicionalmente mediante alquilación de tricloruro de fósforo utilizando reactivos de Grignard o compuestos de organolitio relacionados :
En el caso de la trimetilfosfina , se utiliza fosfito de trifenilo en lugar del PCl3 altamente electrofílico : [ 7]
Se emplean métodos ligeramente más elaborados para la preparación de fosfinas terciarias asimétricas, con la fórmula R 2 R'P. El uso de nucleófilos basados en organofosforados es típico. Por ejemplo, el difenilfosfuro de litio se metila fácilmente con yoduro de metilo para dar metildifenilfosfina :
La fosfina es un precursor de algunas fosfinas terciarias por hidrofosfinación de alquenos. Por ejemplo, en presencia de catalizadores básicos, el pH 3 añade aceptores de Michael como el acrilonitrilo : [8]
Las fosfinas terciarias del tipo PRR′R″ son “ P -quirales ” y ópticamente estables.
Desde el punto de vista comercial, la fosfina más importante es la trifenilfosfina , de la que se producen varios millones de kilogramos al año. Se prepara a partir de la reacción de clorobenceno , PCl3 y sodio. [9] Las fosfinas de naturaleza más especializada suelen prepararse por otras vías. [10]

Las difosfinas también están disponibles en sustituyentes de fósforo primario, secundario y terciario. Las trifosfinas, etc., son similares.
Las organofosfinas, como la fosfina misma, son moléculas piramidales con simetría aproximada C 3 v . Los ángulos de enlace C–P–C son aproximadamente 98,6°. [3] Los ángulos de enlace C–P–C son consistentes con la noción de que el fósforo utiliza predominantemente los orbitales 3p para formar enlaces y que hay poca hibridación sp del átomo de fósforo. Esto último es una característica común de la química del fósforo. Como resultado, el par solitario de trimetilfosfina tiene predominantemente carácter s, como es el caso de la fosfina, PH 3 . [11]
Las fosfinas terciarias son piramidales. Cuando todos los sustituyentes orgánicos son diferentes, la fosfina es quiral y configuracionalmente estable ( a diferencia de NRR'R"). Los complejos derivados de las fosfinas quirales pueden catalizar reacciones para dar productos quirales enantioenriquecidos .
El átomo de fósforo en las fosfinas tiene un estado de oxidación formal −3 (σ 3 λ 3 ) y son los análogos de fósforo de las aminas . Al igual que las aminas, las fosfinas tienen una geometría molecular piramidal trigonal aunque a menudo con ángulos CEC más pequeños (E = N, P), al menos en ausencia de efectos estéricos. El ángulo de enlace CPC es de 98,6° para la trimetilfosfina y aumenta a 109,7° cuando los grupos metilo se reemplazan por grupos terc -butilo . Cuando se usan como ligandos, el volumen estérico de las fosfinas terciarias se evalúa por su ángulo de cono . La barrera para la inversión piramidal también es mucho mayor que la inversión de nitrógeno y, por lo tanto, las fosfinas con tres sustituyentes diferentes se pueden resolver en isómeros ópticos térmicamente estables . Las fosfinas son a menudo menos básicas que las aminas correspondientes, por ejemplo, el propio ion fosfonio tiene un p K a de −14 en comparación con 9,21 para el ion amonio; el trimetilfosfonio tiene un p K a de 8,65 en comparación con 9,76 para el trimetilamonio . Sin embargo, la trifenilfosfina (p K a 2,73) es más básica que la trifenilamina (p K a −5), principalmente porque el par solitario del nitrógeno en NPh 3 está parcialmente deslocalizado en los tres anillos de fenilo. Mientras que el par solitario en el nitrógeno está deslocalizado en el pirrol , el par solitario en el átomo de fósforo en el equivalente de fósforo del pirrol ( fosfol ) no lo está. La reactividad de las fosfinas coincide con la de las aminas con respecto a la nucleofilicidad en la formación de sales de fosfonio con la estructura general PR 4 + X − . Esta propiedad se utiliza en la reacción de Appel para convertir alcoholes en haluros de alquilo . Las fosfinas se oxidan fácilmente para formar los óxidos de fosfina correspondientes , mientras que los óxidos de amina se generan con menos facilidad. En parte por esta razón, las fosfinas se encuentran muy raramente en la naturaleza.
Las fosfinas terciarias se utilizan a menudo como ligandos en la química de coordinación. La unión de las fosfinas se une a los metales, que sirven como ácidos de Lewis . Por ejemplo, el cloruro de plata reacciona con la trifenilfosfina para formar complejos 1:1 y 1:2:
Los aductos formados a partir de fosfinas y boranos son reactivos útiles. Estos fosfinoboranos son estables al aire, pero el grupo protector del borano puede eliminarse mediante tratamiento con aminas. [12] [13]
De manera similar a la formación de complejos, las fosfinas se alquilan fácilmente. Por ejemplo, el bromuro de metilo convierte la trifenilfosfina en bromuro de metiltrifenilfosfonio , una "sal cuaternaria":
Las fosfinas son catalizadores nucleofílicos en la síntesis orgánica , por ejemplo, la reacción de Rauhut-Currier y la reacción de Baylis-Hillman .
Al igual que la fosfina, pero de forma más sencilla, las organofosfinas sufren protonación. La reacción es reversible. Mientras que las organofosfinas son sensibles al oxígeno, los derivados protonados no lo son.
Derivados primarios y secundarios, pueden ser desprotonados por bases fuertes para dar derivados organofosfóricos. Así, la difenilfosfina reacciona con el reactivo organolitio para dar difenilfosfuro de litio :
Las fosfinas terciarias se oxidan característicamente para dar óxidos de fosfina con la fórmula R 3 PO. La reacción con oxígeno está prohibida por el espín, pero aún así se produce a una velocidad suficiente como para que las muestras de fosfinas terciarias se contaminen característicamente con óxidos de fosfina. Cualitativamente, las velocidades de oxidación son más altas para las trialquilfosfinas que para las triarilfosfinas. Aún más rápidas son las oxidaciones con peróxido de hidrógeno . Las fosfinas primarias y secundarias también se oxidan, pero el producto o los productos están sujetos a tautomerización y oxidación adicional.
Las fosfinas terciarias se oxidan característicamente para dar sulfuros de fosfina .
Las propiedades reductoras de las organofosfinas también se ilustran en la reducción de Staudinger para la conversión de azidas orgánicas en aminas y en la reacción de Mitsunobu para convertir alcoholes en ésteres. En estos procesos, la fosfina se oxida a fósforo (V). También se ha descubierto que las fosfinas reducen los grupos carbonilo activados, por ejemplo, la reducción de un éster α-ceto a un éster α-hidroxi en el esquema 2. [ 14] En el mecanismo de reacción propuesto , el primer protón es prestado del grupo metilo en la trimetilfosfina (la trifenilfosfina no reacciona).