La Lepidosauria ( / ˌ l ɛ p ɪ d oʊ ˈ s ɔː r i ə / , del griego que significa lagartos escamosos ) es una subclase o superorden de reptiles , que contiene los órdenes Squamata y Rhynchocephalia . Squamata incluye lagartos y serpientes . [2] Squamata contiene más de 9.000 especies, lo que lo convierte, con diferencia, en el orden de reptiles no aviares más rico y diverso en especies de la actualidad. [3] La rinocefalia fue un grupo de reptiles antiguamente extendido y diverso en la Era Mesozoica . [4] Sin embargo, está representado por una sola especie viva: el tuátara ( Sphenodon punctatus), un reptil superficialmente parecido a un lagarto originario de Nueva Zelanda . [5] [6]
Lepidosauria es un grupo monofilético (es decir, un clado ), que contiene a todos los descendientes del último ancestro común de los escamosos y los rincocéfalos. [7] Los lepidosaurios se pueden distinguir de otros reptiles por varios rasgos, como grandes escamas queratinosas que pueden superponerse entre sí. Puramente en el contexto de los taxones modernos , Lepidosauria puede considerarse el taxón hermano de Archosauria , que incluye Aves (pájaros) y Crocodilia . Las testudinas (tortugas) pueden estar relacionadas con los lepidosaurios o los arcosaurios, pero no se ha llegado a un consenso sobre este tema. Lepidosauria está englobada por Lepidosauromorpha , un grupo más amplio definido como todos los reptiles (vivos o extintos) más cercanos a los lepidosaurios que a los arcosaurios .
Se cree que Lepidosauromorpha se separó del antepasado de Archelosauria durante el período Pérmico . [8] Los primeros miembros de Lepidosauromorpha datan del Triásico Temprano. Sophineta del Triásico Temprano puede ser el lepidosaurio más antiguo conocido, pero su ubicación exacta es incierta. [9] El rincocéfalo más antiguo , Wirtembergia , se conoce del Triásico Medio . [10] Si bien el lepidosaurio Megachirella puede representar un escamado de un grupo madre del Triásico Medio [11], los primeros miembros modernos del grupo se conocen del Jurásico Medio. [12] Los escamosos sufrieron una gran radiación en el Cretácico , [13] mientras que los rincocéfalos disminuyeron durante el mismo período de tiempo. [14]
Los reptiles existentes pertenecen al clado Diapsida , llamado así por dos pares de fenestras temporales presentes en el cráneo detrás de la cuenca del ojo. [15] Hasta hace poco, se decía que Diapsida estaba compuesta por Lepidosauria y su taxón hermano Archosauria. [16] La subclase Lepidosauria luego se divide en Squamata [17] y Rhynchocephalia. Estudios morfológicos más recientes [18] [19] y estudios moleculares [20] [21] [22] [23] [24] [25] también ubican a las tortugas firmemente dentro de Diapsida, a pesar de que carecen de fenestraciones temporales.

Los reptiles de la subclase Lepidosauria se pueden distinguir de otros reptiles por una variedad de características. [26] Se sugiere que los lepidosaurios se distingan de los lepidosauromorfos más primitivos por el desarrollo de una concha en el cuadrado , lo que permite el desarrollo de una membrana timpánica en el oído (un rasgo perdido en los tuátara, pero presente en los primeros rincocéfalos), como así como el desarrollo de un proceso subolfatorio en los huesos frontales del cráneo. [9] [27]

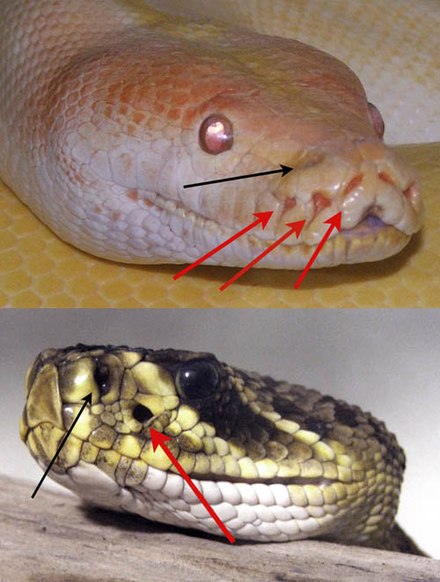
El grupo Squamata [17] incluye serpientes, lagartos y anfisbenos. Squamata se puede caracterizar por la reducción o pérdida de extremidades. Las serpientes y los lagartos sin patas han evolucionado hasta la pérdida total de sus extremidades. La mandíbula superior de Squamates se puede mover sobre el cráneo , una configuración llamada kinesis. [28] Esto es posible gracias a una conexión suelta entre el cuadrado y sus huesos vecinos. [29] Sin esto, las serpientes no podrían consumir presas que sean mucho más grandes que ellas. Los anfisbenos en su mayoría no tienen patas como las serpientes, pero generalmente son mucho más pequeños. Tres especies de anfisbenos han mantenido extremidades delanteras reducidas y estas especies son conocidas por excavar activamente en el suelo. [30] Los tuátara y algunos rincocéfalos extintos tienen un cráneo más rígido con una barra temporal inferior completa que cierra la fenestra temporal inferior formada por la fusión de los huesos yugal y cuadrado / cuadratoyugal , similar a la condición que se encuentra en los diápsidos primitivos. Sin embargo, los primeros rincocéfalos y lepidosauromorfos tenían una fenestra temporal inferior abierta, sin una barra temporal completa, por lo que se cree que esto es una reversión más que una retención. Se cree que la barra temporal estabiliza el cráneo durante la mordida. [31]
Los escamados masculinos han desarrollado un par de hemipenes en lugar de un solo pene con tejido eréctil que se encuentra en cocodrilos , aves , mamíferos y tortugas . El hemipene se encuentra en la base de la cola. El tuátara no tiene hemipene, sino que tiene bolsas emparejadas poco profundas en la pared posterior de la cloaca . [dieciséis]

En segundo lugar, la mayoría de los lepidosaurios tienen la capacidad de autotomizar sus colas. Sin embargo, este rasgo se ha perdido en algunas especies recientes. En los lagartos y rhynchoc, hay planos de fractura dentro de las vértebras de la cola que permiten su eliminación. Algunos lagartos tienen múltiples planos de fractura, mientras que otros solo tienen un único plano de fractura. El nuevo crecimiento de la cola no siempre es completo y está hecho de una barra sólida de cartílago en lugar de vértebras individuales. [16] En las serpientes, la cola se separa entre las vértebras y algunas no vuelven a crecer. [dieciséis]
En tercer lugar, las escamas de los lepidosaurios son estructuras córneas ( queratinizadas ) de la epidermis , lo que les permite mudarse colectivamente, a diferencia de los escudos que se ven en otros reptiles. [16] Esto se hace en diferentes ciclos, dependiendo de la especie. Sin embargo, los lagartos generalmente mudan su pelo en escamas, mientras que las serpientes lo hacen en una sola pieza. A diferencia de los escudos, las escamas de los lepidosaurios a menudo se superponen como tejas .
Los escamados están representados por especies vivíparas , ovovivíparas y ovíparas . Vivíparo significa que la hembra da a luz a crías vivas, Ovovivíparo significa que el huevo se desarrollará dentro del cuerpo de la hembra y Ovíparo significa que la hembra pone huevos. Algunas especies dentro de Squamata tienen la capacidad de reproducirse asexualmente . [32] El tuátara pone huevos que suelen tener aproximadamente una pulgada de largo y que tardan unos 14 meses en incubarse. [28]
Mientras está en el huevo, el embrión de Squamata desarrolla un diente de huevo en el premaxilar que ayuda al animal a emerger del huevo. [33] Un reptil aumentará de tres a veinte veces su longitud desde que nace hasta la edad adulta. [33] Hay tres eventos principales en la historia de vida que alcanzan los lepidosaurios: eclosión/nacimiento, madurez sexual y senilidad reproductiva. [33]
Debido a que el bombeo gular es tan común en los escamados y también se encuentra en los tuátara, se supone que es un rasgo original del grupo. [34]
La mayoría de los lepidosaurios dependen del camuflaje como una de sus principales defensas. Algunas especies han evolucionado para mezclarse con su ecosistema, mientras que otras pueden cambiar el color de su piel para mezclarse con su entorno actual. La capacidad de autotomizar la cola es otra defensa común entre los lepidosaurios. Otras especies, como la Echinosauria, han desarrollado la defensa de fingir la muerte. [33]

Los viperinos pueden sentir la radiación infrarroja de sus presas a través de las terminaciones nerviosas desnudas en la piel de sus cabezas. [33] Además, las viperinas y algunos boidos tienen receptores térmicos que les permiten apuntar al calor de sus presas. [33] Muchas serpientes pueden obtener sus presas mediante constricción . Esto se hace mordiendo primero a la presa y luego enrollando su cuerpo alrededor de la presa. Luego, la serpiente aprieta con más fuerza mientras la presa lucha, lo que provoca asfixia. [33] Algunas serpientes tienen colmillos que producen mordeduras venenosas , lo que les permite consumir presas inconscientes o incluso muertas. Además, algunos venenos incluyen un componente proteolítico que ayuda en la digestión. [33] Los camaleones agarran a sus presas con una lengua de proyectil. Esto es posible gracias al mecanismo hioides, que es la contracción del músculo hioides que impulsa la punta de la lengua hacia afuera. [33]
.jpg/440px-Eastern_Brown_Snake_eating_an_Eastern_Blue_tongue._(8235991265).jpg)
Dentro de la subclase Lepidosauria hay herbívoros , omnívoros , insectívoros y carnívoros . Los herbívoros se componen de iguanas, algunas agámidas y algunos eslizones . [33] La mayoría de las especies de lagartos y algunas especies de serpientes son insectívoras. Las especies de serpientes restantes, tuátaras y anfisbenos, son carnívoras. Si bien algunas especies de serpientes son generalistas, otras comen una gama limitada de presas; por ejemplo, Salvadora solo come lagartos. [33] Los lagartos restantes son omnívoros y pueden consumir plantas o insectos. La amplia dieta carnívora del tuátara puede verse facilitada por su mecanismo de corte especializado, que implica un movimiento hacia adelante de la mandíbula inferior después del cierre de la mandíbula. [35]
Si bien se sabe que las aves, incluidas las aves rapaces, las aves zancudas y los correcaminos, y los mamíferos se alimentan de reptiles, el principal depredador son otros reptiles. Algunos reptiles comen huevos de reptiles, por ejemplo, la dieta del varano del Nilo incluye huevos de cocodrilo, y los reptiles pequeños son presa de los más grandes. [33]

Los rangos geográficos de los lepidosaurios son vastos y cubren todas las partes del mundo excepto las más frías. Los anfisbenos existen en Florida , México continental , incluida Baja California , la región mediterránea , Oriente Medio , África del Norte , África subsahariana , América del Sur y el Caribe . [29] El tuátara está confinado sólo a unas pocas islas rocosas de Nueva Zelanda, donde cava madrigueras para vivir y se alimenta principalmente de insectos. [28]
El cambio climático ha llevado a la necesidad de realizar esfuerzos de conservación para proteger la existencia del tuátara . Esto se debe a que esta especie no puede migrar por sí sola a zonas más frías. Los conservacionistas están empezando a considerar la posibilidad de trasladarlos a islas con climas más fríos. [36] El alcance del tuátara ya se ha visto minimizado por la introducción de gatos, ratas, perros y mustélidos en Nueva Zelanda. [37] La erradicación de los mamíferos de las islas donde aún sobrevive el tuátara ha ayudado a la especie a aumentar su población. Un experimento que observó la población de tuátara después de la eliminación de la rata polinesia mostró que los tuátara expresaron un aumento de población específico de la isla después de la eliminación de las ratas. [38] Sin embargo, puede ser difícil evitar que estos pequeños mamíferos vuelvan a habitar estas islas.
La destrucción del hábitat es el principal impacto negativo de los humanos sobre los reptiles. Los humanos continúan desarrollando tierras que son un hábitat importante para los lepidosaurios. La tala rasa de tierras también ha llevado a la reducción del hábitat. Algunas serpientes y lagartos migran hacia las viviendas humanas porque hay abundancia de presas de roedores e insectos. Sin embargo, estos reptiles son vistos como plagas y muchas veces son exterminados . [dieciséis]

Las serpientes son comúnmente temidas en todo el mundo. Se pagaron recompensas por las cobras muertas bajo el Raj británico en la India ; De manera similar, se han anunciado redadas de serpientes de cascabel en América del Norte . Los datos muestran que entre 1959 y 1986 un promedio de 5,563 serpientes de cascabel fueron asesinadas por año en Sweetwater, Texas , debido a redadas de serpientes de cascabel, y estas redadas han llevado a disminuciones documentadas y extirpaciones locales de poblaciones de serpientes de cascabel, especialmente Diamondbacks del este en Georgia. [dieciséis]
La gente ha introducido especies en los hábitats naturales de los lepidosaurios que han aumentado la depredación de los reptiles. Por ejemplo, las mangostas fueron introducidas en Jamaica desde la India para controlar la infestación de ratas en los campos de caña de azúcar. Como resultado, las mangostas se alimentaron de la población de lagartos de Jamaica, lo que ha llevado a la eliminación o disminución de muchas especies de lagartos. [16] Los humanos pueden tomar medidas para ayudar a los reptiles en peligro de extinción. Algunas especies no pueden criarse en cautiverio, pero otras han prosperado. También existe la opción de refugios para animales. Este concepto es útil para contener a los reptiles y mantenerlos alejados de las viviendas humanas. Sin embargo, en los refugios todavía se producen fluctuaciones ambientales y ataques depredadores. [33]
Todavía se venden pieles de reptiles. Los accesorios, como zapatos, botas, carteras, cinturones, botones, carteras y pantallas de lámparas, están hechos de piel de reptil. [16] En 1986, el Instituto de Recursos Mundiales estimó que 10,5 millones de pieles de reptiles se comercializaban legalmente. Este total no incluye el comercio ilegal de ese año. [16] Los lagartos cornudos se capturan y rellenan popularmente . [16] Sin embargo, algunos humanos están haciendo un esfuerzo consciente para preservar las especies restantes de reptiles.