La prueba de Papanicolaou (abreviada como prueba de Papanicolaou , también conocida como prueba de Papanicolaou (PAP), [1] frotis cervical (CE), cribado cervical (CE), [2] o prueba de frotis (CE)) es un método de cribado cervical utilizado para detectar procesos potencialmente precancerosos y cancerosos en el cuello uterino (abertura del útero o matriz) o, más raramente, el ano (tanto en hombres como en mujeres). [3] Los hallazgos anormales suelen ser seguidos por procedimientos de diagnóstico más sensibles y, si está justificado, intervenciones que tienen como objetivo prevenir la progresión al cáncer de cuello uterino . La prueba fue inventada de forma independiente en la década de 1920 por el médico griego Georgios Papanikolaou y recibió su nombre. Una versión simplificada de la prueba fue introducida por la obstetra canadiense Anna Marion Hilliard en 1957.
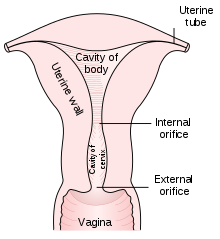
El frotis de Papanicolaou se realiza abriendo la vagina con un espéculo y recolectando células en la abertura externa del cuello uterino en la zona de transformación (donde las células cervicales escamosas externas se unen a las células endocervicales glandulares internas), utilizando una espátula de Ayre o un citocepillo . Las células recolectadas se examinan bajo un microscopio para buscar anomalías. La prueba tiene como objetivo detectar cambios potencialmente precancerosos (llamados neoplasia intraepitelial cervical [CIN] o displasia cervical; el sistema de lesión intraepitelial escamosa [SIL] también se usa para describir anomalías) causados por el virus del papiloma humano , un virus de ADN de transmisión sexual . La prueba sigue siendo un método eficaz y ampliamente utilizado para la detección temprana del precáncer y el cáncer de cuello uterino. Si bien la prueba también puede detectar infecciones y anomalías en el endocérvix y el endometrio , no está diseñada para hacerlo.
Las pautas sobre cuándo comenzar la prueba de Papanicolaou son variadas, pero generalmente comienzan en la edad adulta . Las pautas sobre la frecuencia varían de cada tres a cinco años. [4] [5] [6] Si los resultados son anormales, y dependiendo de la naturaleza de la anomalía, puede ser necesario repetir la prueba en seis a doce meses. [7] Si la anomalía requiere un escrutinio más minucioso, la paciente puede ser derivada para una inspección detallada del cuello uterino mediante colposcopia , que amplía la vista de las superficies del cuello uterino, la vagina y la vulva. La persona también puede ser derivada para una prueba de ADN del VPH , que puede servir como complemento a la prueba de Papanicolaou. En algunos países, primero se verifica el ADN viral, antes de verificar si hay células anormales. [8] Se están desarrollando biomarcadores adicionales que pueden aplicarse como pruebas complementarias con la prueba de Papanicolaou. [9]
Las pautas de detección varían de un país a otro. En general, la detección comienza alrededor de los 20 o 25 años y continúa hasta los 50 o 60 años. [12] Por lo general, se recomienda realizar la detección cada tres a cinco años, siempre que los resultados sean normales. [11]
El Congreso Estadounidense de Obstetras y Ginecólogos (ACOG, por sus siglas en inglés) y otros organismos recomiendan comenzar con las pruebas de detección a los 21 años . [5] [15] Muchos otros países esperan hasta los 25 años o más para comenzar con las pruebas de detección. Por ejemplo, en algunas partes de Gran Bretaña se comienzan a realizar pruebas de detección a los 25 años. La recomendación general del ACOG es que las personas con órganos reproductivos femeninos de entre 30 y 65 años se realicen un examen de bienestar de la mujer anual , que no se hagan pruebas de Papanicolaou anuales y que sí se hagan pruebas de Papanicolaou con intervalos de tres a cinco años. [16]
El VPH se transmite a través del contacto de piel a piel; no es necesario que haya relaciones sexuales, aunque es una forma común de propagación. [17] El sistema inmunológico de una persona tarda un año, en promedio, pero puede tardar hasta cuatro años, en eliminar la infección inicial. Las pruebas de detección durante este período pueden mostrar esta reacción inmunológica y su reparación como anomalías leves, que por lo general no se asocian con el cáncer de cuello uterino, pero que podrían causar estrés a la paciente y dar lugar a más pruebas y posible tratamiento. El cáncer de cuello uterino suele tardar en desarrollarse, por lo que retrasar el inicio de las pruebas de detección unos años plantea poco riesgo de pasar por alto una lesión potencialmente precancerosa. Por ejemplo, las pruebas de detección en personas menores de 25 años no reducen las tasas de cáncer en personas menores de 30 años. [18]
El VPH se puede transmitir a través de las relaciones sexuales entre mujeres, por lo que aquellas que sólo han tenido relaciones sexuales con otras mujeres deben realizarse pruebas de detección, aunque tienen un riesgo ligeramente menor de cáncer de cuello uterino. [19]
Las pautas sobre la frecuencia de las pruebas de detección varían: por lo general, cada tres a cinco años para aquellas personas que no han tenido frotis anormales previos. [11] Algunas recomendaciones más antiguas sugerían pruebas de detección con una frecuencia de uno a dos años, sin embargo, hay poca evidencia que respalde una detección tan frecuente; la detección anual tiene poco beneficio, pero conduce a un aumento considerable de los costos y a muchos procedimientos y tratamientos innecesarios. [5] Se ha reconocido desde antes de 1980 que la mayoría de las personas pueden ser examinadas con menos frecuencia. [20] En algunas pautas, la frecuencia depende de la edad; por ejemplo, en Gran Bretaña, se recomienda la detección cada tres años para las mujeres menores de 50 años y cada cinco años para las mayores. [21]
Las pruebas de detección deberían interrumpirse alrededor de los 65 años, a menos que exista un historial de resultados anormales en las pruebas o de enfermedad. Probablemente no haya ningún beneficio en realizar pruebas de detección a personas de 60 años o más cuyas pruebas anteriores hayan sido negativas. [13] Si los últimos tres resultados de Papanicolaou de una mujer fueron normales, puede interrumpir las pruebas a los 65 años, según el USPSTF, ACOG, ACS y ASCP; [5] el NHS de Inglaterra dice que a los 64. No es necesario continuar con las pruebas de detección después de una histerectomía completa por enfermedad benigna.
Todavía se recomienda la prueba de Papanicolaou para quienes se vacunaron contra el VPH [11], ya que las vacunas no cubren todos los tipos de VPH que pueden causar cáncer de cuello uterino. Además, la vacuna no protege contra la exposición al VPH antes de la vacunación. [22]
Las mujeres con antecedentes de cáncer de endometrio deben interrumpir las pruebas de Papanicolaou de rutina después de una histerectomía. [14] [23] Es poco probable que otras pruebas detecten la recurrencia del cáncer, pero conllevan el riesgo de dar resultados falsos positivos, lo que daría lugar a pruebas adicionales innecesarias. [14]
Es posible que se necesiten pruebas de Papanicolaou más frecuentes para realizar un seguimiento después de una prueba de Papanicolaou anormal, después del tratamiento por resultados anormales de una prueba de Papanicolaou o una biopsia, o después del tratamiento del cáncer (de cuello uterino, anal, etc.). [24]
La prueba de Papanicolaou, cuando se combina con un programa regular de detección y seguimiento adecuado, puede reducir las muertes por cáncer de cuello uterino hasta en un 80%. [11]
El fracaso de la prevención del cáncer mediante la prueba de Papanicolaou puede ocurrir por muchas razones, incluyendo no hacerse exámenes regulares, falta de seguimiento apropiado de resultados anormales y errores de muestreo e interpretación. [25] En los EE. UU., más de la mitad de todos los cánceres invasivos ocurren en mujeres que nunca se han hecho una prueba de Papanicolaou; un 10 a 20% adicional de los cánceres ocurren en aquellas que no se han hecho una prueba de Papanicolaou en los cinco años anteriores. [ cita requerida ] Aproximadamente una cuarta parte de los cánceres de cuello uterino en los EE. UU. se dieron en personas que tuvieron una prueba de Papanicolaou anormal pero no recibieron un seguimiento apropiado (la paciente no regresó para recibir atención o el médico no realizó las pruebas o el tratamiento recomendados). [ cita requerida ]
No se ha demostrado que el adenocarcinoma de cuello uterino se pueda prevenir con pruebas de Papanicolaou. [25] En el Reino Unido, que tiene un programa de detección mediante pruebas de Papanicolaou, el adenocarcinoma representa aproximadamente el 15% de todos los cánceres de cuello uterino. [26]
Las estimaciones sobre la eficacia del sistema de llamada y recordatorio del Reino Unido varían ampliamente, pero podría prevenir alrededor de 700 muertes por año en el país. [27]
Múltiples estudios han realizado análisis de sensibilidad y especificidad en las pruebas de Papanicolaou. El análisis de sensibilidad captura la capacidad de las pruebas de Papanicolaou para identificar correctamente a las mujeres con cáncer de cuello uterino. Varios estudios han revelado que la sensibilidad de las pruebas de Papanicolaou está entre el 47,19 y el 55,5 %. [28] [29] [30] El análisis de especificidad captura la capacidad de las pruebas de Papanicolaou para identificar correctamente a las mujeres sin cáncer de cuello uterino. Varios estudios han revelado que la especificidad de las pruebas de Papanicolaou está entre el 64,79 y el 96,8 %. [28] [29] [30] Si bien las pruebas de Papanicolaou pueden no ser completamente precisas, siguen siendo una de las herramientas de prevención del cáncer de cuello uterino más efectivas. Las pruebas de Papanicolaou pueden complementarse con pruebas de ADN del VPH. [ cita requerida ]
En la detección de una población general o de bajo riesgo, la mayoría de los resultados de la prueba de Papanicolaou son normales.
En los Estados Unidos, se encuentran alrededor de 2 a 3 millones de resultados anormales en la prueba de Papanicolaou cada año. [31] La mayoría de los resultados anormales son levemente anormales ( ASC-US (típicamente 2 a 5% de los resultados de Papanicolaou) o lesión intraepitelial escamosa de bajo grado ( LSIL ) (alrededor del 2% de los resultados)), lo que indica infección por VPH. [ cita requerida ] Aunque la mayoría de las displasias cervicales de bajo grado regresan espontáneamente sin derivar nunca en cáncer cervical , la displasia puede servir como una indicación de que se necesita una mayor vigilancia.
En un escenario típico, alrededor del 0,5 % de los resultados de la prueba de Papanicolaou son SIL de alto grado ( HSIL ), y menos del 0,5 % de los resultados indican cáncer; entre el 0,2 y el 0,8 % de los resultados indican células glandulares atípicas de significado incierto (AGC-NOS). [ cita requerida ]
A medida que las preparaciones en base líquida (LBP, por sus siglas en inglés) se vuelven un medio común para las pruebas, las tasas de resultados atípicos han aumentado. La tasa media para todas las preparaciones con lesiones intraepiteliales escamosas de bajo grado utilizando LBP fue del 2,9% en 2006, en comparación con una tasa media del 2,1% en 2003. Las tasas para lesiones intraepiteliales escamosas de alto grado (media, 0,5%) y células escamosas atípicas han cambiado poco. [32]
Los resultados anormales se informan según el sistema Bethesda . [33] Incluyen: [31]
También se pueden detectar anomalías endocervicales y endometriales, así como una serie de procesos infecciosos, como la candidiasis , el virus del herpes simple y la tricomoniasis . Sin embargo, no es muy sensible para detectar estas infecciones, por lo que la ausencia de detección en una prueba de Papanicolaou no significa la ausencia de infección. [ cita requerida ]
Las pruebas de Papanicolaou generalmente se pueden realizar durante el embarazo hasta al menos las 24 semanas de edad gestacional . [34] Las pruebas de Papanicolaou durante el embarazo no se han asociado con un mayor riesgo de aborto espontáneo . [34] Un componente inflamatorio se observa comúnmente en las pruebas de Papanicolaou de mujeres embarazadas [35] y no parece ser un riesgo de parto prematuro posterior . [36]
Después del parto, se recomienda esperar 12 semanas antes de hacerse una prueba de Papanicolaou porque la inflamación del cuello uterino causada por el parto interfiere con la interpretación de la prueba. [37]
Los hombres transgénero también suelen correr riesgo de contraer VPH debido a la retención del cuello uterino en la mayoría de los individuos de este subgrupo. [38] [39] Por ello, las directrices profesionales recomiendan que los hombres transgénero se sometan a pruebas de detección de cáncer de cuello uterino de forma rutinaria utilizando métodos como la prueba de Papanicolaou, idénticas a las recomendaciones para las mujeres cisgénero. [40]
Sin embargo, los hombres transgénero tienen tasas más bajas de detección de cáncer de cuello uterino que las mujeres cisgénero. [41] Muchos hombres transgénero informan barreras para recibir atención médica que reafirme su género, [42] [43] incluyendo la falta de cobertura de seguro y el estigma/discriminación [44] [45] durante los encuentros clínicos, y pueden encontrarse con conceptos erróneos del proveedor sobre el riesgo en esta población de cáncer de cuello uterino. Las pruebas de Papanicolaou pueden presentarse a los pacientes como procedimientos de detección de cáncer sin género en lugar de uno específico para el examen de los órganos reproductivos femeninos. Las pruebas de Papanicolaou pueden desencadenar disforia de género en los pacientes y se puede utilizar un lenguaje neutral en cuanto al género al explicar la patogénesis del cáncer debido a la infección, enfatizando la omnipresencia de la infección por VPH independientemente del género. [46]
Las mujeres transgénero que no se han sometido a vaginoplastias no corren riesgo de desarrollar cáncer de cuello uterino porque no tienen cuello uterino. Las mujeres transgénero que se han sometido a vaginoplastias y tienen un neo-cuello uterino o una neo-vagina tienen una pequeña probabilidad de desarrollar cáncer, según la Sociedad Canadiense del Cáncer. [47] Los cirujanos suelen utilizar la piel del pene para crear la nueva vagina y el nuevo cuello uterino, que puede contraer el VPH y provocar cáncer de pene , aunque es considerablemente más raro que el cáncer de cuello uterino. [48] Debido a que el riesgo de este tipo de cáncer es tan bajo, no se ofrece de forma rutinaria la detección del cáncer de cuello uterino a las mujeres con un neo-cuello uterino. [49] [39] [50] [48]

Según los CDC, se deben evitar las relaciones sexuales, las duchas vaginales y el uso de medicamentos vaginales o espuma espermicida durante los 2 días anteriores a la prueba. [51] Varios estudios han demostrado que el uso de una pequeña cantidad de lubricante en gel a base de agua no interfiere, oscurece ni distorsiona la prueba de Papanicolaou. Además, la citología no se ve afectada, ni tampoco algunas pruebas de ETS. [52] Los CDC afirman que las pruebas de Papanicolaou se pueden realizar durante la menstruación . [51] Sin embargo, el NHS recomienda no realizar pruebas de detección de cáncer de cuello uterino durante la menstruación o en los 2 días anteriores y posteriores a ella. [53] Las pruebas de Papanicolaou se pueden realizar durante la menstruación, especialmente si el médico utiliza una prueba a base de líquido; sin embargo, si el sangrado es extremadamente abundante, las células endometriales pueden oscurecer las células cervicales y, si esto ocurre, es posible que sea necesario repetir la prueba en 6 meses. [54]
La prueba de Papanicolaou comienza con la inserción de un espéculo en la vagina, que la abre y permite el acceso al cuello uterino . Luego, el médico recoge una muestra de células de la abertura externa del cuello uterino raspándola con una espátula o un cepillo. [55]
La obtención de una prueba de Papanicolaou no debería causar mucho dolor, [56] pero puede ser incómoda. [57] Afecciones como el vaginismo , la vulvodinia o la estenosis cervical pueden hacer que la inserción del espéculo sea dolorosa. [58] [59]
En una prueba de Papanicolaou convencional, las células se colocan en un portaobjetos de vidrio y se llevan al laboratorio para analizarlas en busca de anomalías. [60]
En ocasiones se utiliza una escoba con mango de plástico en lugar de la espátula o el cepillo. La escoba no es un dispositivo de recolección tan bueno, ya que es mucho menos eficaz para recolectar material endocervical que la espátula y el cepillo. [61] La escoba se utiliza con más frecuencia con el advenimiento de la citología en base líquida , aunque cualquiera de los dos tipos de dispositivo de recolección se puede utilizar con cualquier tipo de citología.
La muestra se tiñe utilizando la técnica de Papanicolaou , en la que los colorantes y ácidos tintóreos son retenidos selectivamente por las células. Las células no teñidas no se pueden ver adecuadamente con un microscopio óptico. Papanicolaou eligió tinciones que resaltaran la queratinización citoplasmática, que en realidad no tiene casi nada que ver con las características nucleares que se utilizan para hacer diagnósticos en la actualidad. [ cita requerida ]
Un único frotis tiene una superficie de 25 x 50 mm y contiene unos pocos cientos de miles de células en promedio. El examen con microscopio óptico se realiza primero con una potencia baja (10x) y luego se cambia a una potencia más alta (40x) al observar hallazgos sospechosos. Las células se analizan con una potencia alta para detectar cambios morfológicos indicativos de malignidad (incluido un núcleo agrandado e irregular, un aumento de la relación núcleo-citoplasma y una cromatina más gruesa e irregular). Se requieren aproximadamente 1000 campos de visión con una potencia de 10x para el examen de una sola muestra, lo que lleva en promedio de 5 a 10 minutos. [62]
En algunos casos, un sistema informático puede preseleccionar las muestras, indicando aquellas que no necesitan ser examinadas por una persona o resaltando áreas que requieren una atención especial. Luego, la muestra suele ser examinada por un citotecnólogo especialmente capacitado y calificado utilizando un microscopio óptico . La terminología para quien examina la muestra varía según el país; en el Reino Unido , el personal se conoce como citotecnólogos , científicos biomédicos (BMS), profesionales avanzados y patólogos . Estos dos últimos se encargan de informar sobre la muestra anormal, que puede requerir una investigación más exhaustiva. [ cita requerida ]
En la última década, ha habido intentos exitosos de desarrollar sistemas automatizados de análisis de imágenes por computadora para la detección. [63] Aunque, en base a la evidencia disponible, no se puede recomendar la implementación de la detección automatizada del cáncer de cuello uterino en un programa nacional de detección, una reciente evaluación de tecnología del Servicio Nacional de Salud concluyó que "probablemente se ha presentado un caso general para el análisis automatizado de imágenes". [64] La automatización puede mejorar la sensibilidad y reducir las muestras insatisfactorias. [65] La FDA ha aprobado dos sistemas que funcionan en laboratorios de referencia de alto volumen, con supervisión humana. [ cita requerida ]


Las pruebas de Papanicolaou examinan comúnmente anomalías epiteliales, como metaplasia, displasia o cambios limítrofes, que pueden ser indicativas de CIN. Los núcleos se tiñen de azul oscuro, las células escamosas se tiñen de verde y las células queratinizadas se tiñen de rosa/naranja. Se pueden observar coilocitos donde hay discariosis (del epitelio). El núcleo de los coilocitos es típicamente irregular, lo que indica una posible causa de preocupación; se requieren más pruebas y exámenes de confirmación.
Además, la prueba del virus del papiloma humano (VPH) se puede realizar según lo indicado para resultados anormales de Papanicolaou, o en algunos casos, se realiza una prueba dual, donde se realizan tanto una prueba de Papanicolaou como una prueba de VPH al mismo tiempo (también llamada prueba conjunta de Papanicolaou). [67]
Se puede tomar una muestra parcial del endocérvix con el dispositivo utilizado para obtener la muestra exocérvico-cervical, pero debido a la anatomía de esta zona, no se puede garantizar que la toma de muestras sea consistente y confiable. Como se pueden tomar muestras de células endocervicales anormales, a quienes las examinan se les enseña a reconocerlas. [ cita requerida ]
El endometrio no se muestrea directamente con el dispositivo que se utiliza para tomar muestras del exocérvix. Las células pueden exfoliarse sobre el cuello uterino y recolectarse desde allí, por lo que, al igual que con las células endocervicales, se pueden reconocer células anormales si están presentes, pero la prueba de Papanicolaou no debe utilizarse como herramienta de detección de malignidad endometrial. [ cita requerida ]
En los Estados Unidos, una prueba de Papanicolaou en sí cuesta entre 20 y 30 dólares, pero los costos de las visitas para hacerse una prueba de Papanicolaou pueden superar los 1.000 dólares, en gran medida porque se agregan pruebas adicionales que pueden ser necesarias o no. [68]
La prueba fue inventada y bautizada en honor al médico griego Georgios Papanikolaou , quien comenzó su investigación en 1923. [69] Aurel Babeș hizo descubrimientos similares de forma independiente en 1927. [70] [71] Sin embargo, el método de Babeș era radicalmente diferente al de Papanikolaou. [69] [72]
La prueba de Papanicolaou fue finalmente reconocida solo después de un artículo destacado en el American Journal of Obstetrics and Gynecology en 1941 por Papanikolaou y Herbert F. Traut, un ginecólogo estadounidense. [69] [73] Una monografía titulada Diagnóstico de cáncer uterino mediante frotis vaginal que publicaron contenía dibujos de las diversas células observadas en pacientes sin enfermedad, condiciones inflamatorias y carcinoma preclínico y clínico. [69] La monografía fue ilustrada por Hashime Murayama , quien más tarde se convirtió en ilustrador del personal de la National Geographic Society . [69] Tanto Papanikolaou como su esposa, Andromachi Papanikolaou , dedicaron el resto de sus vidas a enseñar la técnica a otros médicos y personal de laboratorio. [69]
En el mundo desarrollado, la biopsia cervical guiada por colposcopia se considera el " patrón oro " para diagnosticar anomalías cervicales después de un frotis de Papanicolaou anormal. Otras técnicas como el frotis triple también se realizan después de un frotis de Papanicolaou anormal. [74] El procedimiento requiere un colposcopista capacitado y puede ser costoso de realizar. Sin embargo, los frotis de Papanicolaou son muy sensibles y algunos resultados negativos de la biopsia pueden representar un muestreo insuficiente de la lesión en la biopsia, por lo que la biopsia negativa con citología positiva requiere un seguimiento cuidadoso. [75]
Las técnicas de visualización experimental utilizan luz de banda ancha (p. ej., visualización directa, especuloscopia , cervicografía , inspección visual con ácido acético o con Lugol y colposcopia) y métodos de detección electrónica (p. ej., Polarprobe y espectroscopia in vivo ). Estas técnicas son menos costosas y se pueden realizar con mucho menos entrenamiento. No funcionan tan bien como la prueba de Papanicolaou y la colposcopia. En este momento, estas técnicas no han sido validadas por ensayos a gran escala y no se usan de manera general. [ cita requerida ]
Australia ha utilizado la prueba de Papanicolaou como parte de su programa de detección de cáncer cervical desde su implementación en 1991, que requería que las mujeres mayores de 18 años se hicieran la prueba cada dos años. [76] En diciembre de 2017, Australia suspendió el uso de la prueba de Papanicolaou y la reemplazó con una nueva prueba de VPH que solo se requiere realizar una vez cada cinco años a partir de los 25 años. [77] Medicare cubre los costos de la prueba; sin embargo, si el médico de una paciente no permite la facturación en bloque, es posible que tenga que pagar la cita y luego reclamar el reembolso de Medicare. [78]
Las pruebas de Papanicolaou gratuitas se ofrecieron entre 1974 y 1984, antes de ser reemplazadas por un sistema en el que todas las mujeres mayores de 30 años podían tener el costo de su prueba de Papanicolaou reembolsado por el Seguro Nacional de Salud en 1995. [79] Esta política todavía estaba vigente en 2018 y alentaba a las mujeres a realizarse pruebas de detección al menos cada tres años. [80]
A pesar de ello, el número de personas que se hacen la prueba de Papanicolaou sigue siendo inferior al de países como Australia. Algunos creen que esto se debe a la falta de conocimiento sobre la prueba y su disponibilidad. También se ha descubierto que las mujeres que padecen enfermedades crónicas u otras enfermedades reproductivas tienen menos probabilidades de hacerse la prueba. [81] [82] [83]
A partir de 2020, [update]el NHS mantiene un programa de detección de cáncer de cuello uterino en el que se invita a las mujeres de entre 25 y 49 años a hacerse una prueba de Papanicolaou cada tres años, y a las mujeres mayores de 50 años, cada cinco años. Al igual que Australia, Inglaterra utiliza una prueba de VPH antes de examinar las células que dan positivo mediante la prueba de Papanicolaou. [84] La prueba es gratuita como parte del programa nacional de detección de cáncer de cuello uterino. [85]
El hallazgo de bacterias cocoides en una prueba de Papanicolaou no tiene importancia si los resultados de la prueba son normales y no hay síntomas infecciosos. Sin embargo, si hay suficiente inflamación para ocultar la detección de procesos precancerosos y cancerosos, puede indicar un tratamiento con un antibiótico de amplio espectro para estreptococos y bacterias anaeróbicas (como metronidazol y amoxicilina ) antes de repetir el frotis. Alternativamente, la prueba se repetirá en un momento más temprano de lo que se haría de otra manera. [86] Si hay síntomas de flujo vaginal , mal olor o irritación, la presencia de bacterias cocoides también puede indicar un tratamiento con antibióticos como se mencionó anteriormente. [86]
La ACS y otros han recomendado, desde antes de 1980, que la citología convencional se puede realizar de forma segura hasta cada tres años para la mayoría de las mujeres.