

La citocinesis ( / ˌs aɪ t oʊ k ɪ ˈ n iː s ɪ s / ) es la parte del proceso de división celular y parte de la mitosis durante la cual el citoplasma de una sola célula eucariota se divide en dos células hijas. La división citoplasmática comienza durante o después de las últimas etapas de la división nuclear en la mitosis y la meiosis . Durante la citocinesis, el aparato del huso divide y transporta las cromátidas duplicadas al citoplasma de las células hijas que se separan . De este modo, garantiza que el número y el complemento de cromosomas se mantengan de una generación a la siguiente y que, excepto en casos especiales, las células hijas serán copias funcionales de la célula madre. Después de completar la telofase y la citocinesis, cada célula hija entra en la interfase del ciclo celular .
Las funciones particulares exigen diversas desviaciones del proceso de citocinesis simétrica; por ejemplo, en la ovogénesis en animales, el óvulo ocupa casi todo el citoplasma y los orgánulos . Esto deja muy poco para los cuerpos polares resultantes , que en la mayoría de las especies mueren sin función, aunque sí asumen varias funciones especiales en otras especies. [1] Otra forma de mitosis ocurre en tejidos como el hígado y el músculo esquelético ; omite la citocinesis, lo que produce células multinucleadas ( ver sincitio ).
La citocinesis vegetal se diferencia de la animal en parte por la rigidez de las paredes celulares vegetales. En lugar de que las células vegetales formen un surco de división como el que se desarrolla entre las células hijas animales, se forma en el citoplasma una estructura divisoria conocida como placa celular que crece hasta convertirse en una nueva pared celular duplicada entre las células hijas vegetales. Divide la célula en dos células hijas.
La citocinesis se parece mucho al proceso procariota de fisión binaria , pero debido a las diferencias entre las estructuras y funciones de las células procariotas y eucariotas, los mecanismos difieren. Por ejemplo, una célula bacteriana tiene un cromosoma circular (un solo cromosoma en forma de bucle cerrado), en contraste con los cromosomas lineales , generalmente múltiples, de los eucariotas. En consecuencia, las bacterias no construyen un huso mitótico en la división celular. Además, la duplicación del ADN procariota tiene lugar durante la separación real de los cromosomas; en la mitosis, la duplicación tiene lugar durante la interfase antes de que comience la mitosis, aunque las cromátidas hijas no se separan completamente antes de la anafase .
La palabra "citocinesis" ( /ˌs aɪ t oʊ k aɪ ˈ n iː s ɪ s , -t ə - , -k ə - / [ 2 ] [ 3 ] ) utiliza formas combinadas de cyto- + kine- + -sis , neolatín del latín clásico y griego antiguo , que refleja " célula " y kinesis ( "movimiento, movimiento"). Fue acuñada por Charles Otis Whitman en 1887. [4]
El origen de este término es del griego κύτος ( kytos , un hueco), derivado latino cyto (celular), griego κίνησις ( kínesis , movimiento).
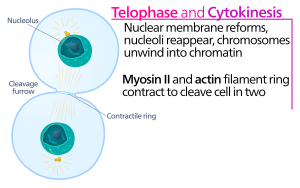
La citocinesis de las células animales comienza poco después del inicio de la separación de las cromátidas hermanas en la anafase de la mitosis . El proceso se puede dividir en los siguientes pasos distintos: reorganización del huso en la anafase, especificación del plano de división, ensamblaje y contracción del anillo de actina-miosina y abscisión. [5] La partición fiel del genoma en células hijas emergentes se asegura mediante la estrecha coordinación temporal de los eventos individuales anteriores mediante vías de señalización molecular.
La citocinesis de las células animales comienza con la estabilización de los microtúbulos y la reorganización del huso mitótico para formar el huso central. El huso central (o zona media del huso ) se forma cuando las fibras de microtúbulos no cinetocóricos se agrupan entre los polos del huso. Varias especies diferentes, incluidas H. sapiens , D. melanogaster y C. elegans, requieren el huso central para realizar la citocinesis de manera eficiente, aunque el fenotipo específico asociado con su ausencia varía de una especie a otra (por ejemplo, ciertos tipos de células de Drosophila son incapaces de formar un surco de división sin el huso central, mientras que tanto en embriones de C. elegans como en células de cultivo de tejido humano se observa que se forma y entra un surco de división, pero luego regresa antes de que se complete la citocinesis). El proceso de reorganización del huso mitótico y la formación del huso central es causado por la disminución de la actividad de CDK1 durante la anafase. [5] La disminución de la actividad de CDK1 en la transición metafase-anafase conduce a la desfosforilación de sitios inhibidores en múltiples componentes del huso central. En primer lugar, la eliminación de una fosforilación de CDK1 de una subunidad del CPC (el complejo pasajero cromosómico) permite su translocalización al huso central desde los centrómeros, donde se encuentra durante la metafase. Además de ser un componente estructural del propio huso central, el CPC también desempeña un papel en la fosforegulación de otros componentes del huso central, incluidos PRC1 (proteína de agrupamiento de microtúbulos necesaria para la citocinesis 1) y MKLP1 (una proteína motora de quinesina). Originalmente inhibida por la fosforilación mediada por CDK1, PRC1 ahora puede formar un homodímero que se une selectivamente a la interfaz entre microtúbulos antiparalelos, lo que facilita la organización espacial de los microtúbulos del huso central. MKLP1, junto con la proteína activadora de GTPasa de la familia Rho CYK-4 (también denominada MgcRacGAP), forma el complejo huso central. El huso central se une al huso central en grupos de orden superior. La formación del grupo huso central se promueve mediante la fosforilación de MLKP1 por Aurora B, un componente de CPC. En resumen, el autoensamblaje del huso central se inicia a través de la fosforegulación de múltiples componentes del huso central por la disminución de la actividad de CDK1, ya sea directa o indirectamente, en la transición de metafase a anafase. El huso central puede tener múltiples funciones en la citocinesis, incluido el control de la posición del surco de división, el suministro de vesículas de membrana al surco de división y la formación de la estructura del cuerpo medio que se requiere para los pasos finales de la división. [6]
El segundo paso de la citocinesis de las células animales implica la especificación del plano de división y la formación del surco citocinético. La colocación precisa del plano de división entre las dos masas de cromosomas segregados es esencial para evitar la pérdida de cromosomas. Mientras tanto, el mecanismo por el cual el huso determina el plano de división en las células animales es quizás el misterio más duradero de la citocinesis y un tema de intenso debate. Existen tres hipótesis de inducción del surco. [6] La primera es la hipótesis de la estimulación astral, que postula que los microtúbulos astrales de los polos del huso llevan una señal inductora del surco a la corteza celular, donde las señales de dos polos se enfocan de alguna manera en un anillo en el huso. Una segunda posibilidad, llamada hipótesis del huso central, es que el surco de división es inducido por un estímulo positivo que se origina en el ecuador del huso central. El huso central puede contribuir a la especificación del plano de división al promover la concentración y activación de la pequeña GTPasa RhoA en la corteza ecuatorial. Una tercera hipótesis es la hipótesis de la relajación astral. Se postula que los haces de actina-miosina activos se distribuyen por toda la corteza celular y que la inhibición de su contracción cerca de los polos del huso da como resultado un gradiente de actividad contráctil que es más alto en el punto medio entre los polos. En otras palabras, los microtúbulos astrales generan una señal negativa que aumenta la relajación cortical cerca de los polos. Estudios genéticos y de micromanipulación láser en embriones de C. elegans han demostrado que el huso envía dos señales redundantes a la corteza celular, una que se origina en el huso central y una segunda señal que se deriva del áster del huso, lo que sugiere la participación de múltiples mecanismos combinados en el posicionamiento del surco de segmentación. El predominio de una señal particular varía entre los tipos de células y los organismos. Y la multitud y redundancia parcial de señales pueden ser necesarias para hacer que el sistema sea robusto y aumentar la precisión espacial. [5]
En el surco de escisión de la citocinesis , es el anillo contráctil de actina-miosina el que impulsa el proceso de escisión, durante el cual la membrana celular y la pared crecen hacia adentro, lo que finalmente comprime la célula madre en dos. Los componentes clave de este anillo son la proteína filamentosa actina y la proteína motora miosina II. El anillo contráctil se ensambla ecuatorialmente (en el medio de la célula) en la corteza celular (adyacente a la membrana celular). La familia de proteínas Rho (proteína RhoA en células de mamíferos) es un regulador clave de la formación y contracción del anillo contráctil en células animales. [6] La vía RhoA promueve el ensamblaje del anillo de actina-miosina por dos efectores principales. Primero, RhoA estimula la nucleación de filamentos de actina no ramificados por activación de forminas relacionadas con Diaphanous. Esta generación local de nuevos filamentos de actina es importante para la formación del anillo contráctil. [6] Este proceso de formación de filamentos de actina también requiere una proteína llamada profilina, que se une a los monómeros de actina y ayuda a cargarlos en el extremo del filamento. En segundo lugar, RhoA promueve la activación de la miosina II por la quinasa ROCK, que activa la miosina II directamente por fosforilación de la cadena ligera de miosina y también inhibe la fosfatasa de miosina por fosforilación de la subunidad MYPT que se dirige a la fosfatasa. Además de actina y miosina II, el anillo contráctil contiene la proteína de andamiaje anilina. La anilina se une a la actina, la miosina, RhoA y CYK-4, y de ese modo vincula la corteza ecuatorial con las señales del huso central. También contribuye a la vinculación del anillo de actina-miosina con la membrana plasmática. Además, la anilina genera fuerzas contráctiles rectificando las fluctuaciones térmicas. [7] También se ha especulado que otra proteína, la septina, sirve como un andamio estructural sobre el cual se organiza el aparato de citocinesis. Después de su ensamblaje, la contracción del anillo de actina-miosina conduce a la ingresión de la membrana plasmática adjunta, que divide el citoplasma en dos dominios de células hermanas emergentes. La fuerza para los procesos contráctiles es generada por movimientos a lo largo de la actina por la proteína motora miosina II. La miosina II usa la energía libre liberada cuando se hidroliza el ATP para moverse a lo largo de estos filamentos de actina, constriñendo la membrana celular para formar un surco de división . La hidrólisis continua hace que este surco de división ingrese (se mueva hacia adentro), un proceso sorprendente que es claramente visible a través de un microscopio óptico .
El surco citocinético penetra hasta que se forma una estructura intermedia (compuesta por material proteínico denso en electrones), donde el anillo de actina-miosina ha alcanzado un diámetro de aproximadamente 1-2 μm. La mayoría de los tipos de células animales permanecen conectados por un puente citocinético intercelular durante varias horas hasta que se dividen mediante un proceso independiente de la actina denominado abscisión, el último paso de la citocinesis. [5] [8]
El proceso de abscisión divide físicamente el cuerpo medio en dos. La abscisión se lleva a cabo mediante la eliminación de las estructuras del citoesqueleto del puente citocinético, la constricción de la corteza celular y la fisión de la membrana plasmática. El puente intercelular está lleno de haces densos de microtúbulos antiparalelos que derivan del huso central. Estos microtúbulos se superponen en el cuerpo medio, que generalmente se considera una plataforma de destino para la maquinaria de abscisión.
La proteína espástina, que corta los microtúbulos , es en gran medida responsable del desmontaje de los haces de microtúbulos dentro del puente intercelular. La constricción cortical completa también requiere la eliminación de las estructuras citoesqueléticas subyacentes. El desmontaje del filamento de actina durante la citocinesis tardía depende del complejo PKCε–14-3-3, que inactiva RhoA después de la intrusión en el surco. El desmontaje de actina está controlado además por la GTPasa Rab35 y su efector, la fosfatidilinositol-4,5-bisfosfato 5-fosfatasa OCRL. El paso final de la abscisión está controlado por el reclutamiento y la polimerización del complejo de clasificación endosómica necesario para el transporte III (ESCRT-III), que sirve para contraer y separar físicamente la membrana plasmática de las dos células hijas contiguas. [9]
La citocinesis debe controlarse temporalmente para garantizar que se produzca solo después de que las cromátidas hermanas se separen durante la parte anafásica de las divisiones celulares proliferativas normales. Para lograr esto, muchos componentes de la maquinaria de citocinesis están altamente regulados para garantizar que puedan realizar una función particular solo en una etapa particular del ciclo celular . [10] [11] La citocinesis ocurre solo después de que APC se une con CDC20. [ cita requerida ] Esto permite que la separación de los cromosomas y la miosina funcionen simultáneamente.
Después de la citocinesis, los microtúbulos no cinetocóricos se reorganizan y desaparecen en un nuevo citoesqueleto a medida que el ciclo celular regresa a la interfase (véase también ciclo celular ).
Debido a la presencia de una pared celular , la citocinesis en las células vegetales es significativamente diferente a la de las células animales. En lugar de formar un anillo contráctil, las células vegetales construyen una placa celular en el medio de la célula. Las etapas de la formación de la placa celular incluyen (1) creación del fragmoplasto , una matriz de microtúbulos que guía y apoya la formación de la placa celular ; (2) tráfico de vesículas al plano de división y su fusión para generar una red tubular-vesicular; (3) fusión continua de túbulos de membrana y su transformación en láminas de membrana tras la deposición de calosa , seguida de la deposición de celulosa y otros componentes de la pared celular ; (4) reciclaje del exceso de membrana y otro material de la placa celular ; y (5) fusión con la pared celular parental [12] [13]
El fragmoplasto se ensambla a partir de los restos del huso mitótico y sirve como vía para el tráfico de vesículas hacia la zona media del fragmoplasto. Estas vesículas contienen lípidos, proteínas y carbohidratos necesarios para la formación de un nuevo límite celular. Los estudios de tomografía electrónica han identificado el aparato de Golgi como la fuente de estas vesículas, [14] [15] pero otros estudios han sugerido que también contienen material endocitado. [16] [17]
Estos túbulos luego se ensanchan y se fusionan lateralmente entre sí, formando finalmente una lámina fenestrada plana [8] . A medida que la placa celular madura, se eliminan grandes cantidades de material de membrana a través de la endocitosis mediada por clatrina [7]. Finalmente, los bordes de la placa celular se fusionan con la membrana plasmática parental , a menudo de manera asimétrica, [18] completando así la citocinesis. Las fenestras restantes contienen hebras de retículo endoplasmático que pasan a través de ellas y se cree que son los precursores de los plasmodesmos [8] .

La construcción de la nueva pared celular comienza dentro del lumen de los túbulos estrechos de la placa celular joven . El orden en el que se depositan los diferentes componentes de la pared celular se ha determinado en gran medida mediante microscopía inmunoelectrónica. Los primeros componentes en llegar son las pectinas , las hemicelulosas y las proteínas arabinogalactano transportadas por las vesículas secretoras que se fusionan para formar la placa celular. [19] El siguiente componente que se agrega es la calosa , que se polimeriza directamente en la placa celular por las sintasas de calosa. A medida que la placa celular continúa madurando y se fusiona con la membrana plasmática parental, la calosa se reemplaza lentamente con celulosa , el componente principal de una pared celular madura [6] . La lámina media (una capa similar al pegamento que contiene pectina) se desarrolla a partir de la placa celular, que sirve para unir las paredes celulares de las células adyacentes. [20] [21]
La intrusión del surco citocinético es impulsada por la ATPasa de miosina tipo II . Dado que las miosinas se reclutan en la región medial, las fuerzas contráctiles que actúan sobre la corteza se asemejan a una constricción en forma de "bolsa de tabaco" que tira hacia adentro. Esto conduce a la constricción hacia adentro. La membrana plasmática en virtud de su estrecha asociación con la corteza a través de proteínas reticulantes [22] Para la constricción del surco de división, el área de superficie total debe aumentarse suministrando la membrana plasmática a través de la exocitosis. [23]
Los modelos teóricos muestran que la constricción simétrica requiere tanto fuerzas de estabilización lateral como de constricción. [24] La reducción de la presión externa y de la tensión superficial (por tráfico de membrana) reduce las fuerzas de estabilización y constricción requeridas.
CEP55 es una fosfoproteína mitótica que desempeña un papel clave en la citocinesis, la etapa final de la división celular. [25] [26]
En algunos casos, una célula puede dividir su material genético y crecer en tamaño, pero no logra realizar la citocinesis. Esto da como resultado células más grandes con más de un núcleo. Por lo general, se trata de una aberración no deseada y puede ser un signo de células cancerosas. [27]