
La bioimpresión tridimensional ( 3D ) es la utilización de técnicas similares a la impresión 3D para combinar células , factores de crecimiento , biotintas y biomateriales para fabricar estructuras funcionales que se utilizaban tradicionalmente para aplicaciones de ingeniería de tejidos , pero que en los últimos tiempos han visto un mayor interés en otras aplicaciones como biodetección y remediación ambiental . [1] [2] [3] Generalmente, la bioimpresión 3D utiliza un método capa por capa para depositar materiales conocidos como biotintas para crear estructuras similares a tejidos que luego se utilizan en diversos campos médicos y de ingeniería de tejidos. [4] [5] La bioimpresión 3D cubre una amplia gama de técnicas de bioimpresión y biomateriales. Actualmente, la bioimpresión se puede utilizar para imprimir modelos de tejidos y órganos para ayudar en la investigación de fármacos y tratamientos potenciales. [6] Sin embargo, la traducción de construcciones celulares vivas bioimpresas a aplicaciones clínicas se enfrenta a varios problemas debido a la complejidad y el número de células necesarias para crear órganos funcionales. [7] Sin embargo, las innovaciones abarcan desde la bioimpresión de matriz extracelular hasta la mezcla de células con hidrogeles depositados capa por capa para producir el tejido deseado. [8] Además, la bioimpresión 3D ha comenzado a incorporar la impresión de andamios que pueden usarse para regenerar articulaciones y ligamentos. [9] Aparte de estos, la bioimpresión 3D se ha utilizado recientemente en aplicaciones de remediación ambiental, incluida la fabricación de biopelículas funcionales que albergan microorganismos funcionales que pueden facilitar la eliminación de contaminantes. [10]
La bioimpresión 3D generalmente sigue tres pasos: prebioimpresión, bioimpresión y posbioimpresión. [11] [12]
La prebioimpresión es el proceso de creación de un modelo que luego creará el impresor y elección de los materiales que se utilizarán. Uno de los primeros pasos es obtener una biopsia del órgano para tomar muestras de células. Las tecnologías comunes utilizadas para la bioimpresión son la tomografía computarizada (CT) y la resonancia magnética (MRI). Para imprimir con un enfoque capa por capa, se realiza una reconstrucción tomográfica de las imágenes. Las imágenes ahora 2D se envían a la impresora para su creación. Una vez creada la imagen, ciertas celdas se aíslan y se multiplican. [11] Estas células luego se mezclan con un material licuado especial que proporciona oxígeno y otros nutrientes para mantenerlas vivas. Esta agregación de células no requiere un andamio y es necesaria para colocarla en la fusión de tejido de tipo tubular para procesos como la extrusión. [13] : 165
En el segundo paso, las mezclas líquidas de células, matriz y nutrientes conocidas como biotintas se colocan en un cartucho de impresora y se depositan mediante los escáneres médicos de los pacientes. [14] Cuando un pretejido bioimpreso se transfiere a una incubadora, este pretejido a base de células madura hasta convertirse en un tejido.
La bioimpresión 3D para fabricar construcciones biológicas normalmente implica dispensar células en un andamio biocompatible utilizando un enfoque sucesivo capa por capa para generar estructuras tridimensionales similares a tejidos. [15] Se ha demostrado que los órganos artificiales como el hígado y los riñones fabricados mediante bioimpresión 3D carecen de elementos cruciales que afectan al cuerpo, como los vasos sanguíneos funcionales, los túbulos para recolectar la orina y el crecimiento de miles de millones de células necesarias para estos órganos. Sin estos componentes, el cuerpo no tiene forma de obtener los nutrientes esenciales y el oxígeno de su interior. [15] Dado que cada tejido del cuerpo está compuesto naturalmente por diferentes tipos de células, muchas tecnologías para imprimir estas células varían en su capacidad para garantizar la estabilidad y viabilidad de las células durante el proceso de fabricación. Algunos de los métodos que se utilizan para la bioimpresión 3D de células son la fotolitografía , la bioimpresión 3D magnética , la estereolitografía y la extrusión celular directa. [13] : 196
El proceso posterior a la bioimpresión es necesario para crear una estructura estable a partir del material biológico. Si este proceso no se mantiene bien, la integridad mecánica y la función del objeto impreso en 3D están en riesgo. [11] Para mantener el objeto, se necesitan estimulaciones tanto mecánicas como químicas. Estas estimulaciones envían señales a las células para controlar la remodelación y el crecimiento de los tejidos. Además, en desarrollos recientes, las tecnologías de biorreactores [16] han permitido la rápida maduración de los tejidos, la vascularización de los tejidos y la capacidad de sobrevivir a los trasplantes. [12]
Los biorreactores funcionan proporcionando transporte convectivo de nutrientes, creando entornos de microgravedad, cambiando la presión que hace que la solución fluya a través de las células o agregando compresión para una carga dinámica o estática. Cada tipo de biorreactor es ideal para diferentes tipos de tejido, por ejemplo los biorreactores de compresión son ideales para tejido cartilaginoso. [13] : 198
Los investigadores en este campo han desarrollado enfoques para producir órganos vivos construidos con las propiedades biológicas y mecánicas apropiadas. La bioimpresión 3D se basa en tres enfoques principales: biomímesis, autoensamblaje autónomo y bloques de construcción de minitejidos. [17]
El primer enfoque de la bioimpresión se llama biomímesis. El objetivo principal de este enfoque es crear estructuras fabricadas que sean idénticas a la estructura natural que se encuentra en los tejidos y órganos del cuerpo humano. La biomímesis requiere la duplicación de la forma, la estructura y el microambiente de los órganos y tejidos. [18] La aplicación de la biomímesis en la bioimpresión implica la creación de partes celulares y extracelulares idénticas de órganos. Para que este enfoque tenga éxito, los tejidos deben replicarse a microescala. Por lo tanto, es necesario comprender el microambiente, la naturaleza de las fuerzas biológicas en este microambiente, la organización precisa de los tipos de células funcionales y de soporte, los factores de solubilidad y la composición de la matriz extracelular. [17]
El segundo enfoque de la bioimpresión es el autoensamblaje autónomo. Este enfoque se basa en el proceso físico de desarrollo de órganos embrionarios como modelo para replicar los tejidos de interés. [18] Cuando las células se encuentran en su desarrollo temprano, crean su propia matriz extracelular, la señalización celular adecuada y una disposición y patrón independientes para proporcionar las funciones biológicas y la microarquitectura requeridas. [17] El autoensamblaje autónomo exige información específica sobre las técnicas de desarrollo de los tejidos y órganos del embrión. [18] Existe un modelo "sin andamio" que utiliza esferoides autoensamblados que se someten a fusión y disposición celular para parecerse a tejidos en evolución. El autoensamblaje autónomo depende de la célula como motor fundamental de la histogénesis, guiando los componentes básicos y las propiedades estructurales y funcionales de estos tejidos. Exige una comprensión más profunda de cómo se desarrollan los mecanismos de los tejidos embrionarios, así como del microambiente rodeado para crear los tejidos bioimpresos. [17]
El tercer enfoque de la bioimpresión es una combinación de los enfoques de biomímesis y autoensamblaje, llamados mini tejidos. Los órganos y tejidos se construyen a partir de componentes funcionales muy pequeños. El enfoque de minitejido toma estas pequeñas piezas y las organiza en una estructura más grande. [18] [17]

Al igual que las impresoras de tinta comunes, las bioimpresoras tienen tres componentes principales. Estos son el hardware utilizado, el tipo de biotinta y el material en el que se imprime (biomateriales). [11] La biotinta es un material elaborado a partir de células vivas que se comporta de forma muy parecida a un líquido, lo que permite a las personas "imprimirlo" para crear la forma deseada. Para producir biotinta, los científicos crean una mezcla de células que se pueden cargar en un cartucho e insertar en una impresora especialmente diseñada, junto con otro cartucho que contiene un gel conocido como biopapel". [19] En la bioimpresión, hay tres Los principales tipos de impresoras que se han utilizado son las de inyección de tinta, las asistidas por láser y las de extrusión. Las impresoras de inyección de tinta se utilizan principalmente en la bioimpresión para productos rápidos y a gran escala. , imprime materiales en cantidades exactas, minimizando costos y desperdicios. [20] Las impresoras que utilizan láser brindan impresión de alta resolución; sin embargo, estas impresoras suelen ser costosas para imprimir celdas capa por capa, al igual que la impresión 3D . Además de las células, las impresoras de extrusión también pueden utilizar hidrogeles infundidos con células [11] .
La impresión basada en extrusión es una técnica muy común dentro del campo de la impresión 3D que implica extruir o forzar un flujo continuo de material sólido derretido o líquido viscoso a través de una especie de orificio, a menudo una boquilla o jeringa. [21] Cuando se trata de bioimpresión basada en extrusión, existen cuatro tipos principales de extrusión. Estas son de accionamiento neumático, de pistón, de tornillo y de tornillo excéntrico (también conocidas como bombas de cavidad progresiva). Cada método de extrusión tiene sus propias ventajas y desventajas. La extrusión neumática utiliza aire presurizado para forzar la biotinta líquida a través de un agente depositante. Los filtros de aire se utilizan comúnmente para esterilizar el aire antes de su uso, para garantizar que el aire que empuja la biotinta no esté contaminado. [22] La extrusión impulsada por pistón utiliza un pistón conectado a un tornillo guía. El movimiento lineal del pistón expulsa el material de la boquilla. La extrusión accionada por tornillo utiliza un tornillo sinfín para extruir material mediante un movimiento de rotación. [23] Los dispositivos accionados por tornillo permiten el uso de materiales de mayor viscosidad y proporcionan un mayor control volumétrico. [21] Los sistemas accionados por tornillos excéntricos permiten una deposición mucho más precisa de materiales de baja a alta viscosidad debido a las cámaras autosellantes en la extrusora. [24] Una vez impresos, muchos materiales requieren un paso de reticulación para lograr las propiedades mecánicas deseadas para la construcción, lo que se puede lograr, por ejemplo, con el tratamiento de agentes químicos o foto-reticulantes.
La extrusión directa es una de las técnicas de bioimpresión basadas en extrusión más comunes, en la que la fuerza presurizada dirige la biotinta para que fluya fuera de la boquilla e imprima directamente el andamio sin necesidad de moldear. [25] La biotinta en sí para este enfoque puede ser una mezcla de hidrogeles poliméricos, materiales de origen natural como el colágeno y células vivas suspendidas en la solución. [25] De esta manera, los andamios se pueden cultivar después de la impresión y sin la necesidad de un tratamiento adicional para la siembra celular. Parte del enfoque en el uso de técnicas de impresión directa se basa en el uso de conjuntos de boquillas coaxiales o extrusión coaxial. La configuración de la boquilla coaxial permite la extrusión simultánea de múltiples biotintas de material, capaces de crear andamios de múltiples capas en un solo paso de extrusión. [26] El desarrollo de estructuras tubulares ha encontrado que la extrusión en capas lograda a través de estas técnicas es deseable por la variabilidad radial en la caracterización del material que puede ofrecer, ya que la boquilla coaxial proporciona un tubo interno y externo para el flujo de biotinta. [26] Las técnicas de extrusión indirecta para la bioimpresión requieren más bien la impresión de un material base de hidrogeles cargados de células, pero a diferencia de la extrusión directa, contienen un hidrogel de sacrificio que puede eliminarse trivialmente después de la impresión mediante extracción térmica o química. [27] La resina restante se solidifica y se convierte en la construcción impresa en 3D deseada.
La bioimpresión basada en láser se puede dividir en dos clases principales: las basadas en tecnologías de transferencia celular o la fotopolimerización . En la impresión láser por transferencia celular, un láser estimula la conexión entre el material que absorbe energía (p. ej., oro, titanio, etc.) y la biotinta. Esta "capa donante" se vaporiza bajo la irradiación del láser, formando una burbuja a partir de la capa de biotinta que se deposita mediante un chorro. [28] Las técnicas de fotopolimerización más bien utilizan reacciones fotoiniciadas para solidificar la tinta, moviendo la trayectoria del haz de un láser para inducir la formación de una construcción deseada. Ciertas frecuencias de láser combinadas con reacciones de fotopolimerización se pueden llevar a cabo sin dañar las células del material.
En esta forma de impresión, los residuos de plástico se funden y se colocan en capas individuales en secciones para crear la forma deseada. El nailon y el PVA son ejemplos de biomateriales utilizados en este método. Esta técnica se utiliza con mayor frecuencia para diseñar prototipos para prótesis y construcción de cartílago. [29]
Otra forma de bioimpresión implica una impresora de inyección de tinta, que se utiliza principalmente en entornos biomédicos. Este método imprime proteínas y ácidos nucleicos detallados. [29] Los hidrogeles se seleccionan comúnmente como biotinta. Las células se pueden imprimir en un medio de superficie seleccionado para proliferar y, en última instancia, diferenciarse. Un inconveniente de este método de impresión es la capacidad de las biotintas, como los hidrogeles, de obstruir la boquilla de impresión, debido a su alta viscosidad. [29] La bioimpresión por inyección de tinta ideal implica el uso de una baja viscosidad del polímero (idealmente por debajo de 10 centipoises), baja densidad celular (<10 millones de células/mL) y alturas estructurales bajas (<10 millones de células/mL). [30]
Existen otras técnicas de bioimpresión que se utilizan con menos frecuencia. La bioimpresión basada en gotas es una técnica en la que la mezcla de células y/o hidrogeles de biotinta se coloca en gotas en posiciones precisas. Las más comunes entre este enfoque son las técnicas térmicas y piezoeléctricas de caída bajo demanda. [31] Este método de bioimpresión se utiliza a menudo de forma experimental con modelos de cáncer de pulmón y de ovario. [32] Las tecnologías térmicas utilizan señales de corta duración para calentar la biotinta, induciendo la formación de pequeñas burbujas que son expulsadas. La bioimpresión piezoeléctrica tiene una corriente de corta duración aplicada a un actuador piezoeléctrico , que induce una vibración mecánica capaz de expulsar un pequeño glóbulo de biotinta a través de la boquilla. Un aspecto importante del estudio de los enfoques de bioimpresión basados en gotas es tener en cuenta las células de estrés mecánico y térmico dentro de la experiencia de la biotinta cerca de la punta de la boquilla a medida que se extruyen.
Las biotintas son componentes esenciales del proceso de bioimpresión. Están compuestos de células vivas y suplementos enzimáticos para nutrir un entorno que respalde las necesidades biológicas del tejido impreso. [33] El entorno creado por la biotinta permite que la célula se adhiera, crezca y se diferencie hasta su forma adulta. [33] Los hidrogeles que encapsulan células se utilizan en métodos de bioimpresión basados en extrusión, mientras que la gelatina metacriloilgelatina metacrilón (GelMA) y las biotintas compuestas acelulares se utilizan con mayor frecuencia en técnicas de ingeniería de tejidos que requieren enlaces cruzados e integridad estructural precisa. [33] Es esencial que las biotintas ayuden a replicar el entorno externo de la matriz celular en el que se produciría naturalmente la célula.
La bioimpresión 3D se puede utilizar para reconstruir tejido de diversas regiones del cuerpo. El precursor de la adopción de la impresión 3D en la atención sanitaria fue una serie de ensayos realizados por investigadores del Boston Children's Hospital. El equipo construyó a mano vejigas urinarias de reemplazo para siete pacientes mediante la construcción de andamios, luego los colocó en capas con células de los pacientes y les permitió crecer. Los ensayos fueron un éxito ya que los pacientes mantuvieron su buena salud 7 años después de la implantación, lo que llevó a un investigador llamado Anthony Atala, MD, a buscar formas de automatizar el proceso. [34] Los pacientes con enfermedad de la vejiga en etapa terminal ahora pueden ser tratados utilizando tejidos de vejiga creados mediante bioingeniería para reconstruir el órgano dañado. [35] Esta tecnología también se puede aplicar potencialmente a huesos, piel, cartílagos y tejidos musculares. [36] Aunque un objetivo a largo plazo de la tecnología de bioimpresión 3D es reconstruir un órgano completo y minimizar el problema de la falta de órganos para trasplante. [37] Ha habido poco éxito en la bioimpresión de órganos completamente funcionales, por ejemplo, hígado, piel, menisco o páncreas. [38] [39] [40] A diferencia de los stents implantables, los órganos tienen formas complejas y son significativamente más difíciles de bioimprimir. Un corazón bioimpreso, por ejemplo, no sólo debe cumplir requisitos estructurales, sino también de vascularización, carga mecánica y propagación de señales eléctricas. [41] En 2022, se informó del primer éxito de un ensayo clínico para un trasplante bioimpreso en 3D que se elabora a partir de las propias células del paciente, un oído externo para tratar la microtia , [42] . [43]
La bioimpresión 3D contribuye a avances significativos en el campo médico de la ingeniería de tejidos al permitir la investigación de materiales innovadores llamados biomateriales . Algunas de las sustancias más notables obtenidas mediante bioingeniería suelen ser más fuertes que los materiales corporales promedio, incluidos los tejidos blandos y los huesos. Estos componentes pueden actuar como futuros sustitutos, e incluso mejoras, de los materiales originales de la carrocería. Además, la Agencia de Reducción de Amenazas de Defensa pretende imprimir miniórganos como corazones, hígados y pulmones como potencial para probar nuevos medicamentos con mayor precisión y tal vez eliminar la necesidad de realizar pruebas en animales. [14]
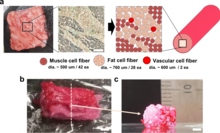
La bioimpresión también se puede utilizar para carne cultivada . En 2021, se produjo una carne cultivada parecida a un filete, compuesta por tres tipos de fibras de células bovinas. La carne de vacuno Wagyu tiene una estructura similar a la carne original. [44] [45] Esta tecnología proporciona una alternativa a los métodos naturales de recolección de carne si la industria ganadera está plagada de enfermedades. Además, proporciona una posible solución para reducir el impacto ambiental de la industria ganadera.
La biorremediación utiliza microorganismos o, en los últimos tiempos, materiales de origen biológico, como enzimas , biocompuestos , biopolímeros o nanopartículas , para degradar bioquímicamente los contaminantes en sustancias inofensivas, lo que la convierte en una alternativa rentable y respetuosa con el medio ambiente; La bioimpresión 3D facilita la fabricación de estructuras funcionales utilizando estos materiales que mejoran los procesos de biorremediación, lo que genera un interés significativo en la aplicación de construcciones bioimpresas en 3D para mejorar la biorremediación. [3]
La bioimpresión de biopelículas utiliza los mismos métodos que otras bioimpresión. A menudo, la biopelícula comienza con la extrusión de un polisacárido para proporcionar estructura para el crecimiento de la biopelícula. Un ejemplo de uno de estos polisacáridos es el alginato. La estructura de alginato puede tener microbios incrustados dentro de la estructura. [46] Los hidrogeles también se pueden utilizar para ayudar en la formación de biopelículas funcionales. [2] Las biopelículas son difíciles de analizar en un laboratorio debido a su estructura compleja y al tiempo que tarda en formarse una biopelícula funcional. La bioimpresión de biopelículas 3D nos permite saltarnos ciertos procesos y facilita el análisis de biopelículas funcionales. [46] El espesor de la biopelícula que se imprime cambia la funcionalidad debido a la difusión de nutrientes y oxígeno. Las biopelículas impresas en 3D más gruesas seleccionarán naturalmente a los anaerobios, por ejemplo. [47]
Las biopelículas son capaces de remediarse en el entorno natural, lo que sugiere que existe potencial con respecto al uso de biopelículas bioimpresas en 3D en la remediación ambiental . [48] Los microbios son capaces de degradar una amplia gama de productos químicos y metales y es beneficioso proporcionar una estructura para que estos microbios florezcan, como en las estructuras de biopelículas. [49] Las biopelículas artificiales protegen a los microbios de los peligros del medio ambiente al tiempo que promueven la señalización y las interacciones microbianas en general. [50] La bioimpresión 3D permite colocar microorganismos funcionales en estructuras que les proporcionan estabilidad mecánica y los protegen de las condiciones ambientales. [10] [3] El área de contacto más grande proporcionada por las estructuras impresas en 3D en comparación con las estructuras ambientales normales proporciona una eliminación más eficiente de contaminantes. [10] [3]
La bioimpresión también tiene posibles usos en el futuro para ayudar en el tratamiento de aguas residuales y en el control de la corrosión. [46] Cuando los humanos entran en contacto con biopelículas ambientales, es posible que se produzcan infecciones y riesgos para la salud a largo plazo. [50] La penetración y expansión de antibióticos dentro de una biopelícula es un área de investigación que puede beneficiarse de las técnicas de bioimpresión, para explorar más a fondo el efecto de las biopelículas ambientales en la salud humana. [10] La impresión de biopelículas requiere más investigación debido a los datos publicados limitados y a los protocolos complejos.