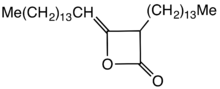
Los dímeros de alquilceteno (AKD) son una familia de compuestos orgánicos basados en el sistema de anillos de 4 miembros de la oxetan-2-ona , que también es el elemento estructural central de la propiolactona y la dicetena . Al anillo de oxetano de los dímeros de alquilceteno técnicamente relevantes se une un grupo alquilo C 12 – C 16 en la posición 3 y un grupo alquilideno C 13 – C 17 en la posición 4.
La principal aplicación de los dímeros de cetena alquilados es en el encolado de papel y cartón , así como en la hidrofobación de fibras de celulosa . Los productos así modificados se caracterizan por una mayor resistencia mecánica y una menor penetración de agua, tintas o tintas de impresión . [1]
Los AKD presentan grupos alquilo hidrófobos que se extienden desde un anillo de beta-propiolactona . Un ejemplo específico se deriva de la dimerización de la cetena del ácido esteárico . Esta cetena se genera por pirólisis de cloruro de estearoilo. [2] Los AKD reaccionan con los grupos hidroxilo de la celulosa mediante una reacción de esterificación . La esterificación es competitiva con la hidrólisis del AKD. Antes del desarrollo de los AKD, la hidrofobicidad se impartía incorporando colofonia al papel. [3]
Relacionado con las AKD está el anhídrido alquenilsuccínico (ASA). En cuanto a los AKD, el ASA reacciona con los grupos hidroxi de la celulosa para formar un éster, anclando el grupo hidrofóbico a la superficie. El ASA se prepara mediante la reacción eno de hidrocarburos insaturados con anhídrido maleico . [4]
En 1901, Edgar Wedekind publicó la síntesis de dímeros de alquilceteno mediante la reacción de cloruros de ácido carboxílico con aminas terciarias : [5] [6]
RCH 2 COCl + R 3 N → RCH=C=O + R 3 NHCl El peso molecular determinado por los primeros investigadores indicó (CH 3 ) 2 CH=C=O ) n donde n > 1 para la deshidrohalogenación del cloruro de isobutirilo con trietilamina . [7] [8]

Los productos de reacción primaria de cloruros de ácido con átomos de hidrógeno en posición α y aminas terciarias fueron identificados por Hermann Staudinger [9] [10] y Norman Thomas Mortimer Wilsmore [11] como cetenas (etenonas) altamente reactivas que forman 2-oxetanonas con una grupo alquilideno cuando se dimeriza en una fotocicloadición [2+2] .
La idea de Staudinger se vio complicada por la dependencia de la dimerización de los sustituyentes. La cetena simple (H 2 C = C = O) se dimeriza a dicetena (4-metilen-oxetan-2-ona), mientras que las cetenas sustituidas, como el dimetil ceteno (Me 2 C = C = O, se forma a partir de cloruro de isobutirilo con trietilamina. ) dimerizar en una adición de cabeza a cola a 2,2,4,4-tetrametilciclobutanodiona . [7] [12]
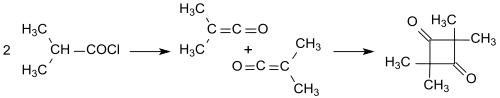
La 2,2,4,4,4-tetrametilciclobutanodiona se puede isomerizar fácilmente a dímero de dimetilcetena (4-isopropiliden-3,3-dimetil-oxetan-2-ona). [13]
La síntesis y caracterización del dímero de hexadecilceteno, una sustancia clave para los dímeros de ceteno alquilados, se describió por primera vez en una patente [14] en 1945 y en una publicación [15] en 1947.
La síntesis industrial de cetendímeros alquilados (en aquel momento todavía llamados cetoetenonas) fue patentada en 1945 a partir de cloruros de ácidos carboxílicos de cadena larga en disolventes inertes (como el éter dietílico o el benceno ) con trietilamina como amina terciaria en condiciones anhidras. Después de la filtración del clorhidrato de trietilamina insoluble y la evaporación del disolvente, se obtienen dímeros de cadena alquílica de cadena larga con rendimientos superiores al 90%. [14]
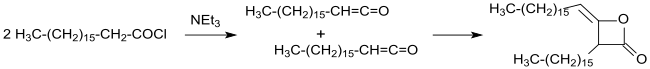
El uso de otros disolventes, como ésteres de ácido carboxílico o cetonas para una separación más fácil de clorhidratos de trialquilamina u otras aminas, como N,N,N',N'- tetrametil-hexano-1,6-diamina [16] no proporciona alguna ventaja significativa.
También se describen procedimientos sin el uso de disolventes, en los que el clorhidrato de amina resultante se filtra o se extrae con ácidos acuosos diluidos. [17]
Un proceso continuo en el que el cloruro de ácido carboxílico de cadena larga y la amina terciaria (por ejemplo, dimetilisopropilamina, dimetilciclohexilamina o trietilamina) se suministran por separado sin disolventes a un reactor tubular, amasadora o preferiblemente a una extrusora de doble tornillo o extrusora de rodillos planetarios y se hacen reaccionar a temperaturas entre 90 y 110 °C, proporciona contenidos de lactona superiores al 90 % en tiempos de reacción cortos. El procesamiento se lleva a cabo mediante separación de fases o extracción ácida. [18]
Los problemas con el encolado en masa ácido (mediado por sulfato de aluminio) del papel con resinas de colofonia digeridas alcalinas introducidas desde principios del siglo XIX llevaron, además del uso de floculantes alcalinos (como tiza o carbonato de calcio como reserva alcalina), a la búsqueda de Materiales alternativos para dimensionamiento en ambiente neutro o alcalino. Además de los anhídridos alquenilsuccínicos significativamente más reactivos (que también se hidrolizan rápidamente en presencia de agua), los dímeros de cetena alquilados han comenzado a ser los tamaños de superficie y masa preferidos en la industria del papel desde la década de 1960 en adelante, comenzando en la década de 1950. [19]

Los AKD aplicados industrialmente se derivan de ácidos grasos con longitudes de cadena entre C14 ( ácido mirístico ) y C22 ( ácido behénico ); Preferentemente se utilizan palmitil (C16) dicetena y estearil (C18) cetena y sus mezclas, así como mezclas de ácidos grasos procedentes de la hidrólisis de grasas animales y vegetales. Debido a la longitud de la cadena de los ácidos grasos originales, los AKD son sólidos cerosos con puntos de fusión entre 42 y aproximadamente 70 °C. Las mezclas de dímeros de cetena alquilados y agua son dispersiones a temperaturas inferiores a 40 °C o emulsiones a temperaturas superiores a 45 °C. Los AKD líquidos no se utilizan mucho, se basan en ácidos grasos insaturados como el ácido oleico o ácidos grasos ramificados, como el ácido isoesteárico.
Las dispersiones acuosas de alquildiceteno contienen generalmente entre un 10 y un 20 % en peso de AKD, así como coloides protectores activos (particularmente policationes como almidón catiónico, copolímeros de N -vinilpirrolidona y N -vinilimidazol cuaternizado , polietileniminas aciladas o poliacrilamidas catiónicas de alto peso molecular con una molar promedio). masa hasta 7 millones g/mol) y otros estabilizadores (normalmente tensioactivos aniónicos, por ejemplo ligninsulfonatos o productos de condensación de la sal sódica del ácido naftalenosulfónico y formaldehído ). [20] Estas dispersiones estabilizadas de AKD son activas y estables a temperatura ambiente durante hasta tres meses y también toleran la adición de diferentes cargas para papel o cartón (por ejemplo, caolín , tiza, talco, dióxido de titanio , sulfato de calcio , óxido de aluminio, etc. ) del 5 al 25%. Las cantidades de dímeros de alquilceteno utilizadas para el apresto de papel y productos de papel están preferiblemente en el rango de 0,15 a 0,8% en peso, a veces de 0,05 a 0,2% en peso, [18] basado en el material de papel seco.
Para el dimensionamiento del papel con AKD, se propuso un proceso de tres pasos que, a pesar de las discusiones controvertidas de la década de 1990, parece describir mejor los procesos que se están llevando a cabo y explica los resultados obtenidos. [21] Los criterios decisivos para la calidad de la hidrofobicidad de los papeles son

La estructura molecular (es decir, masa molar y grado de reticulación), la densidad de carga molar de los grupos catiónicos, la dosificación exacta del polímero catiónico como estabilizador de dispersión y coadyuvante de retención, así como el mantenimiento de otros parámetros del proceso como temperatura, pH y Los tiempos de residencia son cruciales.
Después de eliminar el exceso de agua - también para evitar la hidrólisis del AKD al beta-cetoácido y la posterior descarboxilación a la cetona -

Sigue el craqueo de las partículas de AKD estabilizadas sobre la masa de papel base, la fusión de la cera AKD sólida (a aprox. 90 °C), la dispersión de la cera AKD líquida por difusión superficial sobre las fibras de celulosa y la formación de fibras hidrofóbicas cerradas. capas. El espesor de las capas hidrófobas depende de la concentración de AKD en la dispersión. [22]
Anuncio 3. La hidrofobación de fibras de celulosa con dímeros de cetena alquilados se realiza de forma más eficaz en medios neutros o preferentemente débilmente alcalinos (pH 7,5-9,0). La temperatura de reacción es generalmente de 90-110 °C, reaccionando aproximadamente el 40% del AKD utilizado con la celulosa. [21] Después de la reacción, se miden ángulos de contacto de >100°, lo que indica el carácter hidrofóbico de las superficies del modelo modificado con AKD. La esterificación de grupos hidroxilo de fibras de celulosa también se demostró mediante reacciones de comparación con AKD marcado con 14 C. [21]
El encolado con AKD es adecuado para la hidrofobización permanente de periódicos, papel de impresión y escritura y cartón utilizado como recipiente para líquidos (incluidos alimentos como la leche), así como para mejorar la estabilidad de la forma y la manejabilidad.