El virus de Epstein-Barr ( VEB ), formalmente llamado gammaherpesvirus humano 4 , es uno de los nueve tipos conocidos de herpesvirus humanos de la familia del herpes y es uno de los virus más comunes en los seres humanos. El VEB es un virus de ADN de doble cadena . [2] El virus de Epstein-Barr (VEB) es el primer virus oncogénico identificado , es decir, un virus que puede causar cáncer . El VEB establece una infección permanente en los seres humanos. Provoca mononucleosis infecciosa y también está estrechamente relacionado con muchas enfermedades malignas (cánceres). Varias formulaciones de vacunas se sometieron a pruebas en diferentes animales o en seres humanos. Sin embargo, ninguna de ellas pudo prevenir la infección por VEB y hasta la fecha no se ha aprobado ninguna vacuna. [3]
La mononucleosis infecciosa ("mono" o "fiebre glandular"), una enfermedad causada por el virus, se caracteriza por fatiga extrema, fiebre, dolor de garganta y ganglios linfáticos inflamados. El virus también está asociado con varias enfermedades linfoproliferativas no malignas, premalignas y malignas asociadas al virus de Epstein-Barr, como el linfoma de Burkitt , la linfohistiocitosis hemofagocítica [4] y el linfoma de Hodgkin ; neoplasias malignas no linfoides como el cáncer gástrico y el carcinoma nasofaríngeo ; y afecciones asociadas con el virus de la inmunodeficiencia humana, como la leucoplasia pilosa y los linfomas del sistema nervioso central . [5] [6] El virus también está asociado con los trastornos infantiles del síndrome de Alicia en el país de las maravillas [7] y la ataxia cerebelosa aguda [8] y, según algunas evidencias, con mayores riesgos de desarrollar ciertas enfermedades autoinmunes , [9] especialmente dermatomiositis , lupus eritematoso sistémico , artritis reumatoide y síndrome de Sjögren . [10] [11] Se cree que alrededor de 200.000 casos de cáncer a nivel mundial por año son atribuibles al VEB. [12] [13] En 2022, un gran estudio (población de 10 millones durante 20 años) sugirió que el VEB era la principal causa de esclerosis múltiple , y una infección reciente por VEB provocó un aumento de 32 veces en el riesgo de desarrollar esclerosis múltiple. [14] [15] [16] [17] [18]
La infección por el virus de Epstein-Barr (VEB) se produce por la transmisión oral de saliva [19] y secreciones genitales. La mayoría de las personas se infectan con el VEB y adquieren inmunidad adaptativa . En los Estados Unidos, aproximadamente la mitad de todos los niños de cinco años y aproximadamente el 90% de los adultos tienen evidencia de infección previa. [20] Los bebés se vuelven susceptibles al VEB tan pronto como desaparece la protección de anticuerpos maternos . Muchos niños que se infectan con el VEB no presentan síntomas o los síntomas son indistinguibles de otras enfermedades leves y breves de la infancia. [21] Cuando la infección ocurre durante la adolescencia o la adultez temprana, causa mononucleosis infecciosa entre el 35 y el 50% de las veces. [22]
El virus de Epstein-Barr (VEB) infecta las células B del sistema inmunitario y las células epiteliales . Una vez que se controla la infección lítica inicial del VEB, la latencia del virus persiste en las células B de memoria del individuo durante el resto de su vida. [19] [23] [24]
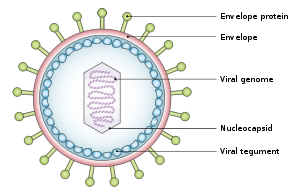
El virus tiene un diámetro de entre 122 y 180 nm y está compuesto por una doble hélice de ácido desoxirribonucleico (ADN) que contiene unos 172.000 pares de bases que codifican 85 genes . [19] El ADN está rodeado por una nucleocápside proteica , que está rodeada por un tegumento hecho de proteína, que a su vez está rodeado por una envoltura que contiene tanto lípidos como proyecciones superficiales de glicoproteínas , que son esenciales para la infección de la célula huésped. [25] En julio de 2020, un equipo de investigadores informó sobre el primer modelo atómico completo de la nucleocápside del virus. Este "primer modelo atómico completo [incluye] la cápside icosaédrica, el complejo de tegumento asociado a la cápside (CATC) y el portal dodecamérico, el aparato de translocación del genoma viral". [26] [27]
El término tropismo viral se refiere a los tipos de células que el VEB infecta. El VEB puede infectar diferentes tipos de células, incluidas las células B y las células epiteliales . [28]
Los complejos de glicoproteína viral de tres partes de gHgL gp42 median la fusión de la membrana de las células B; aunque los complejos de dos partes de gHgL median la fusión de la membrana de las células epiteliales. Los virus de Epstein-Barr que se producen en las células B tienen un bajo número de complejos gHgLgp42, porque estos complejos de tres partes interactúan con las moléculas de antígeno leucocitario humano de clase II presentes en las células B en el retículo endoplasmático y se degradan. Por el contrario, los virus de Epstein-Barr de las células epiteliales son ricos en los complejos de tres partes porque estas células normalmente no contienen moléculas de HLA de clase II . Como consecuencia, los virus de Epstein-Barr fabricados a partir de células B son más infecciosos para las células epiteliales, y los virus de Epstein-Barr fabricados a partir de células epiteliales son más infecciosos para las células B. Los virus que carecen de la porción gp42 pueden unirse a las células B humanas, pero no pueden infectar. [29]

El virus de Epstein-Barr (VEB) puede infectar tanto a las células B como a las células epiteliales. Los mecanismos de entrada en estas dos células son diferentes.
Para entrar en las células B, la glicoproteína viral gp350 se une al receptor celular CD21 (también conocido como CR2). [30] Luego, la glicoproteína viral gp42 interactúa con las moléculas celulares MHC clase II . Esto desencadena la fusión de la envoltura viral con la membrana celular, lo que permite que el VEB entre en la célula B. [25] El CD35 humano, también conocido como receptor del complemento 1 (CR1), es un factor de unión adicional para gp350/220 y puede proporcionar una ruta para la entrada del VEB en células CD21-negativas, incluidas las células B inmaduras. La infección por VEB regula a la baja la expresión de CD35. [31]
Para entrar en las células epiteliales, la proteína viral BMRF-2 interactúa con las integrinas β1 celulares. Luego, la proteína viral gH/gL interactúa con las integrinas αvβ6/αvβ8 celulares. Esto desencadena la fusión de la envoltura viral con la membrana de la célula epitelial, lo que permite que el virus de Epstein-Barr (VEB) entre en la célula epitelial. [25] A diferencia de la entrada de las células B, la entrada a las células epiteliales en realidad se ve impedida por la glicoproteína viral gp42. [30]
Una vez que el VEB ingresa a la célula, la cápside viral se disuelve y el genoma viral se transporta al núcleo celular . [32]
El ciclo lítico , o infección productiva, da como resultado la producción de viriones infecciosos . El VEB puede experimentar replicación lítica tanto en células B como en células epiteliales. En las células B, la replicación lítica normalmente solo tiene lugar después de la reactivación desde la latencia. En las células epiteliales, la replicación lítica a menudo sigue directamente a la entrada viral. [25]
Para que se produzca la replicación lítica, el genoma viral debe ser lineal. El genoma latente del virus de Epstein-Barr (VEB) es circular, por lo que debe linealizarse en el proceso de reactivación lítica. Durante la replicación lítica, la ADN polimerasa viral es responsable de copiar el genoma viral. Esto contrasta con la latencia, en la que la ADN polimerasa de la célula huésped copia el genoma viral. [25]
Los productos de genes líticos se producen en tres etapas consecutivas: inmediata-temprana, temprana y tardía. [25] Los productos de genes líticos inmediatos-tempranos actúan como transactivadores , mejorando la expresión de genes líticos posteriores. Los productos de genes líticos inmediatos-tempranos incluyen BZLF1 (también conocido como Zta, EB1, asociado con su gen de producto ZEBRA ) y BRLF1 (asociado con su gen de producto Rta ). [25] Los productos de genes líticos tempranos tienen muchas más funciones, como la replicación, el metabolismo y el bloqueo del procesamiento de antígenos . Los productos de genes líticos tempranos incluyen BNLF2. [25] Finalmente, los productos de genes líticos tardíos tienden a ser proteínas con funciones estructurales, como VCA , que forma la cápside viral . Otros productos de genes líticos tardíos, como BCRF1, ayudan al EBV a evadir el sistema inmunológico. [25]
En un estudio se ha demostrado que el EGCG , un polifenol del té verde , inhibe la infección lítica espontánea por VEB a nivel de ADN, transcripción génica y proteínas de manera dependiente del tiempo y la dosis ; sin embargo, la expresión de los genes líticos del VEB Zta, Rta y el complejo antigénico temprano EA-D (inducido por Rta ) no se ve afectada, mientras que el gen EBNA-1 altamente estable que se encuentra en todas las etapas de la infección por VEB no se ve afectado. [33] Los inhibidores específicos (de las vías) sugieren que la vía Ras/MEK/MAPK contribuye a la infección lítica por VEB a través de la vía BZLF1 y la vía PI3-K a través de BRLF1, esta última anulando por completo la capacidad de un vector de adenovirus BRLF1 para inducir la forma lítica de la infección por VEB. [33] Además, se está estudiando la activación de algunos genes pero no de otros para determinar cómo inducir la destrucción inmunitaria de las células B latentemente infectadas mediante el uso de TPA o butirato de sodio . [33]

A diferencia de la replicación lítica, la latencia no da como resultado la producción de viriones. [25] En cambio, el ADN circular del genoma del VEB reside en el núcleo celular como un episoma y es copiado por la ADN polimerasa de la célula huésped . [25] Persiste en las células B de memoria del individuo . [19] [24] Los cambios epigenéticos como la metilación del ADN y los componentes de la cromatina celular , suprimen la mayoría de los genes virales en las células infectadas de forma latente. [34] Solo se expresa una parte de los genes del VEB , lo que respalda el estado latente del virus. [34] [19] [35] El VEB latente expresa sus genes en uno de tres patrones, conocidos como programas de latencia. El VEB puede persistir de forma latente dentro de las células B y las células epiteliales , pero son posibles diferentes programas de latencia en los dos tipos de células. [36] [37]
El virus de Epstein-Barr (VEB) puede presentar uno de tres programas de latencia: Latencia I, Latencia II o Latencia III. Cada programa de latencia conduce a la producción de un conjunto limitado y distinto de proteínas virales y ARN virales . [38] [39]
Además, se postula un programa en el que se desactiva toda la expresión de proteínas virales (latencia 0). [40]
Dentro de las células B, los tres programas de latencia son posibles. [19] La latencia del VEB dentro de las células B generalmente progresa de la Latencia III a la Latencia II a la Latencia I. Cada etapa de latencia influye de manera única en el comportamiento de las células B. [19] Al infectar una célula B ingenua en reposo , el VEB entra en la Latencia III. El conjunto de proteínas y ARN producidos en la Latencia III transforma la célula B en una explosión proliferante (también conocida como activación de células B). [19] [25] Más tarde, el virus restringe su expresión genética y entra en la Latencia II. El conjunto más limitado de proteínas y ARN producidos en la Latencia II induce a la célula B a diferenciarse en una célula B de memoria . [19] [25] Finalmente, el VEB restringe la expresión genética aún más y entra en la Latencia I. La expresión de EBNA-1 permite que el genoma del VEB se replique cuando la célula B de memoria se divide. [19] [25]
Dentro de las células epiteliales, sólo es posible la latencia II. [41]
En la infección primaria, el virus de Epstein-Barr (VEB) se replica en las células epiteliales orofaríngeas y establece infecciones de latencia III, II y I en los linfocitos B. La infección latente de los linfocitos B por el VEB es necesaria para la persistencia del virus, la replicación posterior en las células epiteliales y la liberación del virus infeccioso en la saliva. Las infecciones de latencia III y II de los linfocitos B por el VEB, la infección de latencia II de las células epiteliales orales y la infección de latencia II de las células NK o T pueden dar lugar a neoplasias malignas, marcadas por la presencia uniforme del genoma del VEB y la expresión génica. [42]
El virus de Epstein-Barr (VEB) latente en las células B puede reactivarse para pasar a la replicación lítica. Se sabe que esto sucede in vivo , pero no se sabe con precisión qué lo desencadena. In vitro , el VEB latente en las células B puede reactivarse estimulando el receptor de células B, por lo que es probable que la reactivación in vivo tenga lugar después de que las células B infectadas de forma latente respondan a infecciones no relacionadas. [25]
La infección de los linfocitos B por el virus de Epstein-Barr (VEB) produce la " inmortalización " de estas células, lo que significa que el virus hace que sigan dividiéndose indefinidamente. Normalmente, las células tienen una vida útil limitada y acaban muriendo, pero cuando el VEB infecta a los linfocitos B, altera su comportamiento y los vuelve "inmortales" en el sentido de que pueden seguir dividiéndose y sobreviviendo mucho más tiempo de lo habitual. Esto permite que el virus persista en el organismo durante toda la vida del individuo. [43]
Cuando el virus de Epstein-Barr (VEB) infecta a las células B in vitro , surgen líneas celulares linfoblastoides capaces de crecer indefinidamente. La transformación del crecimiento de estas líneas celulares es consecuencia de la expresión de proteínas virales. [44]
EBNA-2, EBNA-3C y LMP-1 son esenciales para la transformación, mientras que EBNA-LP y los EBER no lo son. [45]
Se cree que, tras la infección natural con el virus de Epstein-Barr (VEB), el virus ejecuta parte o la totalidad de su repertorio de programas de expresión genética para establecer una infección persistente. Dada la ausencia inicial de inmunidad del huésped , el ciclo lítico produce una gran cantidad de viriones para infectar a otros linfocitos B (presumiblemente) dentro del huésped.
Los programas latentes reprograman y subvierten los linfocitos B infectados para que proliferen y lleven células infectadas a los sitios en los que presumiblemente persiste el virus. Finalmente, cuando se desarrolla la inmunidad del huésped, el virus persiste desactivando la mayoría (o posiblemente todos) de sus genes y solo ocasionalmente se reactiva y produce viriones progenie. Finalmente, se logra un equilibrio entre la reactivación viral ocasional y la vigilancia inmunológica del huésped eliminando las células que activan la expresión génica viral. La manipulación de la epigenética del cuerpo humano por parte del VEB puede alterar el genoma de la célula para dejar fenotipos oncogénicos. [46] Como resultado, la modificación por parte del VEB aumenta la probabilidad de que el huésped desarrolle cáncer relacionado con el VEB. [47] Los cánceres relacionados con el VEB son únicos en el sentido de que son frecuentes en cuanto a realizar cambios epigenéticos, pero es menos probable que muten. [48]
El sitio de persistencia del VEB puede ser la médula ósea . Los pacientes con VEB positivo que han tenido su propia médula ósea reemplazada con médula ósea de un donante con VEB negativo resultan ser negativos al VEB después del trasplante . [49]
Todas las proteínas nucleares del virus de Epstein-Barr (VEB) se producen mediante el empalme alternativo de un transcrito que comienza en los promotores Cp o Wp en el extremo izquierdo del genoma (en la nomenclatura convencional). Los genes están ordenados EBNA-LP/EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1 dentro del genoma.
El codón de iniciación de la región codificante de EBNA-LP se crea mediante un empalme alternativo del transcrito de la proteína nuclear. En ausencia de este codón de iniciación, se expresarán EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1 dependiendo de cuál de estos genes se empalme alternativamente en el transcrito.
El virus de Epstein-Barr (VEB) se puede dividir en dos tipos principales: el tipo 1 y el tipo 2. Estos dos subtipos tienen genes EBNA-3 diferentes . Como resultado, los dos subtipos difieren en sus capacidades de transformación y reactivación. El tipo 1 es dominante en la mayor parte del mundo, pero los dos tipos son igualmente frecuentes en África . Se puede distinguir el tipo 1 del tipo 2 cortando el genoma viral con una enzima de restricción y comparando los patrones de digestión resultantes mediante electroforesis en gel . [25]
Los ARN pequeños codificados por el virus de Epstein-Barr (EBER) son, con diferencia, los productos del virus de Epstein-Barr más abundantes que se transcriben en las células infectadas por el virus. Se utilizan habitualmente como dianas para la detección del virus de Epstein-Barr en tejidos histológicos. [50]
Clínicamente, la forma más común de detectar la presencia del virus de Epstein-Barr (VEB) es el ensayo inmunoabsorbente ligado a enzimas (ELISA). Se detectan anticuerpos (IgM e IgG) contra las proteínas codificadas por el ADN del VEB. [54] La detección directa de la presencia del genoma del VEB mediante la reacción en cadena de la polimerasa (PCR) rara vez se realiza, ya que este método no dice nada sobre la reacción del sistema inmunológico al virus. La carga viral del VEB no se correlaciona bien con los síntomas clínicos de la infección. [55]
El VEB causa mononucleosis infecciosa. [56] Los niños infectados con VEB tienen pocos síntomas o pueden parecer asintomáticos, pero cuando la infección se retrasa hasta la adolescencia o la edad adulta, puede causar fatiga , fiebre , inflamación de garganta , ganglios linfáticos inflamados en el cuello, agrandamiento del bazo , hígado inflamado o sarpullido. [20] El síndrome de fatiga crónica postinfecciosa también se ha asociado con la infección por VEB. [57] [58]
El VEB también se ha visto implicado en varias otras enfermedades, incluyendo el linfoma de Burkitt , [59] linfohistiocitosis hemofagocítica , [60] linfoma de Hodgkin , [61] cáncer de estómago , [12] [62] carcinoma nasofaríngeo , [63] esclerosis múltiple , [15] [16] [64] [17] y granulomatosis linfomatoide . [65]
En concreto, se ha demostrado que las células B infectadas por el virus de Epstein-Barr residen en las lesiones cerebrales de los pacientes con esclerosis múltiple [17] , y un estudio de 2022 de muestras de sangre históricas de 10 millones de soldados mostró que "las personas que no estaban infectadas con el virus de Epstein-Barr prácticamente nunca contraen esclerosis múltiple. Es solo después de la infección por el virus de Epstein-Barr que el riesgo de esclerosis múltiple aumenta más de 30 veces", y que solo el virus de Epstein-Barr de muchas infecciones tenía una conexión tan clara con la enfermedad. [66]
Otras enfermedades que se han relacionado con el VEB incluyen el síndrome de Gianotti-Crosti , el eritema multiforme , las úlceras genitales agudas y la leucoplasia pilosa oral . [67] La infección viral también se asocia con, y a menudo contribuye al desarrollo de, una amplia gama de enfermedades linfoproliferativas no malignas, como reacciones alérgicas graves por hipersensibilidad a las picaduras de mosquitos , [68] úlceras mucocutáneas positivas al virus de Epstein-Barr e hidroa vacciniforme , así como enfermedades linfoproliferativas malignas como el linfoma de Burkitt positivo al virus de Epstein-Barr , [69] el linfoma de Hodgkin positivo al virus de Epstein-Barr , [70] y el linfoma de derrame primario . [71]
El virus de Epstein-Barr se ha relacionado con trastornos relacionados con la agregación de alfa-sinucleína (por ejemplo, enfermedad de Parkinson , demencia con cuerpos de Lewy y atrofia multisistémica ). [72]
Se ha descubierto que EBNA1 puede inducir la rotura cromosómica en el cromosoma 11 , específicamente en la región 11q23 entre el gen FAM55D y FAM55B, por la que EBNA-1 parece tener una alta afinidad debido a que su dominio de unión al ADN tiene interés en una repetición palindrómica específica en esta sección del genoma. [73] Si bien se desconoce la causa y el mecanismo exacto de esto, el subproducto da como resultado errores y rotura de la estructura cromosómica a medida que las células que provienen de la línea del genoma contaminado experimentan mitosis . Dado que los genes de esta área se han implicado en la leucemia y es el hogar de un gen supresor de tumores que está modificado o no está presente en la mayoría de la expresión de genes tumorales, se ha planteado la hipótesis de que la rotura en esta área es el principal culpable de los cánceres que el EBV aumenta la probabilidad de contraer. La rotura también depende de la dosis: una persona con una infección latente tendrá menos rotura que una persona con una infección nueva o reactivada, ya que los niveles de EBNA1 en el núcleo y el nucléolo son más altos durante el ataque activo del cuerpo debido a la constante replicación y toma de control de células en el cuerpo.
El virus de Epstein-Barr recibió su nombre en honor a MA Epstein y a Yvonne Barr , quienes descubrieron el virus junto con Bert Achong . [74] [75] En 1961, Epstein, un patólogo y experto en microscopía electrónica , asistió a una conferencia sobre "El cáncer infantil más común en África tropical: un síndrome hasta ahora no reconocido" dictada por DP Burkitt , un cirujano que ejercía en Uganda , en la que Burkitt describió la "variante endémica" (forma pediátrica) de la enfermedad que ahora lleva su nombre . En 1963, se envió una muestra desde Uganda al Hospital Middlesex para su cultivo. Se identificaron partículas virales en las células cultivadas y los resultados fueron publicados en The Lancet en 1964 por Epstein, Achong y Barr. [75] [76] Se enviaron líneas celulares a Werner y Gertrude Henle en el Hospital Infantil de Filadelfia, quienes desarrollaron marcadores serológicos . [77] En 1967, un técnico de su laboratorio desarrolló mononucleosis y pudieron comparar una muestra de suero almacenada, mostrando que se desarrollaron anticuerpos contra el virus. [76] [78] [79] En 1968, descubrieron que el VEB puede inmortalizar directamente las células B después de la infección, [43] imitando algunas formas de infecciones relacionadas con el VEB, [77] y confirmaron el vínculo entre el virus y la mononucleosis infecciosa. [80]
El virus de Epstein-Barr es un virus relativamente complejo que aún no se comprende del todo. Los laboratorios de todo el mundo siguen estudiándolo y desarrollando nuevas formas de tratar las enfermedades que causa. Una forma popular de estudiar el virus de Epstein -Barr in vitro es utilizar cromosomas artificiales bacterianos . [81] El virus de Epstein-Barr se puede mantener y manipular en el laboratorio en latencia continua (una propiedad compartida con el herpesvirus asociado al sarcoma de Kaposi , otro de los ocho herpesvirus humanos). Aunque se supone que muchos virus tienen esta propiedad durante la infección de sus huéspedes naturales, no existe un sistema fácil de gestionar para estudiar esta parte del ciclo de vida viral. Los estudios genómicos del virus de Epstein-Barr han podido explorar la reactivación lítica y la regulación del episoma viral latente. [82]
Aunque se está investigando activamente, todavía no se dispone de una vacuna contra el virus de Epstein-Barr . El desarrollo de una vacuna eficaz podría prevenir hasta 200.000 cánceres a nivel mundial por año. [12] [13] La ausencia de modelos animales eficaces es un obstáculo para el desarrollo de vacunas profilácticas y terapéuticas contra el virus de Epstein-Barr. [24]
Al igual que otros herpesvirus humanos, el virus de Epstein-Barr podría permitir su propia erradicación mediante un tratamiento con el fármaco valaciclovir , pero se necesitan más investigaciones para determinar si la erradicación es realmente alcanzable. [46] Los agentes antivirales actúan inhibiendo la replicación del ADN viral, pero hay poca evidencia de que sean eficaces contra el virus de Epstein-Barr. Además, son caros, corren el riesgo de causar resistencia a los agentes antivirales y (en el 1% al 10% de los casos) pueden causar efectos secundarios desagradables . [47]