La artemisinina ( / ˌ ɑː t ɪ ˈ m iː s ɪ n ɪ n / ) y sus derivados semisintéticos son un grupo de fármacos utilizados en el tratamiento de la malaria por Plasmodium falciparum . [1] Fue descubierto en 1972 por Tu Youyou , quien compartió el Premio Nobel de Fisiología o Medicina de 2015 por su descubrimiento. [2] Las terapias combinadas basadas en artemisinina (ACT) son ahora el tratamiento estándar en todo el mundo para la malaria por P. falciparum, así como para la malaria debida a otras especies de Plasmodium . [3] La artemisinina se extrae de la planta Artemisia annua (ajenjo dulce), una hierba empleada en la medicina tradicional china . Se puede producir un compuesto precursor utilizando una levadura genéticamente modificada , que es mucho más eficiente que utilizar la planta. [4]
La artemisinina y sus derivados son lactonas sesquiterpénicas que contienen un puente de peróxido inusual . Este anillo de endoperóxido de 1,2,4-trioxano es responsable de sus propiedades antipalúdicas. Se conocen pocos compuestos naturales con dicho puente de peróxido. [5]
La artemisinina y sus derivados se han utilizado para el tratamiento de infecciones por malaria y gusanos parásitos (helmintos) . Las ventajas de dichos tratamientos sobre otros antiparasitarios incluyen una eliminación más rápida de los parásitos y una eficacia más amplia a lo largo de todo el ciclo de vida del parásito; Las desventajas incluyen su baja biodisponibilidad , propiedades farmacocinéticas deficientes y alto costo. [6] [7] Además, la Organización Mundial de la Salud desaconseja explícitamente el uso del fármaco por sí solo como monoterapia , [8] ya que ha habido signos de que los parásitos de la malaria están desarrollando resistencia al fármaco. Las terapias combinadas , que incluyen artemisinina o sus derivados junto con algún otro fármaco antipalúdico, constituyen el régimen de tratamiento estándar contemporáneo para la malaria. [9]
La Organización Mundial de la Salud (OMS) recomienda la artemisinina o uno de sus derivados (generalmente en combinación con un fármaco asociado de mayor duración) como terapia de primera línea para todos los casos de malaria. [3] Para la malaria no complicada , la OMS recomienda tres días de tratamiento oral con cualquiera de las cinco terapias combinadas basadas en artemisinina (ACT): arteméter/lumefantrina , artesunato/amodiaquina (ASAQ), artesunato/mefloquina , dihidroartemisinina/piperaquina o artesunato/ Sulfadoxina/pirimetamina . [3] En cada una de estas combinaciones, el derivado de la artemisinina mata rápidamente a los parásitos, pero a su vez se elimina rápidamente del cuerpo. [10] El fármaco asociado de vida más larga mata los parásitos restantes y proporciona cierta protección persistente contra la reinfección. [11]
Para la malaria grave , la OMS recomienda el tratamiento intravenoso o intramuscular con artesunato, derivado de la artemisinina, durante al menos 24 horas. [12] El tratamiento con artesunato se continúa hasta que la persona tratada esté lo suficientemente bien como para tomar medicamentos orales. Luego se les administra un tratamiento ACT de tres días, como en el caso de la malaria no complicada. [12] Cuando no se dispone de artesunato, la OMS recomienda la inyección intramuscular del arteméter, un derivado de la artemisinina menos potente . [13] Para niños menores de seis años, si no se dispone de artesunato inyectable, la OMS recomienda la administración rectal de artesunato, seguida de la derivación a un centro con recursos para recibir atención adicional. [12]
Las artemisininas no se utilizan para la prevención de la malaria debido a la actividad ( vida media ) extremadamente corta del fármaco. Para que sea eficaz, tendría que administrarse varias veces al día. [ cita necesaria ]
La OMS recomienda evitar la ACT en mujeres en el primer trimestre del embarazo debido a la falta de investigaciones sobre la seguridad de la artemisinina al comienzo del embarazo. En cambio, la OMS recomienda un tratamiento de siete días con clindamicina y quinina . [14] Para las mujeres embarazadas en su segundo o tercer trimestre, la OMS recomienda un curso de tratamiento normal con un ACT. [15] Para algunos otros grupos, se evitan ciertos TCA debido a los efectos secundarios del fármaco asociado: se evita la sulfadoxina-pirimetamina durante las primeras semanas de vida, ya que interfiere con la acción de la bilirrubina y puede empeorar la ictericia neonatal . [16] En personas VIH positivas , la combinación de trimetoprima/sulfametoxazol , tratamientos antirretrovirales que contienen zidovudina y ASAQ se asocia con neutropenia . La combinación del medicamento contra el VIH efavirenz y ASAQ se asocia con toxicidad hepática. [17]
Las artemisininas generalmente se toleran bien en las dosis utilizadas para tratar la malaria. [18] Los efectos secundarios de la clase de medicamentos artemisinina son similares a los síntomas de la malaria: náuseas , vómitos , pérdida de apetito y mareos . También se han observado anomalías sanguíneas leves. Un efecto adverso raro pero grave es la reacción alérgica . [18] [19] Se informó un caso de inflamación hepática significativa en asociación con el uso prolongado de una dosis relativamente alta de artemisinina por una razón poco clara (el paciente no tenía malaria). [20] Los medicamentos utilizados en terapias combinadas pueden contribuir a los efectos adversos experimentados por quienes reciben tratamiento. Los efectos adversos en pacientes con paludismo agudo por P. falciparum tratados con derivados de la artemisinina tienden a ser mayores. [21]
Un componente inusual de las moléculas de artemisinina es un anillo de endoperóxido de 1,2,4-trioxano. Este es el principal centro antipalúdico de la molécula. [22] Las modificaciones en la posición del carbono 10 (C10) dan lugar a una variedad de derivados que son más potentes que el compuesto original. [23] Debido a que las propiedades físicas de la artemisinina en sí, como la escasa biodisponibilidad, limitan su eficacia, se han desarrollado derivados semisintéticos de la artemisinina. Los derivados de la dihidroartemisinina se fabrican desde 1976. El artesunato, el arteéter y el arteméter se sintetizaron por primera vez en 1986. Se han producido muchos derivados, de los cuales el ácido artelínico , el artemotilo , la artemisona, SM735, SM905, SM933, SM934 y SM1044 se encuentran entre los compuestos más potentes. [24] [25] También existen análogos simplificados en desarrollo preclínico . [26] Se han preparado más de 120 derivados más, pero las pruebas clínicas no han sido posibles debido a la falta de apoyo financiero. [22]
La artemisinina es poco soluble en aceites y agua. Por lo tanto, normalmente se administra a través del tracto digestivo, ya sea por vía oral o rectal. Sin embargo, el artesunato se puede administrar por vía intravenosa e intramuscular, así como por vía oral y rectal. [27] Un compuesto sintético con una estructura de trioxolano similar (un anillo que contiene tres átomos de oxígeno) llamado RBx-11160 [28] se mostró prometedor en pruebas in vitro . Las pruebas de fase II en pacientes con malaria no tuvieron tanto éxito como se esperaba, pero el fabricante decidió iniciar las pruebas de fase III de todos modos. [29]
Hasta 2018, el mecanismo de acción exacto de las artemisininas no se ha dilucidado por completo. [30] La artemisinina en sí es un profármaco de la dihidroartemisinina biológicamente activa . Este metabolito sufre la escisión de su anillo endoperóxido dentro de los eritrocitos . Cuando las moléculas del fármaco entran en contacto con el hemo (asociado con la hemoglobina de los glóbulos rojos), el óxido de hierro (II) rompe el anillo de endoperóxido. [31] Este proceso produce radicales libres que a su vez dañan las proteínas susceptibles, lo que provoca la muerte del parásito. [32] [33] En 2016, se demostró que la artemisinina se une a una gran cantidad de objetivos, lo que sugiere que actúa de manera promiscua. Sin embargo, la fracción endoperóxido de artemisinina es menos sensible al óxido de hierro (II) libre y, por lo tanto, más activa en las etapas intraeritrocíticas de P. falciparum . [34] Por el contrario, la práctica clínica muestra que, a diferencia de otros antipalúdicos, la artemisinina está activa durante todas las etapas del ciclo de vida del parásito. [35]
La evidencia clínica de resistencia a los medicamentos a la artemisinina en el sudeste asiático se informó por primera vez en 2008, [36] y posteriormente fue confirmada por un estudio detallado realizado en el oeste de Camboya . [37] [38] Se informó de resistencia en la vecina Tailandia en 2012, [39] y en el norte de Camboya, Vietnam y el este de Myanmar en 2014. [40] [41] Se informó de resistencia emergente en el sur de Laos , el centro de Myanmar y el noreste de Camboya en 2014. [40] [41] El gen kelch del parásito en el cromosoma 13 parece ser un marcador molecular confiable de resistencia clínica en el sudeste asiático. [42]
En 2011, la OMS afirmó que la resistencia al fármaco antipalúdico más eficaz, la artemisinina, podría desbaratar los programas nacionales indios de control de la malaria, que han logrado avances significativos en la última década. La OMS aboga por el uso racional de los medicamentos antipalúdicos y reconoce el papel crucial de los trabajadores de salud comunitarios en la reducción de la malaria en la región. [43]
Las artemisininas se pueden usar solas, pero esto conduce a una alta tasa de reaparición de parásitos y se requieren otros medicamentos para eliminar del cuerpo todos los parásitos y prevenir una recurrencia. La OMS está presionando a los fabricantes para que dejen de poner el medicamento no compuesto a disposición de la comunidad médica en general, consciente de la catástrofe que resultaría si el parásito de la malaria desarrollara resistencia a las artemisininas. [44]
Dos mecanismos principales de resistencia impulsan la resistencia de Plasmodium a los medicamentos antipalúdicos. El primero es una salida del fármaco fuera de su sitio de acción debido a mutaciones en diferentes genes transportadores (como pfcrt en la resistencia a la cloroquina ) o a un mayor número de copias del gen (como el número de copias de pfmdr1 en la resistencia a la mefloquina ). El segundo es un cambio en el objetivo del parásito debido a mutaciones en los genes correspondientes (como, a nivel del citosol, dhfr y dhps en la resistencia a la sulfadoxina - pirimetamina o, a nivel de las mitocondrias, el citocromo b en la resistencia a la atovacuona ). La resistencia de P. falciparum a los nuevos compuestos de artemisinina implica un mecanismo novedoso correspondiente a un fenómeno de inactividad. [45]
A partir de 2020, [actualizar]las futuras investigaciones sobre resistencia utilizarán ratones transgénicos para descubrir marcadores moleculares relevantes . [46]
Se cree que la biosíntesis de artemisinina implica la vía del mevalonato (MVA) y la ciclación del farnesil difosfato (FDP). No está claro si la vía distinta del mevalonato también puede contribuir con precursores de 5 carbonos ( IPP o DMAPP ), como ocurre en otros sistemas biosintéticos de sesquiterpenos. Las rutas del alcohol artemisínico a la artemisinina siguen siendo controvertidas y difieren principalmente en cuándo tiene lugar el paso de reducción. Ambas rutas sugirieron el ácido dihidroartemisínico como precursor final de la artemisinina. Luego, el ácido dihidroartemisínico sufre fotooxidación para producir hidroperóxido de ácido dihidroartemisínico. La expansión del anillo mediante la escisión del hidroperóxido y una segunda hidroperoxidación mediada por oxígeno finalizan la biosíntesis de la artemisinina. [ cita necesaria ]
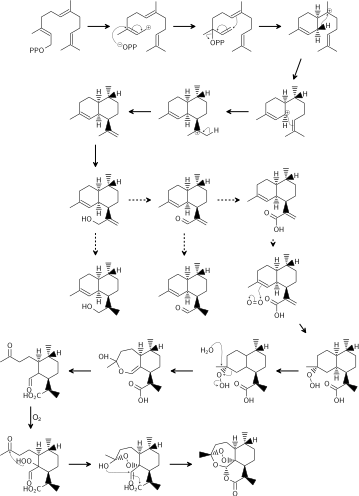
La síntesis total de artemisinina se ha realizado muchas veces a partir de materiales de partida orgánicos disponibles, utilizando reactivos orgánicos básicos. Las dos primeras síntesis totales fueron una síntesis estereoselectiva realizada por Schmid y Hofheinz en Hoffmann-La Roche en Basilea a partir de (-)- isopulegol (13 pasos, ~5 % de rendimiento total) y una síntesis simultánea por Zhou y sus compañeros de trabajo en el Instituto de Shanghai. de Química Orgánica a partir de ( R )-(+)- citronelal (20 pasos, ~0,3% de rendimiento total). [47] Los pasos clave del enfoque de Schmid-Hofheinz incluyeron una hidroboración/oxidación estereoselectiva inicial de Ohrloff para establecer el estereocentro de metilo "fuera del anillo" en la cadena lateral del propeno; dos alquilaciones secuenciales mediadas por reactivos de litio que introdujeron todos los átomos de carbono necesarios y que, en conjunto, eran altamente diastereoselectivas; y se realizaron pasos adicionales de reducción, oxidación y desililación en este intermedio monocarbocíclico, incluido un oxígeno singlete final que utiliza fotooxigenación y reacción ene , que, después del tratamiento ácido, cerró los tres anillos oxacíclicos restantes del producto deseado, artemisinina, en un solo paso. [47] [48] [49] (En esencia, la operación oxidativa final de cierre del anillo en estas síntesis logra los tres pasos biosintéticos de cierre que se muestran arriba).
Se sigue explorando una amplia variedad de rutas adicionales, desde los primeros tiempos hasta la actualidad, incluidas rutas de síntesis total de ( R )-(+)-pulegona, isomenteno , [47] e incluso 2-ciclohexen-1-ona , [50]. así como rutas mejor descritas como parciales o semisíntesis a partir de un precursor biosintético más abundante, el ácido artemisínico; en el último caso, incluidos algunos ejemplos de síntesis biomiméticas muy breves y de muy alto rendimiento (de Roth y Acton, y Haynes et al., 3 pasos , 30% de rendimiento), que nuevamente presentan la química del eno de oxígeno singlete. [51] [47] [52] [53]
La asociación para desarrollar artemisinina semisintética fue dirigida por el programa de desarrollo de fármacos de PATH (a través de una afiliación con OneWorld Health), con financiación de la Fundación Bill y Melinda Gates . El proyecto comenzó en 2004, y los socios iniciales incluyeron la Universidad de California, Berkeley (que proporcionó la tecnología en la que se basó el proyecto, un proceso que alteró genéticamente la levadura para producir ácido artemisínico) [54] y Amyris (una empresa de biotecnología en California, que perfeccionó el proceso para permitir la producción a gran escala y desarrolló procesos escalables para transferirlos a un socio industrial).
En 2006, un equipo de la Universidad de California en Berkeley informó que habían diseñado la levadura Saccharomyces cerevisiae para producir una pequeña cantidad del precursor ácido artemisínico. El ácido artemisínico sintetizado puede luego transportarse, purificarse y convertirse químicamente en artemisinina, lo que, según afirman, costará aproximadamente 0,25 dólares estadounidenses por dosis. En este esfuerzo de biología sintética , se utilizó una vía de mevalonato modificada y las células de levadura se diseñaron para expresar la enzima amorfadieno sintasa y una monooxigenasa del citocromo P450 (CYP71AV1), ambas de Artemisia annua . Una oxidación en tres pasos del amorfa-4,11-dieno da el ácido artemisínico resultante. [55]
El método de UC Berkeley se amplió utilizando tecnología de varias otras organizaciones. La última tecnología exitosa se basa en invenciones autorizadas por la UC Berkeley y el Instituto de Biotecnología Vegetal del Consejo Nacional de Investigación (NRC) de Canadá. [ cita necesaria ]
La producción comercial de artemisinina semisintética ya está en marcha en las instalaciones de Sanofi en Garessio, Italia. Esta segunda fuente de artemisinina está preparada para permitir un flujo más estable de tratamientos antipalúdicos clave para quienes más los necesitan. [56] El objetivo de producción se ha fijado en 35 toneladas para 2013. Se espera que aumente a 50-60 toneladas por año en 2014, abasteciendo aproximadamente un tercio de la necesidad anual mundial de artemisinina. [ cita necesaria ]
En 2013, el Programa de Precalificación de Medicamentos de la OMS anunció la aceptabilidad de la artemisinina semisintética para su uso en la fabricación de ingredientes farmacéuticos activos presentados a la OMS para su precalificación, o que ya hayan sido calificados por la OMS. [57] El ingrediente farmacéutico activo (API) de Sanofi producido a partir de artemisinina semisintética (artesunato) también fue precalificado por la OMS el 8 de mayo de 2013, lo que lo convierte en el primer derivado semisintético de artemisinina precalificado. [ cita necesaria ]
En 2010, un equipo de la Universidad e Investigación de Wageningen informó que habían diseñado un pariente cercano del tabaco, Nicotiana benthamiana , que también puede producir el precursor, el ácido artemisínico. [58]
China y Vietnam aportan el 70% y África Oriental el 20% de la materia prima vegetal. [59] Las plántulas se cultivan en viveros y luego se trasplantan a los campos. Les toma alrededor de 8 meses alcanzar su tamaño completo. Las plantas se cosechan, las hojas se secan y se envían a instalaciones donde se extrae la artemisinina mediante un disolvente, normalmente hexano . Se han propuesto métodos de extracción alternativos. [60] El precio de mercado de la artemisinina ha fluctuado ampliamente, entre 120 y 1.200 dólares EE.UU. por kilogramo entre 2005 y 2008. [61]
La empresa china Artepharm creó un fármaco combinado de artemisinina y piperaquina comercializado como Artequick. Además de la investigación clínica realizada en China y el sudeste asiático, Artequick se utilizó en esfuerzos de erradicación de la malaria a gran escala en las Comoras . Esos esfuerzos, realizados en 2007, 2012 y 2013-14, produjeron una reducción de entre el 95% y el 97% en el número de casos de malaria en las Comoras. [62]
Después de negociar con la OMS, Novartis y Sanofi proporcionan medicamentos ACT al costo sin fines de lucro; sin embargo, estos medicamentos siguen siendo más caros que otros tratamientos contra la malaria. [63] La inyección de artesunato para el tratamiento grave de la malaria es fabricada por la fábrica farmacéutica de Guilin en China, donde la producción ha recibido la precalificación de la OMS. [64] El Centro de Nuevos Productos Agrícolas de la Universidad de York está produciendo variedades de Artemisia de alto rendimiento utilizando técnicas de mejoramiento molecular. [61]
Utilizando semillas suministradas por Acción para la Medicina Natural (ANAMED), el Centro Mundial de Agroforestería (ICRAF) ha desarrollado un híbrido, denominado A3, que puede crecer hasta una altura de 3 metros y producir 20 veces más artemisinina que las variedades silvestres. En el noroeste de Mozambique , el ICRAF está trabajando junto con una organización médica, Médicos Sin Fronteras , ANAMED y el Ministerio de Agricultura y Desarrollo Rural para capacitar a los agricultores sobre cómo cultivar el arbusto a partir de esquejes y cómo cosechar y secar las hojas para hacer té de artemisia. Sin embargo, la OMS no recomienda el uso de materiales vegetales de A. annua , incluido el té, para la prevención y el tratamiento de la malaria. [sesenta y cinco]
En 2013, Sanofi anunció el lanzamiento [56] de una instalación de producción en Garessio, Italia, para fabricar el fármaco antiplasmodial a gran escala. La asociación para crear un nuevo proceso de fabricación farmacéutica fue liderada por el programa de Desarrollo de Medicamentos de PATH (a través de una afiliación con OneWorld Health), con financiación de la Fundación Bill y Melinda Gates y basada en un proceso biosintético modificado para el ácido artemisínico, diseñado inicialmente por Jay Keasling. en UC Berkeley y optimizado por Amyris . A la reacción le sigue un proceso fotoquímico que crea oxígeno singlete para obtener el producto final. Sanofi espera producir 25 toneladas de artemisinina en 2013, aumentando la producción a 55-60 toneladas en 2014. El precio por kilogramo será de 350 a 400 dólares estadounidenses, aproximadamente el mismo que el de la fuente botánica. [66] A pesar de las preocupaciones de que esta fuente equivalente conduciría a la desaparición de empresas que producen esta sustancia de manera convencional mediante la extracción de biomasa de A. annua , un mayor suministro de este medicamento probablemente producirá precios más bajos y, por lo tanto, aumentará la disponibilidad para el tratamiento ACT. En 2014, Sanofi anunció el lanzamiento del primer lote de artemisinina semisintética. En los próximos meses se enviarán 1,7 millones de dosis de ASAQ de Sanofi , una terapia combinada de dosis fija basada en artemisinina, a media docena de países africanos. [67]
Una revisión sistemática de 2016 de cuatro estudios de África Oriental concluyó que subsidiar ACT en el sector minorista privado en combinación con capacitación y marketing ha llevado a una mayor disponibilidad de ACT en las tiendas, un mayor uso de ACT para niños febriles menores de cinco años y Disminución del uso de antipalúdicos más antiguos y menos eficaces entre los niños menores de cinco años. Los estudios subyacentes no determinaron si los niños tenían malaria ni determinaron si había beneficios para la salud. [68]
Después de la ingestión o inyección, la artemisinina y sus derivados (arteéter, arteméter y artesunato) se convierten rápidamente en el torrente sanguíneo en dihidroartemisinina (DHA), que tiene una potencia antipalúdica entre 5 y 10 veces mayor que la artemisinina. [69] El DHA finalmente se convierte en el hígado en metabolitos como desoxiartemisinina, desoxidihidroartemisinina y 9,10-dihidrodesoxiartemisinina. Estas reacciones son catalizadas por las enzimas CYP2A6 , CYP3A4 y CYP3A5 , que pertenecen al grupo del citocromo P450 presente en el retículo endoplásmico liso . Estos metabolitos carecen de propiedades antipalúdicas debido a la pérdida del grupo endoperóxido (sin embargo, la desoxiartemisinina tiene propiedades antiinflamatorias y antiulcerosas. [70] ) Todos estos metabolitos se someten a glucuronidación , después de lo cual se excretan a través de la orina o las heces. Las glucuronosiltransferasas , en particular UGT1A9 y UGT2B7 , son responsables de este proceso. El DHA también se elimina a través de la bilis en forma de glucurónidos menores . Debido a su rápido metabolismo, la artemisinina y sus derivados son fármacos relativamente seguros con un índice terapéutico relativamente alto . [6]
La artemisinina es una lactona antipalúdica derivada del qinghao (青蒿, Artemisia annua o ajenjo dulce). En 1596, Li Shizhen recomendó el té elaborado con qinghao específicamente para tratar los síntomas de la malaria en su Compendio de Materia Médica . El nombre del género se deriva de la diosa griega Artemisa y, más específicamente, puede haber recibido el nombre de la reina Artemisia II de Caria , botánica e investigadora médica del siglo IV a.C. [71]

Artemisia annua : una hierba común que se encuentra en muchas partes del mundo. En 1967, el Ejército Popular de Liberación creó un programa de investigación de selección de plantas, en el marco de un programa militar secreto cuyo nombre en código era " Proyecto 523 ", para encontrar un tratamiento adecuado para la malaria; El programa y los primeros trabajos clínicos fueron ordenados por Mao Zedong a petición de los líderes norvietnamitas para brindar asistencia a su ejército asolado por la malaria. [72] En el curso de esta investigación en 1972, Tu Youyou descubrió la artemisinina en las hojas de Artemisia annua . [73]
Llamado qinghaosu ( chino :青蒿素; literalmente, 'compuesto de ajenjo verde-azul'), [73] [74] fue uno de los muchos candidatos probados como posibles tratamientos para la malaria por científicos chinos, de una lista de casi 2.000 tratamientos tradicionales. Medicinas chinas . [75] Tu Youyou también descubrió que se podría utilizar un proceso de extracción a baja temperatura para aislar una sustancia antipalúdica eficaz de la planta. Tu dice que fue influenciada por una fuente de medicina herbaria tradicional china, el Manual de recetas para tratamientos de emergencia, escrito en el año 340 d.C. por Ge Hong, que decía que esta hierba debe remojarse en agua fría. [76] Este libro contenía la útil referencia a la hierba: "Un puñado de qinghao sumergido en dos litros de agua, exprime el jugo y bébelo todo".
Posteriormente, el equipo de Tu aisló un extracto . [73] Los resultados se publicaron en el Chinese Medical Journal en 1979. [73] [77] [5] La sustancia extraída, una vez sometida a purificación, demostró ser un punto de partida útil para obtener artemisinina purificada. [73] Una revisión de 2012 informó que las terapias basadas en artemisinina eran los medicamentos más eficaces para el tratamiento de la malaria en ese momento; [78] También se informó que elimina los parásitos de la malaria del cuerpo de los pacientes más rápido que otros medicamentos. Además de la artemisinina, el Proyecto 523 desarrolló una serie de productos que se pueden usar en combinación con la artemisinina, incluidos lumefantrina , piperaquina y pironaridina . [73]
A finales de la década de 1990, Novartis presentó una nueva patente china para un tratamiento combinado con arteméter/lumefantrina, proporcionando a la OMS las primeras terapias combinadas basadas en artemisinina (Coartem) a precios reducidos. [79] En 2006, después de que la artemisinina se convirtiera en el tratamiento de elección para la malaria, la OMS pidió un cese inmediato de las preparaciones de artemisinina en monoterapia en favor de combinaciones de artemisinina con otro medicamento contra la malaria, para reducir el riesgo de que los parásitos desarrollen resistencia. [80]
En 2011, Tu Youyou recibió el Premio de Investigación Médica Clínica Lasker-DeBakey por su papel en el descubrimiento y desarrollo de la artemisinina. [73] [81] El 5 de octubre de 2015, recibió la mitad del Premio Nobel de Fisiología o Medicina de 2015 por descubrir la artemisinina, "un fármaco que ha reducido significativamente las tasas de mortalidad de los pacientes que padecen malaria". [2] La otra mitad del premio fue otorgada conjuntamente a William C. Campbell y Satoshi Ōmura por descubrir la avermectina , "cuyos derivados han reducido radicalmente la incidencia de la ceguera de los ríos y la filariasis linfática , además de mostrar eficacia contra un número creciente de otras enfermedades parasitarias". [2]
La OMS señala cuatro TCA adicionales que se encuentran en ensayos clínicos preliminares o se utilizan a nivel regional para los cuales no hay evidencia que recomiende su uso generalizado: artesunato/pironaridina , arterolano - piperaquina , artemisinina-piperaquina base y artemisinina/naftoquina. [82]
A principios de la década de 1980, mientras se buscaban nuevos antihelmínticos para la esquistosomiasis , se hizo un descubrimiento fortuito en China: la artemisinina era eficaz contra los esquistosomas , [83] [84] los trematodos de la sangre humana , que son las segundas infecciones parasitarias más prevalentes, después de la malaria. La artemisinina y sus derivados son potentes antihelmínticos. [85] Más tarde se descubrió que las artemisininas poseían un amplio espectro de actividad contra una amplia gama de trematodos , incluidos Schistosoma japonicum , S. mansoni , S. haematobium , Clonorchis sinensis , Fasciola hepatica y Opisthorchis viverrini . [ cita necesaria ]
La artemisinina y sus derivados están bajo investigación de laboratorio por sus posibles efectos anticancerígenos. [1] [86] A partir de 2018, solo se habían realizado investigaciones clínicas preliminares utilizando derivados de artemisininina en varios cánceres, sin aplicaciones clínicas aprobadas. [87]
Los derivados de la artemisinina pueden suprimir reacciones inmunes, como la inflamación. Un derivado, SM934, fue aprobado en 2015 por la Administración Nacional de Productos Médicos de China para un ensayo clínico como fármaco para el lupus eritematoso sistémico . [88]
{{cite journal}}: Mantenimiento CS1: DOI inactivo a partir de marzo de 2024 ( enlace )素:...5. 带有根本性质的物质 'sustancia con las propiedades fundamentales de'
La artemisinina ha demostrado ser el fármaco contra la malaria más eficaz jamás producido.