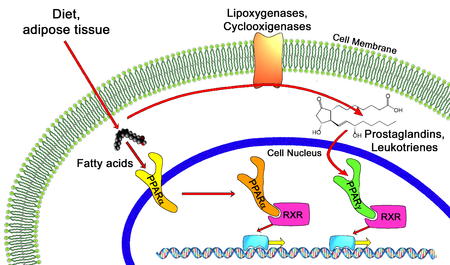
Los agonistas de PPAR son fármacos que actúan sobre el receptor activado por el proliferador de peroxisomas . Se utilizan para el tratamiento de los síntomas del síndrome metabólico , principalmente para reducir los triglicéridos y la glucemia .
Los PPAR-alfa y PPAR-gamma son dianas moleculares de varios fármacos comercializados. Las principales clases de agonistas de PPAR son:
Un compuesto endógeno, el ácido 7(S)-hidroxidocosahexaenoico (7(S)-HDHA), que es un derivado docosanoide del ácido graso omega-3 DHA, se aisló como un ligando endógeno de alta afinidad para PPAR-alfa en el cerebro de rata y ratón. El enantiómero 7(S) se unió con afinidad micromolar a PPAR alfa con una afinidad 10 veces mayor en comparación con el enantiómero (R) y podría desencadenar la activación dendrítica. [1] PPARα (alfa) es el objetivo principal de los fármacos fibratos , una clase de ácidos carboxílicos anfipáticos ( clofibrato , gemfibrozil , ciprofibrato , bezafibrato y fenofibrato ). Originalmente se indicaron para la dislipidemia del colesterol y más recientemente para los trastornos caracterizados por triglicéridos altos.
El PPARγ (gamma) es el principal objetivo de la clase de fármacos de las tiazolidinedionas (TZD), que se utilizan en la diabetes mellitus y otras enfermedades que se caracterizan por la resistencia a la insulina . También se activa levemente con ciertos AINE (como el ibuprofeno ) e indoles , así como con una serie de compuestos naturales. Entre los inhibidores conocidos se encuentra el agente experimental GW-9662.
También se utilizan en el tratamiento de la hiperlipidemia en la aterosclerosis . En este caso, actúan aumentando la expresión de ABCA1 , que transporta el colesterol extrahepático a HDL. Por lo tanto, se produce un aumento de la captación y excreción por el hígado.
Estudios en animales han demostrado su posible papel en la mejora de la inflamación pulmonar, especialmente en el asma. [2]
El PPARδ (delta) es el objetivo principal de una sustancia química de investigación denominada GW501516 . Se ha demostrado que el agonismo del PPARδ cambia la preferencia del cuerpo por el combustible, de la glucosa a los lípidos. [3]
Una cuarta clase de agonistas duales del PPAR, los llamados glitazares , que se unen a las isoformas α y γ del PPAR, se encuentran actualmente bajo investigación activa para el tratamiento de un subconjunto más amplio de los síntomas del síndrome metabólico. [4] [5] Estos incluyen los compuestos experimentales aleglitazar , muraglitazar y tesaglitazar . En junio de 2013, el saroglitazar fue el primer glitazar en ser aprobado para uso clínico. [6]
Además, se están realizando investigaciones y se están desarrollando nuevos agonistas duales del PPAR α/δ y γ/δ para indicaciones terapéuticas adicionales , así como agonistas "pan" que actúan sobre las tres isoformas. [7] [8]
Una vía relativamente reciente de investigación farmacológica para tratar la depresión y la adicción a las drogas es la activación de PPARα y PPARγ . [9] Tanto las vías de señalización mediadas por TLR4 como por NF-κB se han visto implicadas en el desarrollo de la adicción a varias drogas, como los opioides y la cocaína, y, por lo tanto, son objetivos atractivos para la farmacoterapia. [10] [11] [12] A pesar de la amplitud de la investigación preclínica que muestra potencial en modelos animales en el tratamiento de las adicciones a las drogas, incluido el alcohol, la nicotina, la cocaína, los opioides y la metanfetamina, la evidencia humana es limitada y la cantidad de ensayos que analizan el uso de agonistas de PPAR en humanos sigue siendo baja; y hasta ahora (a partir de 2020) no es particularmente prometedora. Hay varias hipótesis sugeridas para la mala traducción de la evidencia de la investigación animal a la humana, como la potencia y selectividad de los ligandos de PPAR, la variabilidad relacionada con el sexo y las diferencias de especies en la distribución y señalización de PPAR. [13]
{{cite journal}}: CS1 maint: DOI inactivo a partir de abril de 2024 ( enlace )