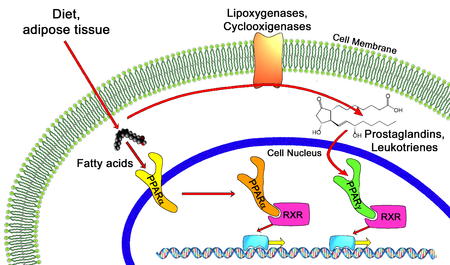
Los agonistas de PPAR son fármacos que actúan sobre el receptor activado por el proliferador de peroxisomas . Se utilizan para el tratamiento de los síntomas del síndrome metabólico , principalmente para reducir los triglicéridos y el azúcar en sangre .
PPAR-alfa y PPAR-gamma son los objetivos moleculares de varios fármacos comercializados. Las principales clases de agonistas de PPAR son:
Se aisló un compuesto endógeno, el ácido 7(S)-hidroxidocosahexaenoico (7(S)-HDHA), que es un derivado docosanoide del ácido graso omega-3 DHA, como ligando endógeno de alta afinidad por PPAR-alfa en ratas y ratones. cerebro. El enantiómero 7(S) se unió con afinidad micromolar a PPAR alfa con una afinidad 10 veces mayor en comparación con el enantiómero (R) y podría desencadenar la activación dendrítica. [1] PPARα (alfa) es el objetivo principal de los fibratos , una clase de ácidos carboxílicos anfipáticos ( clofibrato , gemfibrozilo , ciprofibrato , bezafibrato y fenofibrato ). Originalmente estaban indicados para la dislipidemia del colesterol y más recientemente para los trastornos caracterizados por niveles elevados de triglicéridos.
PPARγ (gamma) es el objetivo principal de la clase de fármacos de tiazolidinedionas (TZD), utilizados en la diabetes mellitus y otras enfermedades que presentan resistencia a la insulina . También se activa levemente con ciertos AINE (como el ibuprofeno ) y los indoles , así como con una serie de compuestos naturales. Los inhibidores conocidos incluyen el agente experimental GW-9662.
También se utilizan en el tratamiento de la hiperlipidemia en la aterosclerosis . Aquí actúan aumentando la expresión de ABCA1 , que transporta el colesterol extrahepático al HDL. Por lo tanto, se produce un aumento de la absorción y excreción en el hígado.
Los estudios en animales han demostrado su posible papel en la mejora de la inflamación pulmonar, especialmente en el asma. [2]
PPARδ (delta) es el objetivo principal de una sustancia química de investigación denominada GW501516 . Se ha demostrado que el agonismo de PPARδ cambia la preferencia de combustible del cuerpo de glucosa a lípidos. [3]
Actualmente se está investigando activamente una cuarta clase de agonistas duales de PPAR, los llamados glitazares , que se unen a las isoformas α y γ de PPAR, para el tratamiento de un subconjunto más amplio de síntomas del síndrome metabólico. [4] [5] Estos incluyen los compuestos experimentales aleglitazar , muraglitazar y tesaglitazar . En junio de 2013, saroglitazar fue el primer glitazar aprobado para uso clínico. [6]
Además, continúa la investigación y el desarrollo de nuevos agonistas duales de PPAR α/δ y γ/δ para indicaciones terapéuticas adicionales , así como agonistas "pan" que actúan sobre las tres isoformas. [7] [8]
Una vía relativamente reciente de investigación de drogas para el tratamiento de la depresión y la drogadicción es mediante la activación de PPARα y PPARγ . [9] Tanto las vías de señalización mediadas por TLR4 como las mediadas por NF-κB se han implicado en el desarrollo de la adicción a varias drogas como los opioides y la cocaína y, por lo tanto, son objetivos atractivos para la farmacoterapia. [10] [11] [12] A pesar de una amplia investigación preclínica que muestra potencial en modelos animales en el tratamiento de adicciones a drogas, incluyendo alcohol, nicotina, cocaína, opioides y metanfetamina, la evidencia en humanos es limitada debido a la cantidad de ensayos que analizan el uso. Los agonistas de PPAR para humanos siguen siendo bajos; y hasta ahora (a partir de 2020) no ha sido particularmente prometedor. Hay varias hipótesis sugeridas para la mala traducción de la evidencia de la investigación en animales a humanos, como la potencia y selectividad de los ligandos de PPAR, la variabilidad relacionada con el sexo y las diferencias entre especies en la distribución y señalización de PPAR. [13]
{{cite journal}}: Mantenimiento CS1: DOI inactivo a partir de abril de 2024 ( enlace )