
La adición nucleofílica conjugada es un tipo de reacción orgánica . Las adiciones nucleofílicas ordinarias o adiciones 1,2-nucleofílicas tratan principalmente de adiciones a compuestos carbonílicos . Los compuestos alquenos simples no muestran reactividad 1,2 debido a la falta de polaridad , a menos que el alqueno se active con sustituyentes especiales . Con compuestos carbonílicos α,β-insaturados como la ciclohexenona , se puede deducir a partir de estructuras de resonancia que la posición β es un sitio electrofílico que puede reaccionar con un nucleófilo . La carga negativa en estas estructuras se almacena como un anión alcóxido . Tal adición nucleofílica se llama adición nucleofílica conjugada o adición 1,4-nucleofílica . Los alquenos activos más importantes son los carbonilos conjugados y acrilonitrilos antes mencionados .
La adición conjugada es la contraparte viníloga de la adición nucleofílica directa. Un nucleófilo reacciona con un compuesto carbonílico α,β-insaturado en la posición β. La carga negativa que lleva el nucleófilo ahora se deslocaliza en el anión alcóxido y el carbanión de carbono α por resonancia . La protonación conduce a través de la tautomería ceto-enólica al compuesto carbonílico saturado. En la difuncionalización vecinal, el protón es reemplazado por otro electrófilo.
La adición conjugada es eficaz en la formación de nuevos enlaces carbono-carbono con la ayuda de reactivos organometálicos como la reacción del yoduro de organozinc con metilvinilcetona . [1]
Un ejemplo de síntesis asimétrica por adición conjugada es la síntesis de (R)-3-fenil-ciclohexanona a partir de ciclohexenona, ácido fenilborónico , un catalizador de rodio acac y el ligando quiral BINAP . [2]

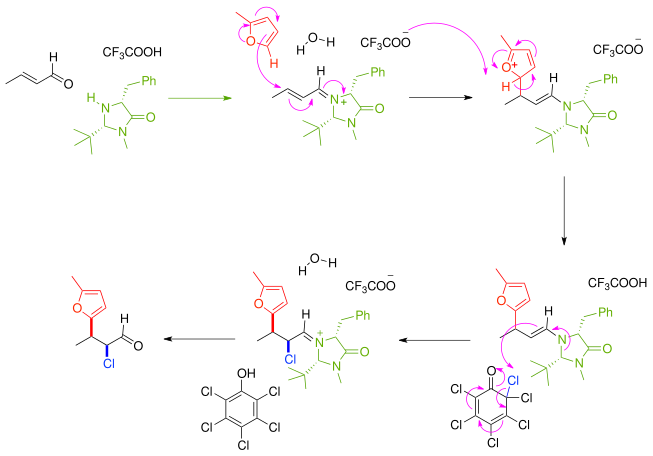
En otro ejemplo de síntesis asimétrica, el compuesto carbonílico α,β-insaturado reacciona primero con un catalizador de imidazolidinona quiral y un auxiliar quiral de un compuesto de iminio en una bisustitución des-oxo-alquilimino que luego reacciona de manera enantioselectiva con el nucleófilo furano . El producto de reacción inmediato es una enamina nucleófila y la reacción se produce en cascada con la abstracción de cloro de una quinona clorada . Después de la eliminación del catalizador de amina, la cetona se funcionaliza de manera efectiva con un nucleófilo y un electrófilo con una relación sin:anti de 8:1 y un exceso enantiomérico del 97 % . [3]
Este principio también se aplica en una adición conjugada en dominó multicomponente enantioselectiva de tioles nucleofílicos como el bencilmercaptano y el DEAD electrofílico . [4]

Los aceptores de Michael solubles son tóxicos porque alquilan el ADN mediante adición conjugada. Dicha modificación induce mutaciones que son citotóxicas y cancerígenas. Sin embargo, el glutatión también puede reaccionar con ellos y, por ejemplo, el fumarato de dimetilo reacciona con él. [ cita requerida ]