El síndrome del corazón izquierdo hipoplásico ( HLHS ) es un defecto cardíaco congénito poco común en el que el lado izquierdo del corazón está severamente subdesarrollado y es incapaz de soportar la circulación sistémica. [2] Se estima que representa el 2-3% de todas las cardiopatías congénitas. [3] Los primeros signos y síntomas incluyen mala alimentación, cianosis y disminución del pulso en las extremidades. [4] Se cree que la etiología es multifactorial y resulta de una combinación de mutaciones genéticas y defectos que resultan en un flujo sanguíneo alterado en el corazón. [5] [6] [7] Varias estructuras pueden verse afectadas, incluido el ventrículo izquierdo , la aorta , la válvula aórtica o la válvula mitral , todo lo cual resulta en una disminución del flujo sanguíneo sistémico. [8]
El diagnóstico puede realizarse prenatalmente mediante ecografía o poco después del nacimiento mediante ecocardiografía. [5] El tratamiento inicial está orientado a mantener la permeabilidad del conducto arterioso, una conexión entre la arteria pulmonar y la aorta que se cierra poco después del nacimiento. [9] Posteriormente, el paciente se somete a una reparación paliativa en tres etapas durante los siguientes años de vida. [10] El procedimiento de Norwood se realiza típicamente a los pocos días del nacimiento. [10] El procedimiento de Glenn se realiza típicamente entre los tres y seis meses de edad. [10] Finalmente, el procedimiento de Fontan se realiza en algún momento entre los dos y los cinco años de edad. [10]
Si no se trata, los pacientes con HLHS mueren en las primeras semanas de vida, mientras que el 70% de los que se someten a una cirugía paliativa en tres etapas llegan a la edad adulta. Después de la cirugía, los niños con HLHS suelen experimentar retrasos en el desarrollo neurológico y motor y tienen un mayor riesgo de insuficiencia cardíaca en la edad adulta. [11] [12]
Se estima que el HLHS se presenta en 1 de cada 3841 nacidos vivos en los Estados Unidos, o un total estimado de 1025 nacidos vivos por año en los EE. UU. [13] [14] En general, se estima que representa el 2-3% de todos los casos de cardiopatía congénita y es el defecto de ventrículo único más común. [3] Se cree que es más común en bebés varones, 1,5 veces más común que en bebés mujeres. [15] Una revisión sistemática reciente encontró una ligera disminución en la prevalencia del HLHS de 0,689/1000 en 1995-1999, a 0,475/1000 en 2010-2017. [3] Se cree que esto se debe a mejoras en la detección prenatal y el asesoramiento prenatal en embarazos posteriores.

El cierre del conducto arterioso en un corazón que está muy poco desarrollado en el lado izquierdo produce cianosis y dificultad respiratoria que puede progresar a un shock cardiogénico y la muerte. Los primeros síntomas pueden incluir mala alimentación o cianosis que no responde a la administración de oxígeno. Los pulsos periféricos pueden ser débiles y las extremidades pueden estar frías al tacto. [5]
El síndrome del corazón izquierdo hipoplásico a menudo coexiste con bajo peso al nacer y parto prematuro. [5]
En los neonatos con un defecto del tabique auricular pequeño, denominado "restrictivo", hay una mezcla inadecuada de sangre oxigenada y desoxigenada. Estos neonatos se descompensan rápidamente y desarrollan acidosis y cianosis. [5]
En el ECG, la desviación del eje a la derecha y la hipertrofia ventricular derecha son comunes, pero no indican HLHS. La radiografía de tórax puede mostrar un corazón grande ( cardiomegalia ) o un aumento de la vasculatura pulmonar. Los neonatos con HLHS no suelen tener un soplo cardíaco , pero en algunos casos, puede ser audible un soplo de flujo pulmonar o un soplo de regurgitación tricuspídea . [5]
La insuficiencia tricuspídea o la disfunción ventricular derecha coexistentes pueden provocar el desarrollo de hepatomegalia . [5]
La mayoría de los casos de HLHS son esporádicos, lo que significa que surgen en pacientes sin antecedentes familiares de HLHS. [4] Algunos casos pueden tener un componente genético, ya que se ha demostrado que el HLHS es hereditario y está asociado con mutaciones genéticas específicas. [16] [17] Los posibles factores contribuyentes pueden incluir infarto intrauterino, cambios infecciosos y una miocardiopatía selectiva del ventrículo izquierdo.
Los loci genéticos asociados con HLHS incluyen GJA1 (conexina 43) , HAND1 , NKX2.5 , 10q22 y 6q23. [15] [18] [6] Existe un ligero riesgo de recurrencia en futuros embarazos, estimado en un 2-4%, que aumenta al 25% en familias con dos hijos afectados. [4] Se cree que esto está mediado por mutaciones genéticas con penetrancia incompleta . [15]
El HLHS también se asocia con varios síndromes genéticos, entre ellos la trisomía 13 (síndrome de Patau) , la trisomía 18 (síndrome de Edwards) , la trisomía parcial 9 , el síndrome de Turner (XO) , el síndrome de Jacobsen (síndrome de deleción 11q) , el síndrome de Holt-Oram y el síndrome de Smith-Lemli-Opitz . [15] [18]
Una teoría popular denominada hipótesis de "sin flujo no hay crecimiento" sugiere que los defectos anatómicos primarios de las válvulas aórtica y mitral conducen a malformaciones del ventrículo izquierdo y su tracto de salida. [9] Estos defectos primarios se pueden dividir en aquellos que conducen a la obstrucción del tracto de salida o a la reducción del llenado del ventrículo izquierdo. [7] La obstrucción del tracto de salida conduce a la hipertrofia ventricular izquierda y a la reducción del lumen ventricular izquierdo. Un ejemplo de esto sería el caso de la estenosis aórtica. La estenosis aórtica que se produce durante el desarrollo fetal produce un estrés adicional en el ventrículo izquierdo en el útero. Esto puede conducir eventualmente a una disminución de la perfusión a través del ventrículo izquierdo, lo que se cree que inhibe el crecimiento ventricular. [19]
Al nacer, el conducto arterioso todavía está abierto y la resistencia al flujo sanguíneo en los pulmones es mayor de lo normal. Esto permite una oxigenación adecuada a través de la mezcla entre las aurículas y una apariencia normal al nacer. Cuando el conducto comienza a cerrarse y la resistencia vascular pulmonar disminuye, el flujo sanguíneo a través del conducto se restringe y el flujo a los pulmones aumenta. [5]
En la anatomía típica, el lado izquierdo del corazón recibe sangre rica en oxígeno de los pulmones y la bombea al resto del cuerpo. Los pacientes con HLHS pueden tener una serie de malformaciones cardíacas que finalmente conducen a un ventrículo izquierdo diminuto que no puede suministrar suficiente flujo sanguíneo al resto del cuerpo. [20] Hay tres variantes anatómicas principales de la enfermedad que se diferencian por la estenosis o atresia de la válvula aórtica y mitral. [20]
El subtipo de atresia mitral y atresia aórtica (MA-AA) es la forma más grave de HLHS, que provoca que no entre flujo sanguíneo alguno en el ventrículo izquierdo, lo que no permite la salida del ventrículo izquierdo. [20] En el subtipo de estenosis mitral y atresia aórtica (MS-AA), la sangre puede llenar el ventrículo izquierdo, pero no puede ser suministrada a la circulación sistémica a través de la aorta ascendente hipoplásica. [20] Por último, la forma más leve es el subtipo de estenosis mitral y estenosis aórtica (MS-AS). [20] En estos pacientes, aunque el ventrículo izquierdo puede suministrar algo de flujo sanguíneo al resto del cuerpo, el gasto sistémico general del ventrículo izquierdo sigue siendo inadecuado. [20]
En todos estos casos, el ventrículo izquierdo no puede bombear sangre al resto del cuerpo. El neonato depende de la sangre que fluye a través de un defecto del tabique auricular para mezclar la sangre oxigenada y desoxigenada, y de un conducto arterioso persistente para permitir que la sangre llegue a la aorta y a la circulación sistémica a través del ventrículo derecho. Esto es lo que define al HLHS como un defecto de " ventrículo único ". [15]
Debido al subdesarrollo del lado izquierdo del corazón en el útero , el aumento de la poscarga provoca hipertensión de la aurícula izquierda, edema pulmonar y, por lo tanto, daño pulmonar al feto antes del nacimiento. [19]
El síndrome del corazón izquierdo hipoplásico se puede diagnosticar prenatalmente o después del nacimiento mediante ecocardiografía. Los hallazgos típicos incluyen un ventrículo izquierdo y una aorta pequeños, anomalías de las válvulas mitral y aórtica, flujo retrógrado en el arco transversal de la aorta y flujo de izquierda a derecha entre las aurículas. A menudo se reconoce durante el segundo trimestre del embarazo, entre las 18 y 24 semanas de gestación. [5]
La radiografía de tórax también se puede utilizar para diagnosticar el síndrome del corazón izquierdo hipoplásico y, por lo general, muestra una silueta cardíaca agrandada junto con signos de hipertensión pulmonar. Los análisis de sangre y las pruebas genéticas también siguen siendo de gran importancia y deben incluir un hemograma completo, electrolitos, lactato y gasometría arterial para evaluar el estado ácido-base y la oxigenación. Puede ser beneficioso obtener pruebas genéticas y se han asociado con múltiples anomalías cromosómicas, incluidos los síndromes de Turner, DiGeorge y Down. [21]
Sin intervenciones que prolonguen la vida, el HLHS es mortal, pero con intervención, un bebé puede sobrevivir. Un cirujano cardiotorácico puede realizar una serie de operaciones o un trasplante de corazón completo . Si bien la intervención quirúrgica se ha convertido en el estándar de atención en los Estados Unidos, otros sistemas nacionales de salud, en particular en Francia, abordan el diagnóstico del HLHS de una manera más conservadora, con énfasis en la interrupción del embarazo o la atención compasiva después del parto. [8]
Antes de la cirugía, el conducto debe mantenerse abierto para permitir el flujo sanguíneo mediante el uso de medicamentos que contengan prostaglandina . [9] En los bebés con síndrome del corazón izquierdo hipoplásico se utiliza aire con menos oxígeno de lo normal. Estos niveles bajos de oxígeno aumentan la resistencia vascular pulmonar (RVP) y, por lo tanto, mejoran el flujo sanguíneo al resto del cuerpo debido a la mayor diferencia de presión entre los pulmones y el cuerpo. Para lograr niveles de oxígeno por debajo de la atmósfera se requiere el uso de nitrógeno inhalado. [22] El óxido nítrico es un potente vasodilatador pulmonar y, por lo tanto, reduce la RVP y mejora el retorno venoso. Cualquier factor que aumente la RVP impedirá el flujo del lado derecho. [23] [24]
Las operaciones quirúrgicas para tratar la hipoplasia del corazón izquierdo son complejas y deben individualizarse para cada paciente. Un cardiólogo debe evaluar todas las opciones médicas y quirúrgicas caso por caso. [ cita requerida ]
En la actualidad, los bebés se someten a una cirugía reconstructiva por etapas ( procedimiento Norwood o Sano a los pocos días de nacer, procedimiento Glenn o Hemi-Fontan a los 3 a 6 meses de edad y procedimiento Fontan a los 1 1/2 a 5 años de edad) o trasplante cardíaco. [10] Las expectativas actuales son que el 70% de aquellos con HLHS pueden llegar a la edad adulta. [18] Muchos estudios muestran que cuanto mayor sea el volumen (número de cirugías realizadas) en un hospital, menor será la tasa de mortalidad (muerte). [25] [26] Los factores que aumentan el riesgo de un bebé incluyen un menor peso al nacer, anomalías congénitas adicionales, un síndrome genético o aquellos con un tabique auricular altamente restrictivo. [27] Para los pacientes sin estos factores de riesgo adicionales, la supervivencia a 5 años ahora se acerca al 80%. [27] Los estudios muestran que aproximadamente el 75% de los niños que sobreviven a la cirugía muestran retrasos en el desarrollo en una o más áreas, como discapacidades motoras, cognitivas o del lenguaje, y aproximadamente un tercio de los niños con ventrículo único sin síndrome genético tienen discapacidades significativas. [28] La investigación actual se centra en trazar un mapa de las conexiones entre las lesiones del desarrollo neurológico, los procedimientos quirúrgicos y de cuidados intensivos y la susceptibilidad genética con el objetivo de modificar las intervenciones que perjudican los resultados psicosociales y del desarrollo neurológico. [29] Una alternativa al procedimiento Norwood tradicional es el procedimiento híbrido. [30]
Algunos médicos ofrecen cuidados compasivos en lugar de cirugías, que resultan en la muerte del niño, generalmente dentro de las 2 semanas posteriores al nacimiento. Los cuidados compasivos son supervisados por un médico y pueden llevarse a cabo en el hospital o en el hogar. Sin embargo, debido a la gran mejora de la intervención quirúrgica, con muchos hospitales logrando una supervivencia de más del 90%, existe un debate sobre si se debe seguir ofreciendo cuidados compasivos a las familias. [31] Un estudio realizado en 2003 concluyó que una selección de médicos que son expertos en el cuidado de niños con HLHS estaban divididos de manera uniforme cuando se les preguntó qué harían si sus propios hijos nacieran con HLHS, con 1/3 afirmando que elegirían la cirugía, 1/3 afirmando que elegirían un tratamiento paliativo (compasivo) sin cirugía, y 1/3 afirmando que no están seguros de qué opción elegirían. [32]
El procedimiento de tres etapas es un procedimiento paliativo (no una cura), ya que se hace que la circulación del niño funcione con solo dos de las cuatro cámaras del corazón. [ cita requerida ]

El primer paso es el procedimiento de Norwood . [33] En este procedimiento, se utiliza el ventrículo derecho para bombear sangre a la circulación sistémica. Dado que el ventrículo derecho ya no bombea sangre directamente a los pulmones, se requiere una derivación para pasar la sangre desoxigenada a través de los pulmones. Se puede conectar la arteria subclavia a la circulación pulmonar ( derivación de Blalock-Taussig ) o se realiza una derivación directamente desde el ventrículo derecho a la circulación pulmonar ( derivación de Sano ). La aorta estrecha se agranda utilizando un parche para mejorar el flujo sanguíneo al cuerpo. [34]
Durante este período, el bebé puede estar médicamente frágil y tener problemas de alimentación debido a que el corazón está trabajando muy duro. Hay un grado considerable de mezcla venosa en el ventrículo derecho, lo que conduce a una menor saturación de oxígeno. Además, tanto la derivación de Blalock-Taussig como la de Sano exponen los pulmones a presiones arteriales sistémicas, lo que conduce a una hipertensión pulmonar a largo plazo y, finalmente, a una insuficiencia cardíaca. [33]
El procedimiento híbrido puede utilizarse en lugar del procedimiento Norwood. [33] [35] [36] El procedimiento híbrido no requiere el uso de un bypass cardiopulmonar ni la realización de una esternotomía . En lugar de una cirugía de seis horas, el procedimiento híbrido suele tardar entre una y dos horas. En este procedimiento, se coloca un stent en el conducto arterioso para mantener su permeabilidad y se colocan bandas sobre las ramas de la arteria pulmonar izquierda y derecha para limitar la presión y la sobrecirculación a los pulmones. [37] Los resultados con el enfoque híbrido son comparables a los del procedimiento Norwood. [38]
La segunda etapa, la operación bidireccional Glenn o Hemi-Fontan (ver también el procedimiento de Kawashima ), alivia algunos de los problemas introducidos por la paliación de la Etapa I. [33] En esta operación, se liga la vena cava superior del corazón y se conecta a la circulación pulmonar. En este momento, se retira la derivación Blalock-Taussig o Sano. Los pulmones ya no están expuestos a presiones arteriales sistémicas, sino a presiones venosas mucho más bajas. Aunque la sangre venosa de la mitad superior del cuerpo ya no se mezcla con la sangre oxigenada en el ventrículo derecho, todavía hay mezcla venosa de la mitad inferior del cuerpo, lo que lleva a cierto grado de desaturación de oxígeno. [33]
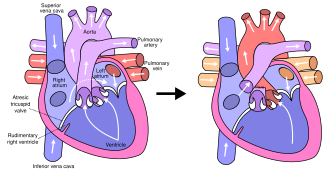
El procedimiento final, el procedimiento de Fontan , completa la reparación del corazón izquierdo hipoplásico. [33] Aunque existen varias variaciones, el efecto funcional es redirigir la sangre venosa desde la parte inferior del cuerpo (a través de la vena cava inferior) lejos de la aurícula derecha hacia la arteria pulmonar. Esto debería eliminar cualquier mezcla de sangre oxigenada y desoxigenada en el ventrículo derecho. El ventrículo derecho realiza el trabajo tradicional del izquierdo, suministrando al cuerpo sangre oxigenada, mientras que la presión venosa sistémica pasiva realiza el trabajo tradicional del derecho, pasando sangre desoxigenada a los pulmones. [33]
Se están investigando las intervenciones realizadas durante el desarrollo fetal. Cuando se detectan signos de HLHS prenatalmente mediante ecografía, un procedimiento percutáneo que implica la inserción de un catéter con balón puede abrir el defecto del tabique auricular para prevenir la hipertensión auricular izquierda y promover un mejor desarrollo del corazón. [39] [40]
El 95% de los bebés con HLHS no tratados mueren en las primeras semanas de vida. [5]
La supervivencia temprana ha mejorado desde la introducción del procedimiento de Norwood. [18] Dado que no existen estudios a largo plazo de adultos con HLHS, las estadísticas generalmente se derivan de pacientes post-Fontan; se estima que el 70% de los pacientes con HLHS pueden llegar a la edad adulta. [18]
El pronóstico depende de la salud del niño, ya que las enfermedades infantiles más comunes exigen una mayor frecuencia cardíaca y respiratoria. Esta población frágil tiene poca reserva cardíaca para satisfacer estas demandas y proporcionar estabilidad hemodinámica durante las enfermedades. [41]
Los niños con HLHS y otras afecciones comparables de ventrículo único, como grupo, tienen peores resultados de desarrollo neurológico que sus pares sanos. Se han demostrado déficits en el lenguaje, el funcionamiento ejecutivo y mayores tasas de trastornos de ansiedad y depresión . [42] Algunos de estos resultados pueden ser una consecuencia de factores genéticos asociados con HLHS, y otros pueden ser modificables a través de cambios en los procedimientos y en el entorno de atención médica. Existe un consenso clínico emergente en torno a la importancia de la vigilancia continua del desarrollo neurológico desde los primeros años hasta la edad adulta. [11] [43] Además, un metanálisis reciente que comparó veintidós estudios mostró que el 64,7% de los estudios informaron un desarrollo motor retrasado en niños con fisiologías de ventrículo único, como el síndrome del corazón izquierdo hipoplásico. [12]
Como sucede con los pacientes con otros tipos de defectos cardíacos que implican válvulas malformadas, [44] los pacientes con HLHS corren un alto riesgo de endocarditis y deben ser controlados por un cardiólogo durante el resto de sus vidas para verificar su función cardíaca. [ cita requerida ]
El trasplante de corazón puede estar indicado, generalmente después de completar la cirugía de Fontan. [18] Un estudio multicéntrico (de pacientes sometidos a la cirugía de Fontan entre 1993 y 2001) informó una tasa de supervivencia a 1 año del 76 % en pacientes que sobrevivieron al trasplante. [45]
Una revisión sistemática encontró 23 artículos, publicados desde 2010, así como nueve ensayos clínicos relevantes relacionados con la cardiopatía congénita y los avances recientes en terapias con células madre. [46] La investigación preclínica se ha centrado en varios tipos de células madre, entre ellas: células madre mesenquimales (MSC), células de sangre del cordón umbilical autólogas, células madre cardíacas c-kit+ y células madre mesenquimales del timo neonatal. [46] Estos tipos de células han demostrado la capacidad de diferenciarse en tejido cardíaco, lo que las hace ideales para la terapia regenerativa cardíaca. El primer uso de células de sangre del cordón umbilical autólogas se realizó en la Clínica Mayo en 2015 y se descubrió que aumentaba la función ventricular derecha en el paciente después del procedimiento. [46] El primer uso de células progenitoras cardíacas se produjo en el ensayo de infusión transcoronaria de células progenitoras cardíacas en pacientes con fisiología de ventrículo único (TICAP) de 2011. [46]
Hay varios estudios en curso que prueban la viabilidad y eficacia de las terapias con células madre para enfermedades de ventrículo único como el HLHS. [46] Estos ensayos se centran en cuáles son las células madre más efectivas, cuál es el mejor momento en la reparación de tres etapas y cuál es el método de administración óptimo.
Es importante tener en cuenta que los pacientes con HLHS tienen un mayor riesgo de desarrollar insuficiencia cardíaca en la edad adulta. Aún se desconoce si estas posibles terapias reducirían el riesgo futuro de insuficiencia cardíaca en estos pacientes.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite journal}}: Requiere citar revista |journal=( ayuda )