En química orgánica , la oxidación de Swern , llamada así por Daniel Swern , es una reacción química mediante la cual un alcohol primario o secundario ( −OH ) se oxida a un aldehído ( −CH=O ) o cetona ( >C=O ) utilizando cloruro de oxalilo , dimetilsulfóxido (DMSO) y una base orgánica , como la trietilamina . [1] [2] [3] Es una de las muchas reacciones de oxidación comúnmente conocidas como oxidaciones de "DMSO activado". La reacción es conocida por su carácter suave y amplia tolerancia de grupos funcionales . [4] [5] [6] [7]

Los subproductos son sulfuro de dimetilo ((CH3 ) 2S ) , monóxido de carbono (CO), dióxido de carbono (CO2 ) y, cuando se utiliza trietilamina como base, cloruro de trietilamonio (Et3NHCl ) . De los subproductos volátiles, el sulfuro de dimetilo tiene un olor fuerte y penetrante y el monóxido de carbono es extremadamente tóxico, por lo que la reacción y el tratamiento deben realizarse en una campana extractora. El sulfuro de dimetilo es un líquido volátil (punto de ebullición 37 °C) con un olor desagradable incluso en concentraciones bajas. [8] [9] [10]
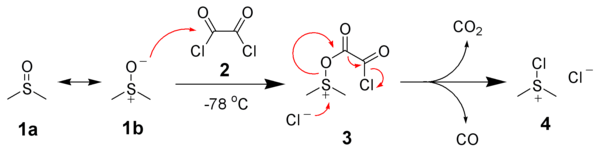
El primer paso de la oxidación de Swern es la reacción a baja temperatura del DMSO, 1a , formalmente como contribuyente de resonancia 1b , con cloruro de oxalilo, 2 . El primer intermedio, 3 , se descompone rápidamente emitiendo dióxido de carbono y monóxido de carbono y produciendo cloruro de cloro(dimetil)sulfonio, 4 .
Después de la adición del alcohol 5 , el cloruro de cloro(dimetil)sulfonio 4 reacciona con el alcohol para dar el ion alcoxisulfonio intermedio clave, 6. La adición de al menos 2 equivalentes de base, típicamente trietilamina, desprotonará el ion alcoxisulfonio para dar el iluro de azufre 7. En un estado de transición de anillo de cinco miembros , el iluro de azufre 7 se descompone para dar sulfuro de dimetilo y el compuesto carbonílico deseado 8 .

Cuando se utiliza cloruro de oxalilo como agente de deshidratación , la reacción debe mantenerse a una temperatura inferior a −60 °C para evitar reacciones secundarias. Con cloruro cianúrico [11] o anhídrido trifluoroacético [12] en lugar de cloruro de oxalilo, la reacción se puede calentar a −30 °C sin reacciones secundarias. Otros métodos para la activación de DMSO para iniciar la formación del intermedio clave 6 son el uso de carbodiimidas ( oxidación de Pfitzner-Moffatt ), un complejo de trióxido de azufre-piridina ( oxidación de Parikh-Doering ) o anhídrido acético ( oxidación de Albright-Goldman ). El intermedio 4 también se puede preparar a partir de sulfuro de dimetilo y N -clorosuccinimida ( oxidación de Corey-Kim ).
En algunos casos, el uso de trietilamina como base puede provocar la epimerización en el carbono alfa del nuevo carbonilo formado. El uso de una base más voluminosa , como la diisopropiletilamina , puede mitigar esta reacción secundaria.
El sulfuro de dimetilo, un subproducto de la oxidación de Swern, es uno de los olores más desagradables conocidos en la química orgánica. Los seres humanos pueden detectar este compuesto en concentraciones tan bajas como 0,02 a 0,1 partes por millón. [13] Un remedio simple para este problema es enjuagar la cristalería usada con lejía o solución de oxona , que oxidará el sulfuro de dimetilo de nuevo a dimetilsulfóxido o a dimetilsulfona , ambos inodoros y no tóxicos. [14]
Las condiciones de reacción permiten la oxidación de compuestos sensibles a los ácidos, que podrían descomponerse en condiciones de oxidación ácida, como la oxidación de Jones . Por ejemplo, en la síntesis de Thompson y Heathcock del isovelleral sesquiterpénico , [15] el paso final utiliza el protocolo de Swern, evitando la reorganización de la fracción de ciclopropanometanol sensible a los ácidos.

{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ); Volúmenes recopilados , vol. 10, pág. 320.{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )