Un complejo de metal salen es un compuesto de coordinación entre un catión metálico y un ligando derivado de N , N ′-bis(salicilideno)etilendiamina , comúnmente llamado salen. El ejemplo clásico es la salcomina , el complejo con cobalto divalente Co 2+ , normalmente denominado Co(salen). [1] Estos complejos se investigan ampliamente como catalizadores e imitadores de enzimas. [2] [3]

El compuesto salen libre de metales (H 2 salen o salenH 2 ) tiene dos grupos hidroxilo fenólicos . El ligando salen suele ser su base conjugada (salen 2− ), resultante de la pérdida de protones de esos grupos hidroxilo. El átomo de metal suele formar cuatro enlaces de coordinación con los átomos de oxígeno y nitrógeno .
El anión salen forma complejos con la mayoría de los metales de transición . Estos complejos generalmente se preparan mediante la reacción de H2 salen ("proligando") con precursores metálicos que contienen bases incorporadas, como alcóxidos , amidas metálicas o acetato metálico . El proligando también puede tratarse con un haluro metálico , con o sin una base añadida. Por último, el proligando puede ser desprotonado por una base no nucleofílica, como el hidruro de sodio , antes del tratamiento con el haluro metálico. Por ejemplo, el catalizador de Jacobsen se prepara a partir del precursor del ligando salen con acetato de manganeso . [4]
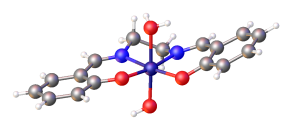
Los complejos de Salen con iones metálicos d 8 , como el Ni (salen), suelen tener una geometría molecular plana cuadrada de bajo espín en la esfera de coordinación .
Otros complejos metal-salen pueden tener ligandos adicionales por encima del plano salen nitrógeno-oxígeno. Los complejos con un ligando adicional, como VO (salen), pueden tener una geometría molecular piramidal cuadrada . Los complejos con dos ligandos adicionales, como Co(salen)Cl( py ), pueden tener geometría octaédrica . Por lo general, el núcleo de MN 2 O 2 es relativamente plano, aunque la columna vertebral de etileno está sesgada y el ligando salen general adopta una simetría C 2 torcida . Existen ejemplos en los que los ligandos auxiliares fuerzan a los donantes de N 2 O 2 a salir de la planaridad. [6] Ninguna evidencia indica que salen sea un ligando redox-no inocente .

El aducto de piridina del complejo de cobalto (II) Co(salen)(py) ( salcomina ) tiene una estructura piramidal cuadrada . Es un portador de dioxígeno formando un complejo octaédrico lábil de O2 . [8] [9]
El nombre "ligandos salen" se utiliza para ligandos tetradentados que tienen estructuras similares. Por ejemplo, en salpn hay un sustituyente metilo en el puente. Se utiliza como aditivo desactivador de metales en combustibles. [10] La presencia de grupos voluminosos cerca del sitio de coordinación puede mejorar la actividad catalítica de un complejo metálico y prevenir su dimerización. Los ligandos salen derivados del 3,5-di- terc -butilsalicilaldehído cumplen estas funciones y también aumentan la solubilidad de los complejos en disolventes no polares como el pentano . Se pueden crear ligandos quirales "salen" mediante la sustitución adecuada del esqueleto de diamina, el anillo de fenilo o ambos. [11] Un ejemplo es el ligando obtenido por condensación del trans -1,2- diaminociclohexano simétrico C2 con 3,5-di- terc - butilsalicilaldehído. Los ligandos quirales se pueden utilizar en reacciones de síntesis asimétricas , como la epoxidación de Jacobsen : [4] [12]
Tsumaki describió los primeros complejos metal-salen en 1938. Descubrió que el complejo cobalto(II) Co(salen) se une reversiblemente al O 2 , lo que llevó a una investigación intensiva sobre los complejos de cobalto de salen y ligandos relacionados por su capacidad de almacenamiento y transporte de oxígeno. , en busca de potenciales portadores sintéticos de oxígeno . [1] Los complejos de cobalto salen también replican ciertos aspectos de la vitamina B 12 .
El complejo salen que contiene manganeso cataliza la epoxidación asimétrica de alquenos . En la técnica de resolución cinética hidrolítica , se puede separar una mezcla racémica de epóxidos hidrolizando selectivamente un enantiómero , catalizado por el complejo análogo de cobalto (III). [13] En trabajos posteriores, los complejos salen de cromo (III) y cobalto (III) catalizan la reacción del dióxido de carbono y los epóxidos para dar policarbonatos . [14]


Los complejos de salen per se son poco solubles en disolventes orgánicos . La sustitución de la estructura orgánica aumenta la solubilidad del complejo. Un ejemplo es el ligando salpn , derivado del 1,2-diaminopropano en lugar de etilendiamina , que se utiliza como aditivo desactivador de metales en aceites y combustibles para motores . [15]
La presencia de grupos voluminosos adyacentes al grupo fenóxido puede dar complejos con actividad catalítica mejorada. Estos sustituyentes suprimen la formación de dímeros . Por estas razones, los ligandos salen derivados del 3,5-di- terc -butilsalicilaldehído han recibido un escrutinio particular.
La quiralidad se puede introducir en el ligando a través del esqueleto de diamina, a través del anillo de fenilo o ambos. [11] Por ejemplo, la condensación del trans -1,2- diaminociclohexano simétrico C 2 con tinte 3,5-di- terc -butilsalicilaldehído da un ligando que forma complejos con Cr, Mn, Co, Al, que han demostrado ser útiles para transformaciones asimétricas . Para ver un ejemplo, consulte la epoxidación de Jacobsen , que está catalizada por un complejo quiral de manganeso -salen: [4]
X
El nombre “salen” o “tipo salen” puede usarse para otros ligandos que tienen un entorno similar alrededor del sitio quelante, es decir, dos grupos hidroxilos ácidos y dos grupos de bases de Schiff (arilimina ) . Estos incluyen los ligandos abreviados como salph, provenientes de la condensación de 1,2-fenilendiamina y salicilaldehído. Otros complejos metálicos "tipo Salen" se forman con ligandos con grupos quelantes similares , como salph y salqu. Los complejos de cobre de Salqu se han investigado como catalizadores de oxidación. [dieciséis]
Los ligandos salan o salalen tienen uno o dos enlaces nitrógeno-arilo saturados ( aminas en lugar de iminas ). Son menos rígidos y más ricos en electrones en el centro metálico que los correspondientes complejos salen. [17] [18] Los salans se pueden sintetizar mediante la alquilación de una amina apropiada con un haluro de alquilo fenólico . Los ligandos "medio salen" tienen un solo grupo salicilimina. Se preparan a partir de un salicilaldehído y una monoamina. [19]

Una clase de ligandos tetradentados con el nombre genérico de acacen se obtienen por condensación de derivados de acetilacetona y etilendiamina . [20]
{{cite encyclopedia}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )