La reacción de Povarov es una reacción orgánica descrita como una cicloadición formal entre una imina aromática y un alqueno . La imina en esta reacción orgánica es un producto de reacción de condensación de un compuesto de tipo anilina y un compuesto de tipo benzaldehído . [1] [2] [3] El alqueno debe ser rico en electrones, lo que significa que los grupos funcionales unidos al alqueno deben poder donar electrones. Dichos alquenos son éteres enólicos y enaminas . El producto de reacción en la reacción de Povarov original es una quinolina . Debido a que las reacciones se pueden llevar a cabo con los tres componentes premezclados en un reactor, es un ejemplo de una reacción de múltiples componentes .
El mecanismo de reacción para la reacción de Povarov a la quinolina se describe en el Esquema 1. En el paso uno, la anilina y el benzaldehído reaccionan con la base de Schiff en una reacción de condensación . La reacción de Povarov requiere un ácido de Lewis como el trifluoruro de boro para activar la imina para una adición electrofílica del alqueno activado . Este paso de reacción forma un ion oxonio que luego reacciona con el anillo aromático en una sustitución aromática electrofílica clásica . Dos reacciones de eliminación adicionales crean la estructura del anillo de quinolina.
La reacción también se clasifica como un subconjunto de las reacciones aza Diels-Alder ; [4] sin embargo, ocurre mediante un mecanismo escalonado en lugar de concertado.
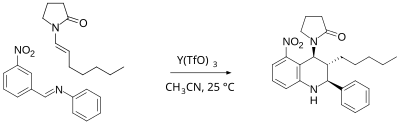
La reacción representada en el Esquema 2 ilustra la reacción de Povarov con una imina y una enamina en presencia de triflato de itrio como ácido de Lewis . [5] Esta reacción es regioselectiva porque el ion iminio ataca preferentemente la posición orto del nitro y no la posición para . El grupo nitro es un sustituyente director meta pero como esta posición está bloqueada, la posición del anillo más rica en electrones ahora es orto y no para. La reacción también es estereoselectiva porque la adición de la enamina ocurre con una preferencia diastereomérica por la adición trans sin formación del isómero cis . Esto contrasta con las reacciones tradicionales de Diels-Alder , que son estereoespecíficas basadas en la geometría del alqueno.
En 2013, Doyle y colaboradores informaron sobre una reacción formal de cicloadición [4+2] de tipo Povarov entre ciclopropenos donantes-aceptores e iminas (Esquema 3). En el primer paso, un catalizador de dirodio efectúa la descomposición diazo a partir de un compuesto diazo de éter de enol de sililo para producir un ciclopropeno donante/aceptor. Luego, el ciclopropeno donante/aceptor se hace reaccionar con una aril imina en condiciones catalizadas con triflato de escandio (III) para producir tetrahidroquinolinas fusionadas con ciclopropano con buenos rendimientos y diastereoselectividades. El tratamiento de estos compuestos con TBAF invoca una expansión de anillo que proporciona las benzazepinas correspondientes. [6]

Una variación de la reacción de Povarov es una reacción de cuatro componentes. [7] Mientras que en la reacción de Povarov tradicional el carbocatión intermedio da lugar a una reacción intramolecular con el grupo arilo, este intermedio también puede terminarse con un nucleófilo adicional, como un alcohol . El esquema 4 representa esta reacción de 4 componentes con el éster etílico del ácido glioxílico , 3,4-dihidro-2H-pirano, anilina y etanol con triflato de escandio (III) de ácido de Lewis y tamices moleculares .