La reacción de Doebner-Miller es la reacción orgánica de una anilina con compuestos carbonílicos α,β-insaturados para formar quinolinas . [1] [2] [3] [4] [5]

Esta reacción también se conoce como síntesis de quinolinas de Skraup-Doebner-Von Miller , y recibe su nombre del químico checo Zdenko Hans Skraup (1850-1910) y de los alemanes Oscar Döbner (Doebner) (1850-1907) y Wilhelm von Miller (1848-1899). Cuando el compuesto carbonílico α,β-insaturado se prepara in situ a partir de dos compuestos carbonílicos (mediante una condensación aldólica ), la reacción se conoce como método de Beyer para quinolinas .
La reacción es catalizada por ácidos de Lewis como el tetracloruro de estaño y el triflato de escandio (III) y ácidos de Brønsted como el ácido p -toluenosulfónico , el ácido perclórico , la amberlita y el yodo .
El mecanismo de reacción para esta reacción y la síntesis de Skraup relacionada es un tema de debate. Un estudio de 2006 [6] propone un mecanismo de fragmentación-recombinación basado en experimentos de mezcla de isótopos de carbono . En este estudio, la 4-isopropilanilina 1 se hace reaccionar con una mezcla (50:50) de pulegona ordinaria y el isómero 2 enriquecido con 13 C y el mecanismo de reacción se describe en el esquema 2 con el carbono marcado identificado con un punto rojo. El primer paso es una adición conjugada nucleofílica de la amina con el enol a la amina cetona 3 en una reacción reversible . Este intermedio luego se fragmenta en la imina 4a y la ciclohexanona saturada 4b en una reacción no reversible y ambos fragmentos se recombinan en una reacción de condensación para dar la imina conjugada 5 . En el siguiente paso, el 5 reacciona con una segunda molécula de anilina en una adición conjugada nucleofílica a la imina 6 y la posterior adición electrofílica y transferencia de protones conduce al 7. La eliminación de una molécula de anilina a través del 8 y la rearomatización conducen al producto final 9. Debido a que los protones α-amino no están disponibles en este compuesto modelo, la reacción no se lleva a la quinolina completamente desarrollada.
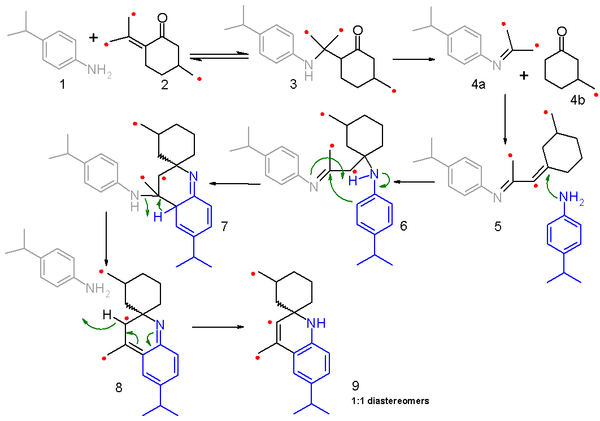
La fragmentación en 4a y 4b es clave para este mecanismo porque explica los resultados de la mezcla de isótopos. En la reacción, solo la mitad del reactivo pulegona ( 2 ) está marcado y, al recombinarse, un fragmento de imina marcado puede reaccionar con otro fragmento de cetona marcado o un fragmento no marcado y, de la misma manera, un fragmento de cetona marcado puede reaccionar con un fragmento de imina marcado o no marcado. La distribución del producto resultante se confirma mediante espectrometría de masas del producto final 9. [7]