La reacción de Sonogashira es una reacción de acoplamiento cruzado utilizada en síntesis orgánica para formar enlaces carbono-carbono . Emplea un catalizador de paladio y un cocatalizador de cobre para formar un enlace carbono-carbono entre un alquino terminal y un haluro de arilo o vinilo . [1]
La reacción de acoplamiento cruzado de Sonogashira se ha empleado en una amplia variedad de áreas debido a su utilidad en la formación de enlaces carbono-carbono. La reacción se puede llevar a cabo en condiciones suaves, como a temperatura ambiente, en medios acuosos y con una base suave, lo que ha permitido el uso de la reacción de acoplamiento cruzado de Sonogashira en la síntesis de moléculas complejas. Sus aplicaciones incluyen productos farmacéuticos, productos naturales, materiales orgánicos y nanomateriales. [1] Los ejemplos específicos incluyen su uso en la síntesis de tazaroteno , [2] que es un tratamiento para la psoriasis y el acné , y en la preparación de SIB-1508Y, también conocido como Altiniclina , [3] un agonista del receptor nicotínico .
La reacción de alquinilación de haluros de arilo utilizando acetilenos aromáticos fue descrita en 1975 en tres contribuciones independientes de Cassar, [4] Dieck y Heck [5] , así como de Sonogashira , Tohda y Hagihara. [6] Todas las reacciones emplean catalizadores de paladio para producir los mismos productos de reacción. Sin embargo, los protocolos de Cassar y Heck se realizan únicamente mediante el uso de paladio y requieren condiciones de reacción duras (es decir, altas temperaturas de reacción). El uso de cocatalizador de cobre además de complejos de paladio en el procedimiento de Sonogashira permitió que las reacciones se llevaran a cabo en condiciones suaves con excelentes rendimientos. Siguió un rápido desarrollo de los sistemas Pd/Cu que permitió innumerables aplicaciones sintéticas, mientras que las condiciones de Cassar-Heck quedaron, tal vez injustamente, casi olvidadas. [7] La notable utilidad de la reacción puede evidenciarse por la cantidad de investigaciones que aún se realizan para comprender y optimizar sus capacidades sintéticas, así como para emplear los procedimientos para preparar diversos compuestos de importancia sintética, medicinal o material/industrial. [7] Entre las reacciones de acoplamiento cruzado, sigue en el número de publicaciones inmediatamente después de la reacción de Suzuki y Heck [8] y una búsqueda del término "Sonogashira" en SciFinder proporciona más de 1500 referencias de publicaciones en revistas entre 2007 y 2010. [7 ]
La reacción de Sonogashira se ha vuelto tan conocida que a menudo todas las reacciones que utilizan catalizadores organometálicos modernos para acoplar motivos alquinos se denominan alguna variante de "reacción de Sonogashira", a pesar de que estas reacciones no se llevan a cabo en las verdaderas condiciones de reacción de Sonogashira. [7]
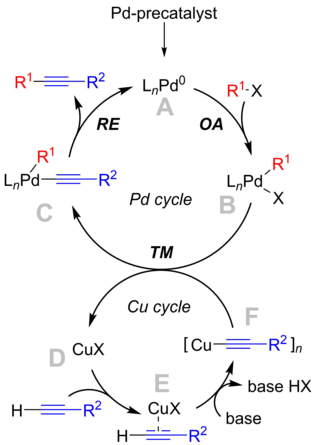
El mecanismo de reacción no se comprende claramente, pero el mecanismo de los libros de texto gira en torno a un ciclo del paladio, que concuerda con el mecanismo de acoplamiento cruzado "clásico" , y un ciclo del cobre, que es menos conocido. [9]
Aunque es beneficioso para la eficacia de la reacción, el uso de sales de cobre en la reacción "clásica" de Sonogashira va acompañado de varios inconvenientes, como la aplicación de reactivos perjudiciales para el medio ambiente, la formación de homoacoplamientos de alquinos indeseables ( productos secundarios de Glaser ) y la necesidad de de estricta exclusión de oxígeno en la mezcla de reacción. Así, con el objetivo de excluir el cobre de la reacción, se realizaron muchos esfuerzos en el desarrollo de la reacción de Sonogashira libre de Cu. A lo largo del desarrollo de nuevas condiciones de reacción, muchos estudios experimentales y computacionales se centraron en la dilucidación del mecanismo de reacción. [12] Hasta hace poco, el mecanismo exacto por el cual se produce la reacción libre de Cu estaba en debate, con preguntas mecanicistas críticas sin respuesta. [7] Fue demostrado en 2018 por Košmrlj et al. que la reacción se desarrolla a lo largo de los dos ciclos catalíticos de Pd 0 /Pd II interconectados . [13] [14]
Se demostró que las aminas son competitivas con las fosfinas y también pueden participar como ligandos L en las especies de reacción descritas. Dependiendo de la tasa de competencia entre aminas y fosfinas, se espera una interacción dinámica y compleja cuando se utilizan diferentes bases de coordinación. [15] [16] [13] [14]
La reacción de Sonogashira normalmente se lleva a cabo en condiciones suaves. [17] El acoplamiento cruzado se lleva a cabo a temperatura ambiente con una base, típicamente una amina, como dietilamina , [6] que también actúa como disolvente. El medio de reacción debe ser básico para neutralizar el haluro de hidrógeno producido como subproducto de esta reacción de acoplamiento, por lo que a veces se usan como solventes compuestos de alquilamina como trietilamina y dietilamina , pero también se pueden usar como solvente DMF o éter. Ocasionalmente se utilizan otras bases como carbonato de potasio o carbonato de cesio. Además, se necesitan formalmente condiciones desaireadas para las reacciones de acoplamiento de Sonogashira porque los complejos de paladio (0) son inestables en el aire y el oxígeno promueve la formación de acetilenos homoacoplados. Recientemente, el desarrollo de catalizadores de organopaladio estables al aire permite que esta reacción se lleve a cabo en la atmósfera ambiente. Además, RM Al-Zoubi y sus colaboradores desarrollaron con éxito un método con alta regioselectividad para derivados de 1,2,3-trihaloareno con rendimientos buenos o altos en condiciones ambientales. [18]
Normalmente, se necesitan dos catalizadores para esta reacción: un complejo de paladio cerovalente y una sal de haluro de cobre (I). Los ejemplos comunes de catalizadores de paladio incluyen aquellos que contienen ligandos de fosfina como [Pd(PPh 3 ) 4 ] . Otra fuente de paladio comúnmente utilizada es [ Pd(PPh 3 ) 2 Cl 2 ] , pero los complejos que contienen ligandos de fosfina bidentados , como [Pd( dppe )Cl 2 ] , [Pd( dppp )Cl 2 ] y [Pd(dppf) Cl 2 ] también se han utilizado. [9] El inconveniente de tales catalizadores es la necesidad de altas cargas de paladio (hasta 5 moles%), junto con una mayor cantidad de cocatalizador de cobre. [9] Los complejos de Pd II son de hecho precatalizadores , ya que deben reducirse a Pd 0 antes de que pueda comenzar la catálisis. Los complejos de Pd II generalmente exhiben mayor estabilidad que los complejos de Pd 0 y pueden almacenarse en condiciones normales de laboratorio durante meses. [19] Los catalizadores de Pd II se reducen a Pd 0 en la mezcla de reacción mediante una amina , un ligando de fosfina u otro reactivo en la mezcla que permite que la reacción avance. [20] Por ejemplo, la oxidación de trifenilfosfina a óxido de trifenilfosfina puede conducir a la formación de Pd 0 in situ cuando se utiliza [Pd(PPh 3 ) 2 Cl 2 ] .
Las sales de cobre (I), como CuI , reaccionan con el alquino terminal y producen un acetiluro de cobre (I), que actúa como una especie activada para las reacciones de acoplamiento. Cu(I) es un cocatalizador en la reacción y se utiliza para aumentar la velocidad de la reacción. [7]
La elección del sustrato de haluro de arilo o pseudohaluro (carbono sp 2 ) es uno de los factores que influyen principalmente en la reactividad del sistema catalítico de Sonogashira. La reactividad de los haluros es mayor hacia el yodo y los haluros de vinilo son más reactivos que los haluros de arilo análogos. El acoplamiento de los yoduros de arilo se produce a temperatura ambiente, mientras que los bromuros de arilo requieren calentamiento.
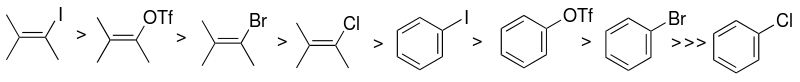
Esta diferencia en reactividad se puede aprovechar para acoplar selectivamente un yoduro de arilo pero no un bromuro de arilo, realizando la reacción a temperatura ambiente. [9] Un ejemplo es el acoplamiento simétrico de Sonogashira de dos equivalentes de 1-bromo-4-yodobenceno con trimetilsililacetileno (con el grupo trimetilsililo eliminado in situ) para formar bis(4-bromofenil)acetileno. [21]
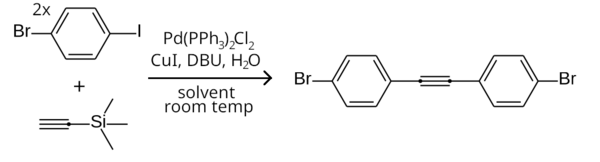
En lugar de haluros de arilo también se pueden emplear triflatos de arilo.
Se ha informado que las sales de arendiazonio son una alternativa a los haluros de arilo para la reacción de acoplamiento de Sonogashira. El cloruro de oro (I) se ha utilizado como cocatalizador combinado con cloruro de paladio (II) en el acoplamiento de sales de arendiazonio con alquinos terminales, proceso que se lleva a cabo en presencia de cloruro de bis-2,6-diisopropilfenil dihidroimidazolio (IPr NHC). (5% en moles) para generar in situ un complejo NHC-paladio y 2,6-di-terc-butil-4-metilpiridina (DBMP) como base en acetonitrilo como solvente a temperatura ambiente. [22] Este acoplamiento se puede llevar a cabo a partir de anilinas mediante la formación de la sal de diazonio seguido del acoplamiento de Sonogashira in situ , donde las anilinas se transforman en sal de diazonio y luego se convierten en alquino mediante acoplamiento con fenilacetileno.
Se pueden emplear diversos alquinos aromáticos para producir productos disustituidos deseados con rendimientos satisfactorios. Los alquinos alifáticos son generalmente menos reactivos.
Debido al papel crucial de la base, se deben agregar aminas específicas en exceso o como solvente para que se desarrolle la reacción. Se ha descubierto que aminas secundarias tales como piperidina, morfolina o diisopropilamina en particular pueden reaccionar eficiente y reversiblemente con complejos trans - RPdX(PPh 3 ) 2 sustituyendo un ligando PPh 3 . La constante de equilibrio de esta reacción depende de R, X, un factor de basicidad, y del impedimento estérico de la amina. [23] El resultado es la competencia entre la amina y el grupo alquino por este intercambio de ligando, razón por la cual la amina generalmente se agrega en exceso para promover la sustitución preferencial.
El trimetilsililacetileno es un reactivo comúnmente utilizado en los acoplamientos Sonogashira. [24] Al ser líquido, es un reactivo más conveniente que el acetileno gaseoso , y el grupo trimetilsililo evita la adición al otro extremo del grupo acetileno. Luego, el grupo trimetilsililo se puede eliminar usando TBAF , produciendo un acetileno monosustituido. También se puede eliminar usando DBU in situ, lo que permite que el acetileno monosustituido reaccione más con otro haluro de arilo para formar difenilacetileno y derivados. [21]
Si bien se agrega un cocatalizador de cobre a la reacción para aumentar la reactividad, la presencia de cobre puede resultar en la formación de dímeros de alquino. Esto conduce a lo que se conoce como reacción de acoplamiento de Glaser , que es una formación no deseada de productos de homoacoplamiento de derivados de acetileno tras la oxidación . Como resultado, cuando se realiza una reacción de Sonogashira con un cocatalizador de cobre, es necesario realizar la reacción en una atmósfera inerte para evitar la dimerización no deseada. Se han desarrollado variaciones sin cobre de la reacción de Sonogashira para evitar la formación de productos de homoacoplamiento. [19] [25] Hay otros casos en los que se debe evitar el uso de cobre, como reacciones de acoplamiento que involucran sustratos con ligandos potenciales de cobre, por ejemplo, porfirinas de base libre . [9]
En un acoplamiento inverso de Sonogashira, los reactivos son un compuesto de arilo o vinilo y un haluro de alquinilo. [26]
En algunos casos, se pueden usar cantidades estequiométricas de óxido de plata en lugar de CuI para acoplamientos Sonogashira sin cobre. [9]
Recientemente, se ha desarrollado un acoplamiento Sonogashira catalizado por níquel que permite el acoplamiento de haluros de alquilo no activados a acetileno sin el uso de paladio, aunque todavía se necesita un cocatalizador de cobre. [27] También se ha informado que el oro se puede utilizar como catalizador heterogéneo, lo que se demostró en el acoplamiento de fenilacetileno y yodobenceno con un catalizador de Au/CeO 2 . [28] [29] En este caso, la catálisis se produce de forma heterogénea en las nanopartículas de Au, [29] [30] con Au(0) como sitio activo. [31] También se descubrió que la selectividad hacia el producto de acoplamiento cruzado deseable aumentaba con soportes como CeO 2 y La 2 O 3 . [31] Además, los acoplamientos Sonogashira catalizados por hierro se han investigado como alternativas relativamente baratas y no tóxicas al paladio. En este caso, se propone que FeCl 3 actúe como catalizador de metal de transición y Cs 2 CO 3 como base, por lo que teóricamente procede a través de un mecanismo libre de paladio y cobre. [32]
Si bien se ha demostrado que el mecanismo sin cobre es viable, los intentos de incorporar los diversos metales de transición mencionados anteriormente como alternativas menos costosas a los catalizadores de paladio han mostrado un pobre historial de éxito debido a la contaminación de los reactivos con trazas de paladio, lo que sugiere que estos caminos teorizados son extremadamente improbables, si no imposibles, de lograr. [33]
Los estudios han demostrado que los materiales de partida orgánicos e inorgánicos también pueden contener suficiente paladio ( nivel de ppb ) para el acoplamiento. [34]
Se ha informado sobre una metodología combinada de oro y paladio altamente eficiente para el acoplamiento de Sonogashira de una amplia gama de haluros de arilo y heteroarilo electrónica y estructuralmente diversos. [35] La reactividad ortogonal de los dos metales muestra una alta selectividad y una tolerancia extrema del grupo funcional en el acoplamiento de Sonogashira. Un breve estudio mecanicista revela que el intermedio oro-acetiluro entra en el ciclo catalítico del paladio en el paso de transmetalación.
Los problemas relacionados con la recuperación del catalizador, a menudo costoso, después de la formación del producto plantean un serio inconveniente para las aplicaciones a gran escala de catálisis homogénea. [9] Las estructuras conocidas como metalodendrímeros combinan las ventajas de los catalizadores homogéneos y heterogéneos, ya que son solubles y están bien definidos a nivel molecular y, sin embargo, pueden recuperarse mediante precipitación, ultrafiltración o ultracentrifugación. [36] Se pueden encontrar algunos ejemplos recientes sobre el uso de catalizadores de complejos dendríticos de paladio para la reacción de Sonogashira sin cobre. Así, se han utilizado varias generaciones de catalizadores bidentados de fosfinapaladio(II) poliaminodendríticos solubilizados en trietilamina para el acoplamiento de yoduros y bromuros de arilo a 25-120 °C, y de cloruros de arilo, pero con rendimientos muy bajos. [37]

Los catalizadores dendrímeros normalmente podrían recuperarse mediante simple precipitación y filtración y reutilizarse hasta cinco veces, observándose una actividad disminuida producida por la descomposición del dendrímero y no por la lixiviación del paladio. Estos catalizadores dendrímeros mostraron un efecto dendrítico negativo; es decir, la eficiencia del catalizador disminuye a medida que aumenta la generación de dendrímero. Un ligando de fosfina polimérico reciclable se obtiene a partir de la polimerización por metátesis con apertura de anillo de un derivado de norborneno y se ha utilizado en la reacción de Sonogashira cocatalizada con cobre de p -yodobenzoato de metilo y fenilacetileno utilizando Pd(dba) 2 ·CHCl 3 como fuente de paladio. . [38] A pesar de la recuperación por filtración, la actividad catalítica del polímero disminuyó aproximadamente entre un 4% y un 8% en cada experimento de reciclaje.
Las piridinas y pirimidinas han mostrado buenas propiedades de complejación para el paladio y se han empleado en la formación de catalizadores adecuados para acoplamientos de Sonogashira. El complejo de dipirimidil-paladio que se muestra a continuación se ha empleado en el acoplamiento sin cobre de yodo, bromo y clorobenceno con fenilacetileno utilizando N-butilamina como base en un disolvente THF a 65 °C. Además, todas las características estructurales de este complejo se han caracterizado mediante extensos análisis de rayos X, verificando la reactividad observada. [39]
Más recientemente, el complejo de dipiridilpaladio se ha obtenido y se ha utilizado en la reacción de acoplamiento de Sonogashira sin cobre de yoduros y bromuros de arilo en N -metilpirrolidinona (NMP) utilizando acetato de tetra-n-butilamonio (TBAA) como base a temperatura ambiente. Este complejo también se ha utilizado para el acoplamiento de yoduros y bromuros de arilo en agua a reflujo como disolvente y en presencia de aire, utilizando pirrolidina como base y TBAB como aditivo, [40] aunque su eficiencia fue mayor en N -metilpirrolidinona (NMP) como solvente.

Los N -carbenos heterocíclicos (NHC) se han convertido en uno de los ligandos más importantes en la catálisis de metales de transición. El éxito de los NHC normales se atribuye en gran medida a sus capacidades superiores de donación de σ en comparación con las fosfinas, que es aún mayor en sus homólogos de NHC anormales. Empleados como ligandos en complejos de paladio, los NHC contribuyeron en gran medida a la estabilización y activación de precatalizadores y, por lo tanto, han encontrado aplicación en muchas áreas de la catálisis organometálica homogénea, incluidos los acoplamientos de Sonogashira. [9] [42] [43]
Ejemplos interesantes de NHC anormales se basan en la estructura mesoiónica de 1,2,3-triazol-5-ilideno. Se demostró que un eficiente catalizador catiónico de paladio de tipo PEPPSI , es decir, i PEPPSI ( estabilización e iniciación de la preparación del precatalizador mejorado con piridina interna ) cataliza eficientemente la reacción de Sonogashira sin cobre en agua como único solvente . en condiciones aeróbicas, en ausencia de cobre, aminas, fosfinas y otros aditivos. [42]
Los avances recientes en catálisis heterogénea permitieron el uso de materiales de óxido metálico, como nanocatalizadores de óxido cuproso , en tecnologías de procesamiento de flujo, que pueden permitir la producción económica de ingredientes farmacéuticos activos y varios otros productos químicos finos. [45]
Los acoplamientos Sonogashira se emplean en una amplia gama de reacciones sintéticas, principalmente debido a su éxito en facilitar las siguientes transformaciones desafiantes:
El acoplamiento de un alquino terminal y un anillo aromático es la reacción fundamental cuando se habla de aplicaciones de la reacción de Sonogashira promovida o sin cobre. La lista de casos en los que se ha empleado la reacción típica de Sonogashira utilizando haluros de arilo es larga y elegir ejemplos ilustrativos es difícil. A continuación se muestra un uso reciente de esta metodología para el acoplamiento de fenilalanina yodada con un alquino terminal derivado de d -biotina utilizando una especie de Pd 0 generada in situ como catalizador, lo que permitió la preparación de un derivado de fenilalanina unido a alquino para aplicaciones bioanalíticas. [46] También hay ejemplos de socios de acoplamiento que están unidos a resinas alílicas, con el catalizador de Pd 0 efectuando la escisión de los sustratos y el posterior acoplamiento de Sonogashira en solución. [47]

Muchos metabolitos que se encuentran en la naturaleza contienen restos alquinos o eninos y, por lo tanto, la reacción de Sonogashira ha encontrado utilidad frecuente en sus síntesis. [48] Varias de las aplicaciones más recientes y prometedoras de esta metodología de acoplamiento hacia la síntesis total de productos naturales emplearon exclusivamente la reacción típica cocatalizada con cobre.
Un ejemplo del acoplamiento de un yoduro de arilo a un arilacetileno se puede ver en la reacción de un alcohol yodado y tris(isopropil)sililacetileno, que dio un alquino, un intermedio en la síntesis total del alcaloide de bencindenoazepina bulgaramina. [49]

Hay otros ejemplos recientes del uso de yoduros de arilo para la preparación de intermedios en condiciones típicas de Sonogashira, que, después de la ciclación, producen productos naturales como la bencilisoquinolina [50] o los alcaloides indol [51]. Un ejemplo es la síntesis de los alcaloides de bencilisoquinolina. (+)-( S ) -laudanosina y (–)-( S )-xilopinina. La síntesis de estos productos naturales implicó el uso del acoplamiento cruzado de Sonogashira para construir la columna vertebral de carbono de cada molécula. [50]

El resto 1,3-enino es una unidad estructural importante para compuestos biológicamente activos y naturales. [ cita necesaria ] Puede derivarse de sistemas vinílicos y acetilenos terminales mediante el uso de un procedimiento estereoespecífico de retención de configuración como la reacción de Sonogashira. Los yoduros de vinilo son los haluros de vinilo más reactivos a la adición oxidativa de Pd 0 y, por lo tanto, su uso es más frecuente para las reacciones de acoplamiento cruzado de Sonogashira debido a las condiciones generalmente más suaves empleadas. Algunos ejemplos incluyen:

La versatilidad de la reacción de Sonogashira la convierte en una reacción ampliamente utilizada en la síntesis de una variedad de compuestos. Una de esas aplicaciones farmacéuticas es la síntesis de SIB-1508Y, más comúnmente conocido como Altiniclina . La altiniclina es un agonista del receptor nicotínico de acetilcolina que ha demostrado potencial en el tratamiento de la enfermedad de Parkinson, la enfermedad de Alzheimer, el síndrome de Tourette, la esquizofrenia y el trastorno por déficit de atención con hiperactividad (TDAH). [3] [54] A partir de 2008, la altiniclina se ha sometido a ensayos clínicos de fase II. [55] [56]

La reacción de acoplamiento cruzado de Sonogashira se puede utilizar en la síntesis de derivados de imidazopiridina. [57]
