La eliminación reductora es un paso elemental en la química organometálica en el que el estado de oxidación del centro metálico disminuye mientras se forma un nuevo enlace covalente entre dos ligandos . Es el reverso microscópico de la adición oxidativa y, a menudo, es el paso de formación del producto en muchos procesos catalíticos. Dado que la adición oxidativa y la eliminación reductora son reacciones inversas, se aplican los mismos mecanismos para ambos procesos y el equilibrio del producto depende de la termodinámica de ambas direcciones. [1] [2]
La eliminación reductora se observa a menudo en estados de oxidación superiores y puede implicar un cambio de dos electrones en un solo centro metálico (mononuclear) o un cambio de un electrón en cada uno de dos centros metálicos (binuclear, dinuclear o bimetálico). [1] [2]
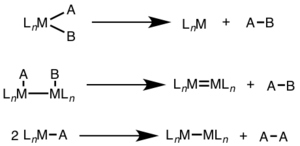
Para la eliminación reductiva mononuclear, el estado de oxidación del metal disminuye en dos, mientras que el recuento de electrones d del metal aumenta en dos. Esta vía es común para los metales d 8 Ni (II), Pd (II) y Au (III) y para los metales d 6 Pt (IV), Pd (IV), Ir (III) y Rh (III). Además, la eliminación reductiva mononuclear requiere que los grupos que se eliminan sean cis entre sí en el centro metálico. [3]

Para la eliminación reductiva binuclear, el estado de oxidación de cada metal disminuye en uno, mientras que el recuento de electrones d de cada metal aumenta en uno. Este tipo de reactividad se observa generalmente con metales de la primera fila, que prefieren un cambio de una unidad en el estado de oxidación, pero se ha observado tanto en metales de segunda como de tercera fila. [4]
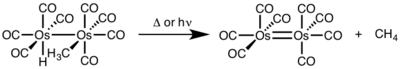
Al igual que con la adición oxidativa, son posibles varios mecanismos con la eliminación reductora. El mecanismo destacado es una vía concertada , lo que significa que es un estado de transición no polar, tricéntrico, con retención de estereoquímica . Además, un mecanismo S N 2 , que procede con la inversión de la estereoquímica, o un mecanismo radical , que procede con la destrucción de la estereoquímica, son otras posibles vías para la eliminación reductiva. [1]
La tasa de eliminación reductora está muy influenciada por la geometría del complejo metálico. En los complejos octaédricos , la eliminación reductiva puede ser muy lenta desde el centro coordinativamente saturado y, a menudo, la eliminación reductiva solo se produce a través de un mecanismo disociativo , donde un ligando debe disociarse inicialmente para formar un complejo de cinco coordenadas. Este complejo adopta una estructura bipiramidal trigonal distorsionada de tipo Y donde un ligando donante π está en la posición basal y los dos grupos a eliminar se acercan mucho. Después de la eliminación, se forma un complejo de tres coordenadas en forma de T, que se asociará con un ligando para formar el complejo plano cuadrado de cuatro coordenadas. [5]
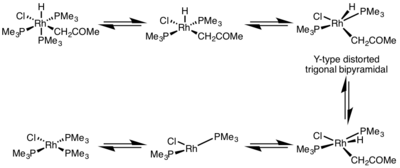
La eliminación reductiva de complejos planos cuadrados puede progresar a través de una variedad de mecanismos: disociativo , no disociativo y asociativo . De manera similar a los complejos octaédricos, un mecanismo disociativo para los complejos planos cuadrados se inicia con la pérdida de un ligando, generando un intermedio de tres coordenadas que se somete a eliminación reductiva para producir un complejo metálico de una coordinación. Para una vía no disociativa, se produce una eliminación reductiva del sistema de cuatro coordenadas para producir un complejo de dos coordenadas. Si los ligandos eliminadores son trans entre sí, el complejo debe sufrir primero una isomerización trans a cis antes de eliminarse. En un mecanismo asociativo, un ligando debe asociarse inicialmente con el complejo metálico de cuatro coordenadas para generar un complejo de cinco coordenadas que sufre una eliminación reductora, sinónimo del mecanismo de disociación de los complejos octaédricos. [6] [7]
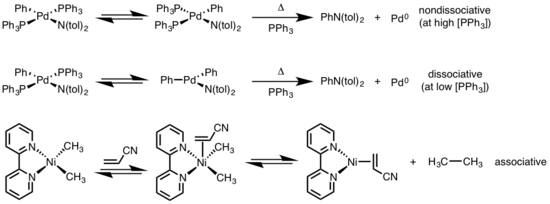
La eliminación reductiva es sensible a una variedad de factores que incluyen: 1) identidad del metal y densidad de electrones; 2) estéricas; 3) ligandos participantes; 4) número de coordinación ; 5) geometría ; y 6) fotólisis /oxidación. Además, debido a que la eliminación reductora y la adición oxidativa son reacciones inversas, cualquier estérico o electrónico que mejore la velocidad de eliminación reductiva debe obstaculizar termodinámicamente la velocidad de adición oxidativa. [2]
Los complejos metálicos de la primera fila tienden a sufrir una eliminación reductiva más rápidamente que los complejos metálicos de la segunda fila, que tienden a ser más rápidos que los complejos metálicos de la tercera fila. Esto se debe a la fuerza del enlace, siendo los enlaces metal-ligando en los complejos de primera fila más débiles que los enlaces metal-ligando en los complejos de tercera fila. Además, los centros metálicos pobres en electrones se someten a una eliminación reductiva más rápidamente que los centros metálicos ricos en electrones, ya que el metal resultante ganaría densidad electrónica tras la eliminación reductiva. [8]
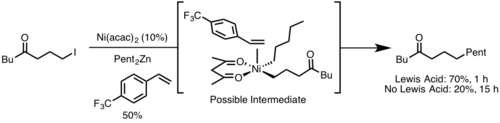
La eliminación reductora generalmente ocurre más rápidamente desde un centro metálico con mayor impedimento estérico porque el gravamen estérico se alivia con la eliminación reductiva. Además, los ángulos de mordida amplios del ligando generalmente aceleran la eliminación reductiva porque los estéricos fuerzan a los grupos eliminadores a acercarse, lo que permite una mayor superposición orbital . [9]
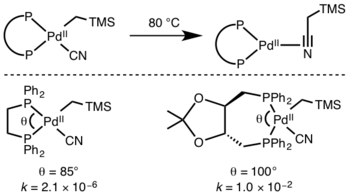
La cinética de la eliminación reductiva es difícil de predecir, pero las reacciones que involucran hidruros son particularmente rápidas debido a los efectos de la superposición de orbitales en el estado de transición. [10]

La eliminación reductiva ocurre más rápidamente para complejos de centros metálicos de tres o cinco coordenadas que para centros metálicos de cuatro o seis coordenadas. Para complejos de números de coordinación pares, la eliminación reductiva conduce a un intermedio con un orbital antienlazante fuertemente ligando metálico . Cuando se produce una eliminación reductora de complejos de números de coordinación impares, el intermedio resultante ocupa un orbital molecular no enlazante . [11]

La eliminación reductora generalmente ocurre más rápido para los complejos cuyas estructuras se parecen al producto. [2]
La eliminación reductora se puede inducir oxidando el centro del metal a un estado de oxidación superior mediante luz o un oxidante. [12]
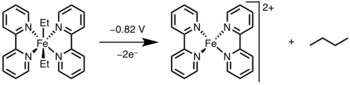
La eliminación reductiva ha encontrado una aplicación generalizada en la academia y la industria, siendo la más notable la hidrogenación , [13] el proceso del ácido acético de Monsanto , [14] la hidroformilación , [15] y las reacciones de acoplamiento cruzado . [16] En muchos de estos ciclos catalíticos, la eliminación reductora es el paso de formación del producto y regenera el catalizador; sin embargo, en la reacción de Heck [17] y el proceso de Wacker , [18] la eliminación reductora está involucrada sólo en la regeneración del catalizador, ya que los productos en estas reacciones se forman mediante la eliminación de β-hidruro .