
El proceso Wacker o proceso Hoechst-Wacker (llamado así por las empresas químicas del mismo nombre) se refiere a la oxidación de etileno a acetaldehído en presencia de cloruro de paladio (II) y cloruro de cobre (II) como catalizador . [1] Esta reacción química fue una de las primeras catálisis homogénea con química de organopaladio aplicada a escala industrial. [2]
La reacción de Wacker fue descrita por primera vez por Smidt et al. [3] [4] [5]
El desarrollo del proceso químico conocido ahora como proceso Wacker comenzó en 1956 en Wacker Chemie . [6] En aquella época, muchos compuestos industriales se producían a partir de acetileno , derivado del carburo de calcio , una tecnología costosa y perjudicial para el medio ambiente. La construcción de una nueva refinería de petróleo en Colonia por parte de Esso cerca de un sitio de Wacker, combinada con la comprensión de que el etileno sería una materia prima más barata, impulsó a Wacker a investigar sus usos potenciales. Como parte del esfuerzo de investigación posterior, una reacción de etileno y oxígeno sobre paladio sobre carbono en una búsqueda de óxido de etileno arrojó inesperadamente evidencia de la formación de acetaldehído (simplemente basado en el olor). Más investigaciones sobre esta conversión de etileno a acetaldehído dieron como resultado una patente de 1957 que describe una reacción en fase gaseosa utilizando un catalizador heterogéneo. [7] Mientras tanto, Hoechst AG se unió a la carrera y, después de presentar una patente, obligó a Wacker a formar parte de una sociedad llamada Aldehyd GmbH . El proceso heterogéneo finalmente fracasó debido a la inactivación del catalizador y fue reemplazado por el sistema homogéneo a base de agua para el cual estaba operativa una planta piloto en 1958. Los problemas con la solución catalítica agresiva se resolvieron adoptando titanio (recién disponible para uso industrial) como material de construcción. para reactores y bombas. Las plantas de producción entraron en funcionamiento en 1960.
El mecanismo de reacción del proceso industrial Wacker (oxidación de olefinas mediante cloruro de paladio(II)) ha recibido mucha atención durante varias décadas. Aún se debaten aspectos del mecanismo. A continuación se describe una formulación moderna:
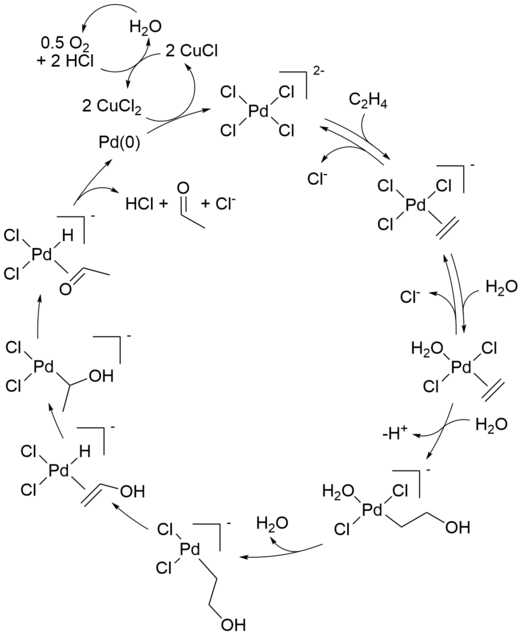
Phillips informó por primera vez de la reacción estequiométrica inicial. [9] [10] La reacción neta también se puede describir de la siguiente manera:
A esta conversión le siguen reacciones que regeneran el catalizador de Pd(II):
Sólo se consumen el alqueno y el oxígeno. Sin cloruro de cobre (II) como agente oxidante , el metal Pd (0) (resultante de la eliminación con hidruro beta de Pd (II) en el paso final) precipitaría, deteniendo la reacción después de un ciclo. Esta reacción estequiométrica se descubrió en 1894. El aire, el oxígeno puro o varios otros reactivos pueden oxidar la mezcla resultante de cloruro de CuCl nuevamente a CuCl 2 , permitiendo que el ciclo continúe.
Los primeros estudios mecanicistas de la década de 1960 aclararon varios puntos clave: [11] [8]
Muchos estudios mecanicistas sobre el proceso de Wacker se han centrado en la vía de formación del enlace CO, el paso de hidroxipaladación . Henry dedujo que el hidróxido coordinado ataca al ligando de etileno, una vía interna (sin). [12] Posteriormente, los estudios estereoquímicos realizados por Stille y sus compañeros de trabajo [13] [14] [15] respaldan una vía anti-adición, mediante la cual el hidróxido libre ataca al ligando de etileno. Las condiciones para los experimentos de Stille difieren significativamente de las condiciones de los procesos industriales. Otros estudios que utilizaron condiciones industriales normales de Wacker (excepto con altas concentraciones de cloruro y cloruro de cobre) también arrojaron productos que infirieron que el ataque nucleofílico era una reacción anti-adición. [dieciséis]
Se realizaron estudios cinéticos en alcoholes alílicos sustituidos isotópicamente en condiciones industriales estándar (con bajas concentraciones de cloruro) para investigar los mecanismos de reacción. [17] [18] Esos resultados mostraron que el ataque nucleofílico es un proceso lento, mientras que los mecanismos propuestos que explican los estudios estereoquímicos anteriores asumieron que el ataque nucleofílico era un proceso rápido.
Estudios estereoquímicos posteriores indicaron que ambas vías ocurren y dependen de las concentraciones de cloruro. [19] [20] Sin embargo, estos estudios también son controvertidos ya que los alcoholes alílicos pueden ser sensibles a reacciones de isomerización y se pueden formar diferentes estereoisómeros a partir de esas reacciones y no a partir del proceso estándar de Wacker.
En resumen, la evidencia experimental parece respaldar que la sinadición ocurre bajo concentraciones bajas de reacción de cloruro (< 1 mol / L , condiciones de proceso industrial), mientras que la antiadición ocurre bajo concentraciones altas de reacción de cloruro (> 3mol/L), probablemente debido a que los iones de cloruro saturan el catalizador e inhiben el mecanismo de la esfera interna. Sin embargo, aún se desconoce la vía exacta y el motivo de este cambio de vías.
Para complicar aún más el mecanismo del proceso de Wacker están las preguntas sobre el papel del cloruro de cobre. La mayoría de las teorías asumían que el cobre no desempeña ningún papel en los mecanismos de oxidación de las olefinas. Sin embargo, los experimentos de Stangl y Jira [21] encontraron que la formación de clorhidrina dependía de las concentraciones de cloruro de cobre. El trabajo de Hosokawa y compañeros de trabajo [22] produjo un producto cristalizado que contiene cloruro de cobre, lo que indica que puede tener un papel no inocente en la oxidación de olefinas. Finalmente, un estudio ab initio de Comas-Vives, et al. [23] que no utilizaron cocatalizador de cobre encontraron que la antiadición era la vía preferida. Esta vía fue confirmada más tarde mediante experimentos sin cobre realizados por Anderson y Sigman. [24] Se encontró una ley de velocidad cinética diferente sin dependencia de protones en condiciones libres de cobre, lo que indica la posibilidad de que incluso pequeñas cantidades de cocatalizadores de cobre puedan tener funciones no inocentes en esta química. Si bien estos trabajos complican la imagen del mecanismo del proceso de Wacker, probablemente uno debería inferir que esta y la química relacionada pueden ser sensibles a las condiciones de reacción, y pueden estar en juego múltiples vías de reacción diferentes.
Otro paso clave en el proceso Wacker es la migración del hidrógeno del oxígeno al cloruro y la formación del doble enlace CO. Generalmente se cree que este paso se produce mediante la denominada eliminación de β-hidruro con un estado de transición cíclico de cuatro miembros :

Los estudios in silico [25] [26] [27] sostienen que el estado de transición para este paso de reacción es desfavorable y que está en juego un mecanismo de reacción de eliminación reductiva alternativo . Es probable que los pasos de reacción propuestos estén ayudados por una molécula de agua en solución que actúa como catalizador.

Se comercializan dos rutas para la producción de acetaldehído: proceso de una etapa y de dos etapas.
El eteno y el oxígeno se hacen pasar en paralelo por una torre de reacción a aproximadamente 130 °C y 400 kPa. [28] El catalizador es una solución acuosa de PdCl 2 y CuCl 2 . El acetaldehído se purifica mediante destilación extractiva seguida de destilación fraccionada . La destilación extractiva con agua elimina los extremos ligeros que tienen puntos de ebullición más bajos que el acetaldehído ( clorometano , cloroetano y dióxido de carbono ) en la parte superior, mientras que el agua y los subproductos de mayor punto de ebullición, como el ácido acético , el crotonaldehído o los acetaldehídos clorados, se eliminan junto con el acetaldehído. en el fondo. [28] Debido a la naturaleza corrosiva del catalizador, el reactor está revestido con material cerámico a prueba de ácidos y el tubo está hecho de titanio .
En el proceso de dos etapas, la reacción y la oxidación se llevan a cabo por separado en reactores tubulares. A diferencia del proceso de una etapa, se puede utilizar aire en lugar de oxígeno. El etileno pasa a través del reactor junto con el catalizador a 105-110 °C y 900-1000 kPa. [28] La solución de catalizador que contiene acetaldehído se separa mediante destilación instantánea . El catalizador se oxida en el reactor de oxidación a 1000 kPa utilizando aire como medio oxidante. La solución de catalizador oxidado se separa y se envía de regreso al reactor. El oxígeno del aire se consume por completo y el aire de escape circula como gas inerte. La mezcla de acetaldehído y vapor de agua se preconcentra al 60-90 % de acetaldehído utilizando el calor de la reacción y el agua descargada se devuelve a la torre de evaporación instantánea para mantener la concentración del catalizador. A continuación se realiza una destilación en dos etapas del acetaldehído bruto. En la primera etapa se separan sustancias de bajo punto de ebullición, como clorometano , cloroetano y dióxido de carbono . En la segunda etapa se eliminan el agua y los subproductos de alto punto de ebullición, como los acetaldehídos clorados y el ácido acético , y se obtiene acetaldehído puro por cabeza. [28] Debido a la naturaleza corrosiva del catalizador, los equipos en contacto con él están revestidos de titanio .
Tanto en los procesos de una como de dos etapas, el rendimiento de acetaldehído es aproximadamente del 95% [28] y los costos de producción son prácticamente los mismos. La ventaja de utilizar gases diluidos en el método de dos etapas se compensa con mayores costes de inversión. Ambos métodos producen hidrocarburos clorados, acetaldehídos clorados y ácido acético como subproductos. Generalmente, la elección del método se rige por la situación de la materia prima y la energía, así como por la disponibilidad de oxígeno a un precio razonable. En general, 100 partes de eteno dan:
y otros productos secundarios menores
La llegada del proceso Wacker ha estimulado muchas investigaciones sobre la utilidad y aplicabilidad de las reacciones con olefinas terminales más complejas. La oxidación Tsuji-Wacker es la transformación catalizada por paladio (II) de tales olefinas en compuestos carbonílicos. Clement y Selwitz [29] fueron los primeros en descubrir que el uso de DMF acuoso como disolvente permitía la oxidación de 1-dodeceno a 2-dodecanona, lo que solucionaba el problema de la insolubilidad de las olefinas de orden superior en agua. Fahey [30] observó que el uso de 3-metilsulfolano en lugar de DMF como disolvente aumentaba el rendimiento de oxidación del 3,3-dimetilbut-1-eno. Dos años después, Tsuji [31] aplicó las condiciones de Selwitz para oxidaciones selectivas de olefinas terminales con múltiples grupos funcionales y demostró su utilidad en la síntesis de sustratos complejos. [32] Un mayor desarrollo de la reacción ha llevado a varios sistemas catalíticos para abordar la selectividad de la reacción, así como a la introducción de oxidaciones intermoleculares e intramoleculares con nucleófilos no acuosos.

La oxidación Tsuji-Wacker oxida la olefina terminal a la correspondiente metilcetona en las condiciones del proceso Wacker. Casi idéntico al proceso Wacker, el ciclo catalítico propuesto [33] (Figura 1) comienza con la complejación de PdCl 2 y dos aniones cloruro para formar PdCl 4 , que luego se somete a un intercambio posterior de dos ligandos cloruro por agua y alqueno para formar Pd. Complejo (Cl 2 )(H 2 O)(alqueno). Luego, una molécula de agua ataca regioselectivamente a la olefina a través de un mecanismo de esfera externa al estilo de Markovnikov , para formar el complejo Pd(Cl 2 )(OH)(-CH 2 -CHOH-R), más termodinámicamente estable . La disociación de un ligando de cloruro al complejo de paladio de tres coordenadas promueve la eliminación de β-hidruro, luego la posterior inserción migratoria de 1,2-hidruro genera el complejo Pd(Cl 2 )(OH)(-CHOHR-CH 3 ). Esto se somete a eliminación de β-hidruro para liberar la cetona, y la posterior eliminación reductora produce HCl, agua y paladio (0). Finalmente el paladio(0) se reoxida a PdCl 2 con dos equivalentes de Cu(II)Cl 2 , que a su vez se puede reoxidar con O 2 .
La oxidación de olefinas terminales generalmente proporciona el producto cetona de Markovnikov; sin embargo, en los casos en que el sustrato favorece al aldehído (que se analiza a continuación), se pueden usar diferentes ligandos para reforzar la regioselectividad de Markovnikov. El uso de esparteína como ligando (Figura 2, A) [34] favorece la nucleopaladación en el carbono terminal para minimizar la interacción estérica entre el complejo de paladio y el sustrato. El catalizador de paladio ligado a Quinox se utiliza para favorecer la formación de cetonas cuando el sustrato contiene un grupo director (Figura 2, B). [35] Cuando dicho sustrato se une a Pd(Quinox)(OOtBu), este complejo se satura de manera coordinada, lo que impide la unión del grupo director y da como resultado la formación del producto de Markovnikov. La eficacia de este ligando también se atribuye a su propiedad electrónica, donde el TBHP aniónico prefiere unir trans a la oxazolina y la olefina coordina trans a la quinolina. [36]

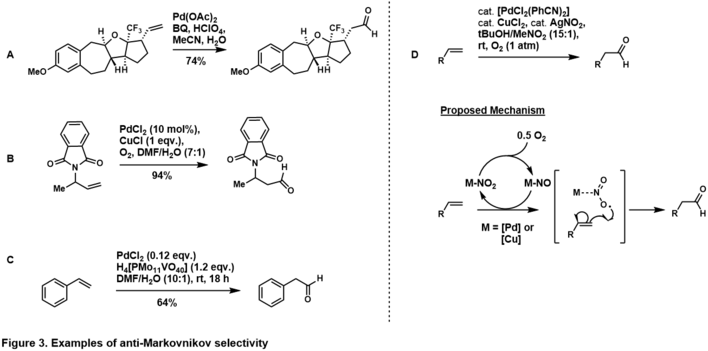
La selectividad de adición anti-Markovnikov al aldehído se puede lograr aprovechando la estereoelectrónica inherente del sustrato. [37] La colocación del grupo director en la posición homoalílica (es decir, Figura 3, A) [38] y alílica (es decir, Figura 3, B) [39] con respecto a la olefina terminal favorece el producto aldehído anti-Markovnikov, lo que sugiere que en Durante el ciclo catalítico, el grupo director se quela al complejo de paladio de modo que el agua ataca el carbono anti-Markovnikov para generar el paladaciclo termodinámicamente más estable. La selectividad anti-Markovnikov también se observa en sustratos de estireno (es decir, Figura 3, C), [40] presumiblemente a través del complejo η 4 -paladio-estireno después de que el agua ataca al anti-Markovnikov. En las revisiones de Namboothiri, [41] Feringa, [37] y Muzart se dan más ejemplos de oxidación de olefinas anti-Markovnikov Tsuji-Wacker controlada por sustrato . [42]
Grubbs y sus compañeros de trabajo allanaron el camino para la oxidación anti-Markovnikov de olefinas terminales estereoelectrónicamente imparciales, mediante el uso de un sistema de nitrito de paladio (Figura 2, D). [43] En su sistema, la olefina terminal se oxidaba al aldehído con alta selectividad a través de una vía de control del catalizador. El mecanismo está bajo investigación, sin embargo, la evidencia [41] sugiere que pasa por la adición de un radical nitrito al carbono terminal para generar el radical secundario, termodinámicamente más estable. Grubbs amplió esta metodología a olefinas más complejas e imparciales. [44] [45]
Las oxidaciones intermoleculares de olefinas con alcoholes como nucleófilos generalmente generan cetales , mientras que las oxidaciones catalizadas por paladio de olefinas con ácidos carboxílicos como nucleófilos generan carboxilatos vinílicos o alílicos . En el caso de los dioles , sus reacciones con alquenos suelen generar cetales, mientras que las reacciones de olefinas que llevan grupos aceptores de electrones tienden a formar acetales . [46]
Las oxidaciones intermoleculares de dienos catalizadas por paladio con ácidos carboxílicos y alcoholes como donadores dan productos de adición 1,4 . En el caso del ciclohexadieno (Figura 4, A), Backvall descubrió que el resultado estereoquímico del producto dependía de la concentración de LiCl. [47] Esta reacción procede generando primero el complejo Pd(OAc)(benzoquinona)(alilo), mediante antinucleopaladación del dieno con acetato como nucleófilo. La ausencia de LiCl induce una eliminación reductora de la esfera interna para producir la estereoquímica del trans-acetato para dar el aducto trans-1,4. La presencia de LiCl desplaza el acetato con cloruro debido a su mayor afinidad de unión, lo que fuerza un ataque de acetato de esfera externa contra el paladio y proporciona la estereoquímica del cis-acetato para dar el aducto cis-1,4. Ciclización oxidativa intramolecular: el 2-(2-ciclohexenil)fenol se cicla al correspondiente dihidrobenzofurano (Figura 4, B); [48] El ácido 1-ciclohexadieno-acético en presencia de ácido acético se cicla al correspondiente aducto de lactona-acetato 1,4 (Figura 4, C), [49] con selectividad cis y trans controlada por la presencia de LiCl.

Las aminaciones oxidativas de olefinas se realizan generalmente con amidas o imidas ; Se cree que las aminas son protonadas por el medio ácido o que se unen al centro metálico con demasiada fuerza para permitir que se produzca la química catalítica . [46] Se ha descubierto que estos nucleófilos de nitrógeno son competentes en reacciones tanto intermoleculares como intramoleculares; se representan algunos ejemplos (Figura 5, A, [50] B [51] ).

{{cite book}}: Mantenimiento CS1: ubicación ( enlace )