
Las personas lesbianas , gays , bisexuales y transgénero ( comunidad LGBT ) que deseen tener hijos pueden recurrir a la tecnología de reproducción asistida . En las últimas décadas, los biólogos del desarrollo han estado investigando y desarrollando técnicas para facilitar la reproducción entre personas del mismo sexo. [1]
Los enfoques obvios [ aclaración necesaria ] , sujetos a una cantidad creciente de actividad, son el esperma femenino y los óvulos masculinos . En 2004, al alterar la función de algunos genes involucrados en la impronta, otros científicos japoneses combinaron dos óvulos de ratón para producir ratones hija [2] y en 2018, científicos chinos crearon 29 ratones hembra a partir de dos ratones madres hembra, pero no pudieron producir descendencia viable a partir de dos ratones padre. [3] [4] Una de las posibilidades es transformar células madre de la piel en esperma y óvulos. [5]
La falta de acceso a tecnologías de reproducción asistida es una forma de desigualdad en la atención sanitaria que experimentan las personas LGBT. [6]
Las mujeres LGBT y los hombres trans pueden optar por donar sus óvulos para reproducirse mediante fertilización in vitro . Los hombres trans, en particular, pueden congelar sus óvulos antes de la transición y optar por que una madre sustituta lleve a su hijo mientras, cuando llegue el momento, utilizan sus óvulos y el esperma de otra persona. Esto les permite evitar la experiencia potencialmente disforica del embarazo o la interrupción de la terapia de reemplazo hormonal para recolectar óvulos a una edad más avanzada. [7]
La criopreservación de ovocitos (óvulos) requiere estimulación hormonal y recuperación de ovocitos, como en el caso del tratamiento de FIV, tras lo cual se vitrifican los ovocitos . [8] Se ha descubierto que la vitrificación de ovocitos es más exitosa que la congelación lenta de ovocitos. [9] El éxito del almacenamiento de ovocitos disminuye significativamente con el aumento de la edad reproductiva. [10] La estimulación ovárica aumentará los niveles séricos de estradiol en hombres transgénero y, en respuesta, puede ser necesaria la monitorización ecográfica transvaginal; las estrategias para minimizar las elevaciones de estradiol incluyen el uso concomitante de inhibidores de la aromatasa durante la estimulación. [11] No hay datos sobre el éxito de la estimulación ovárica en hombres transgénero que previamente habían detenido la pubertad con un agonista de GnRH, seguido directamente de la administración de testosterona. [11] Tampoco hay datos que comparen el número de ovocitos recuperados o la tasa de nacidos vivos después de la preservación de la fertilidad estratificada por el tiempo sin testosterona. [12]
Se requiere un procedimiento quirúrgico para recolectar muestras de tejido, si se somete a una histerectomía y/o ovariectomía, se puede optar por criopreservar algo de tejido al mismo tiempo para evitar un procedimiento quirúrgico adicional. [8] La criopreservación de tejido ovárico ha sido exitosa, pero hasta ahora [¿ hasta ahora? ] , no se han registrado embarazos después de la descongelación y maduración in vitro (MIV) de este tejido, solo se han registrado embarazos exitosos después del autotrasplante . [13] [8] Este método tiene una tasa de éxito muy baja en el desarrollo de blastocistos , ya que en un estudio de 83 hombres transgénero, 2 de los 208 ovocitos maduros se recuperaron de tejido ovárico descongelado y crearon blastocistos de "buena calidad". [12]
Para los fines de la fertilización in vitro o la inseminación artificial , las personas LGBT pueden optar por preservar sus óvulos o esperma.
Las mujeres trans pueden tener una calidad de esperma más baja antes de la terapia de reemplazo hormonal, lo que puede representar un problema para crear muestras de esperma viables para congelar. [14]
Los estrógenos suprimen los niveles de testosterona y en dosis altas pueden alterar notablemente el impulso y la función sexual y la fertilidad por sí solos. [15] [16] [17] [18] [ necesita actualización ] Además, la alteración de la función gonadal y la fertilidad por los estrógenos puede ser permanente después de una exposición prolongada. [17] [18] [19]
Los antiandrógenos no esteroides como la bicalutamida pueden ser una opción para las mujeres transgénero que desean preservar el deseo sexual , la función sexual y/o la fertilidad , en relación con los antiandrógenos que suprimen los niveles de testosterona y pueden alterar en gran medida estas funciones, como el acetato de ciproterona y los moduladores de GnRH. [20] [21]
El semen puede recolectarse a través de la masturbación, pero existen alternativas para quienes encuentran angustiante la masturbación o la eyaculación o pueden tener disfunción eréctil o eyaculatoria secundaria al hipoandrogenismo . Las opciones para quienes tienen disfunción incluyen: estimulación vibratoria del pene y electroeyaculación . [11] Para quienes no desean eyacular o tienen oligospermia o azoospermia pueden buscar la aspiración de esperma testicular o la extracción microquirúrgica de esperma, aunque son más invasivas. [11] Actualmente no hay estudios que evalúen la aceptabilidad o las tasas de éxito de las diferentes opciones para la recolección de esperma específicamente en mujeres transgénero. [11] Además, para las mujeres transgénero que toman estradiol y/o antiandrógenos, no está claro el tiempo necesario para dejar la medicación del tratamiento hormonal antes de que se reanude la espermatogénesis normal (si es que ocurre), tiempo durante el cual se reanudará la producción de testosterona y puede causar efectos masculinizantes no deseados. [11]
Los futuros padres LGBT pueden tener que elegir esperma de un banco de esperma para hacer crecer a su bebé. El esperma puede provenir de una pareja, ya sea que haya sido congelado antes de su transición o que sea reciente en el caso de que una pareja tenga órganos masculinos funcionales . Otras veces, puede provenir de donantes de esperma privados . Las personas LGBT deben considerar cuidadosamente de dónde obtienen su esperma de donante. Las leyes de cada estado varían, pero muchos estados de EE. UU. han adoptado una forma de la Ley de Paternidad Uniforme (UPA). [22] La mayoría, pero no todos los estados, transfieren los derechos parentales de los donantes de esperma anónimos a los futuros padres siempre que el receptor sea una mujer casada y esté involucrado un médico. [22] El incumplimiento de estas leyes puede resultar en la falta de terminación de los derechos parentales del donante de esperma. Ha habido casos judiciales en los que se solicitó a donantes de esperma conocidos que donaron directamente de forma privada que pagaran la manutención de los hijos . [22] [23] [24] [25] Por ejemplo, de estas leyes, consulte las leyes de reproducción asistida de California. En Australia, existe un precedente legal que establece que la participación del donante de esperma en la vida del niño le otorga derechos parentales (Masson v Parsons). [26]
Como alternativa a la donación privada directa, es posible comprar esperma de un banco de esperma para uso personal en tratamientos de fertilidad. Los bancos de esperma pueden variar ampliamente, no solo en términos de precio, sino también de práctica (es decir, quién puede donar esperma, cuántas veces, etc.) y pueden ofrecer una variedad de servicios. Los principales bancos de esperma de EE. UU. incluyen Fairfax Cryobank, California Cyrobank , Cryos International , Seattle Sperm Bank y Xytex, entre muchos otros.
Para dar cabida a las diferentes identidades de género y orientaciones sexuales , se puede lograr un embarazo LGBT a partir de esperma donado mediante inseminación artificial. Se trata de colocar el esperma donado dentro del cuerpo de la madre gestante ( embarazo subrogado u otro).
El momento de estos procedimientos es fundamental para una fertilización exitosa, [27] ya que la ventana fértil son los cinco días antes de la ovulación, más el día de la ovulación y el día después de la ovulación. [28] Para aumentar la probabilidad de éxito, se observa de cerca el ciclo menstrual, a menudo utilizando kits de ovulación, ecografías o análisis de sangre, como pruebas de temperatura corporal basal , anotando el color y la textura del moco vaginal y la suavidad de la nariz del cuello uterino. [28] Para mejorar la tasa de éxito de la inseminación artificial, se pueden utilizar medicamentos para crear un ciclo estimulado llamado estimulación ovárica (EO).
Antes de la ovulación hay un pico de hormona luteinizante (LH) que se puede utilizar para programar un procedimiento de IIU. Los datos sugieren que la IIU debe realizarse 1 día después de la detección del pico de LH. [27] La mayoría de las clínicas en los EE. UU. realizan la IIU por la mañana después de una prueba de kit de predicción de ovulación positiva (que detecta LH en la orina). [27] Una alternativa al control de LH es el control ecográfico del tamaño del folículo ovárico seguido de una inyección desencadenante con gonadotropina coriónica humana (hCG) exógena que imita el pico de LH del cuerpo y desencadena la maduración y ruptura folicular final (36 a 48 horas después). La inyección desencadenante generalmente se administra cuando el folículo dominante alcanza los 18 a 20 mm. [27] El momento recomendado de la IIU después de la administración de hCG es de 24 a 40 horas. [27] Los ciclos de IIU estimulados con dosis clásicas de FSH tienen una alta tasa de tener un embarazo múltiple con tasas que varían del 10 al 40%. [29] Un metanálisis no mostró diferencias entre los resultados del embarazo entre el monitoreo de LH en el hogar y la IIU programada. [27]
La IIU se puede realizar sin el uso de medicamentos. No se recomienda la IIU en casos en los que las gestantes presentan atresia cervical, cervicitis, endometritis u obstrucción tubárica bilateral o cuando el donante de esperma tiene amenorrea u oligospermia severa. [29] Antes de la IIU, se "lava" el esperma, lo cual es necesario para eliminar el plasma seminal y evitar contracciones uterinas inducidas por prostaglandinas. [29] La inseminación con semen sin procesar también se asocia con infección pélvica. [29]
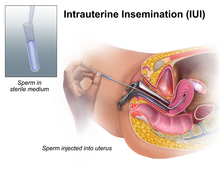
La inseminación intrauterina (IIU) implica la apertura de la vagina utilizando un espéculo, luego inyectando esperma lavado directamente en el útero con un catéter . [30] La inseminación de esta manera significa que el esperma no tiene que nadar a través del cuello uterino que está cubierto con una capa de moco. Esta capa de moco puede ralentizar el paso de los espermatozoides y puede provocar que muchos de ellos mueran antes de poder entrar en el útero. [31] A veces se prueba el esperma de donante para determinar su capacidad de penetración en el moco si se va a utilizar para inseminaciones ICI, ya que si las posibilidades de que el esperma pase a través del cuello uterino son bajas, la IIU proporcionaría una entrega más eficiente del esperma que la ICI [ cita requerida ] . La fertilización por IIU se produce de forma natural en la parte externa de las trompas de Falopio de la misma forma que ocurre después del coito.
No se ha encontrado el beneficio de la doble IIU en pacientes con infertilidad no documentada utilizando esperma de donante, como mujeres lesbianas y solteras. [32] Normalmente, las tasas de éxito del embarazo por ciclo de IIU son de aproximadamente el 12,4%. [33] Según un estudio de 2021, las mujeres lesbianas sometidas a IIU tuvieron una tasa de embarazo clínico del 13,2% por ciclo y una tasa de éxito del 42,2% dado el número promedio de ciclos de 3,6. [33] Se ha informado que la IIU es más eficaz que la ICI [34] [35] pero esto ha sido cuestionado y algunos citan que no hay evidencia sólida para confirmar una diferencia significativa entre las tasas de natalidad de los dos procedimientos. [36] Se especula que la IIU es más eficaz ya que la IIU acerca el esperma al ovocito que la ICI, lo que podría compensar la disminución de la motilidad del esperma después de la congelación y descongelación. [35] La IIU incluye riesgo de endometritis , calambres, sangrado y anafilaxia (raramente). [34] Una revisión sistemática y un metanálisis no pudieron demostrar que el reposo en cama después de la inseminación intrauterina aumenta efectivamente la tasa de embarazo. [37]
Muy similar a la IIU, la inseminación intracervical (ICI) es el método de inseminación artificial que imita más de cerca la eyaculación natural del semen por el pene en la vagina durante las relaciones sexuales. ICI es el método más simple de inseminación artificial y también puede realizarse de forma privada en el hogar en lugar de en una práctica privada. ICI es el proceso de introducir el semen en la vagina en la entrada del cuello uterino , [38] generalmente por medio de una jeringa sin aguja. El esperma utilizado en las inseminaciones ICI no tiene que ser " lavado " para eliminar el líquido seminal, por lo que se puede utilizar semen crudo de un donante privado. El semen suministrado por un banco de esperma preparado para su uso en ICI o IIU también es adecuado para ICI. Un estudio de cohorte retrospectivo mostró que la motilidad total y el recuento móvil total (TMC) después de la descongelación se asociaron con la tasa de embarazo en curso; con mejores resultados de ICI en una motilidad total de ≥20% y un recuento móvil total (TMC) de ≥8 × 106 después de la descongelación. [39]
Durante la ICI, se expulsa el aire de una jeringa sin aguja que luego se llena con semen. Para este fin, se puede utilizar una jeringa especialmente diseñada, más ancha y con un extremo más redondeado. Cualquier aire que quede atrapado se elimina presionando suavemente el émbolo hacia adelante. La receptora se recuesta boca arriba y se inserta la jeringa en la vagina de manera que la punta esté lo más cerca posible de la entrada del cuello uterino. Para este fin, se puede utilizar un espéculo vaginal y se puede conectar un catéter a la punta de la jeringa para asegurar la entrega del semen lo más cerca posible de la entrada del cuello uterino. Luego, se empuja lentamente el émbolo hacia adelante y el semen en la jeringa se vacía suavemente en la vagina. Es importante que la jeringa se vacíe lentamente por seguridad y para obtener los mejores resultados, teniendo en cuenta que el propósito del procedimiento es replicar lo más fielmente posible un depósito natural del semen en la vagina [ cita requerida ] . La jeringa (y el catéter, si se usa) se pueden dejar en su lugar durante varios minutos antes de retirarlos. Tras la inseminación, los espermatozoides fértiles pasarán por el cuello uterino hasta el útero y desde allí a las trompas de Falopio de forma natural, como si los espermatozoides se hubieran depositado en la vagina durante el acto sexual. También se puede utilizar un capuchón de concepción en lugar de una jeringa.


Algunas personas LGBT pueden optar por utilizar la fertilización in vitro en lugar de la inseminación artificial para reproducirse. Se crea un cigoto en un laboratorio con un óvulo y un espermatozoide donados, que pueden proceder de diferentes fuentes, como bancos de esperma, bancos de óvulos o de la misma pareja. Luego, el cigoto se implanta en el útero. El útero portador puede ser una madre sustituta (hombres homosexuales u otras parejas infértiles) o una pareja (mujer u hombre trans ).
La FIV estándar es el proceso mediante el cual se extrae el óvulo de los ovarios y se fertiliza fuera del cuerpo, y luego el preembrión se implanta en el útero. [40] Hay muchos pasos para garantizar que este proceso funcione, incluida la estimulación ovárica, la recolección de óvulos, la fertilización y la transferencia de embriones. Para estimular los ovarios para que produzcan más óvulos de lo habitual, la persona debe tomar hormonas específicas recetadas por un médico. [40] Luego, los óvulos se recolectan utilizando una aguja de aspiración guiada por ultrasonido. Una vez que los óvulos están fuera del cuerpo, se mezclan con esperma en una placa de cultivo con la esperanza de fertilizar. El esperma utilizado puede provenir de cualquier donante de esperma (ya sea de un banco de esperma o de un donante conocido como una pareja). Si se forma un preembrión, permanece en la incubadora durante dos a cinco días mientras continúa creciendo y dividiéndose. En esta etapa, el preembrión a menudo se prueba genéticamente para garantizar que se desarrollará en un bebé sano. Si el embrión se considera saludable, el siguiente paso es la implantación. [40] Los embriones se transfieren al útero, lo que implica el uso de un ultrasonido para guiar un catéter a través del cuello uterino hasta la cavidad uterina. [40]
La reproducción asistida por la pareja , o co-FIV, es un método de formación familiar que utilizan las parejas en las que ambos poseen órganos reproductivos femeninos . El método utiliza la fertilización in vitro (FIV), un método que significa que se extraen óvulos de los ovarios , se fertilizan en un laboratorio y luego uno o más de los embriones resultantes se colocan en el útero para crear, con suerte, un embarazo . La FIV recíproca se diferencia de la FIV estándar en que participan dos mujeres: los óvulos se extraen de una pareja y la otra lleva el embarazo. [41] De esta manera, el proceso es mecánicamente idéntico a la FIV con donación de óvulos . [42] [43] El uso de este proceso garantiza que cada pareja sea madre biológica del niño según los defensores, [44] pero en el sentido más estricto solo una madre es la madre biológica desde un punto de vista genético y la otra es una madre sustituta . Sin embargo, la práctica tiene un peso simbólico mayor que la adopción LGBT y puede crear un vínculo más fuerte entre madre e hijo que la adopción.
En un estudio de 2019, se examinó la calidad de las relaciones entre padres e hijos en familias de donantes de óvulos en comparación con familias de fertilización in vitro. [45] Los bebés tenían entre 6 y 18 meses. Mediante el uso de la Entrevista de Desarrollo de Padres (PDI) y la evaluación observacional, el estudio encontró pocas diferencias entre los tipos de familia en el nivel de representación, pero diferencias significativas entre los tipos de familia en el nivel de observación. [45] Las madres de donación de óvulos fueron menos sensibles y estructurantes que las madres de FIV, y los bebés de donación de óvulos fueron menos receptivos emocionalmente y participativos que los bebés de FIV. [45] [46] Luego, los óvulos se fertilizan con esperma de donante para crear embriones, uno de los cuales luego puede transferirse al útero de la segunda persona. De esta manera, un miembro de la pareja contribuye con el material genético y el segundo miembro de la pareja contribuye con el entorno materno, lo que permite que ambos miembros de la pareja tengan un profundo impacto en el desarrollo del feto y el niño. [46] Las leyes en torno a la paternidad cuando ambos miembros de la pareja no aportan material genético son complicadas y varían según el estado, por lo que es imperativo investigar antes de comenzar el proceso. [46]
Los padres LGBT pueden elegir una madre sustituta o su pareja para el embarazo, dependiendo de su fertilidad y valores personales. Hay muchas formas posibles para que una persona o pareja LGBT quede embarazada, como:
Algunas parejas homosexuales o transexuales deciden tener un embarazo subrogado . Una madre sustituta es una mujer que lleva un óvulo fertilizado por el esperma de uno de los hombres. Algunas mujeres se convierten en madres sustitutas por dinero, otras por razones humanitarias o por ambas. [47] Esto permite que uno de los hombres sea el padre biológico mientras que el otro será un padre adoptivo.
Los hombres homosexuales que se han convertido en padres mediante gestación subrogada han reportado experiencias similares a las de otras parejas que han recurrido a la gestación subrogada, incluidas las relaciones que tienen tanto su hijo como su madre subrogada. [48]
Barrie y Tony Drewitt-Barlow, del Reino Unido, se convirtieron en los primeros hombres homosexuales del país en ser padres de gemelos nacidos mediante gestación subrogada en 1999. [49] [50]

La gestación subrogada es un proceso en el que una mujer gesta y da a luz a un niño para una pareja o un individuo. Puede ser un acuerdo respaldado por un acuerdo legal en el que la madre sustituta puede recibir o no una compensación. La gestación subrogada es la forma más común de acceder a la paternidad porque es menos complicada debido a la conexión biológica que se establece entre padre e hijo. Las personas LGBTQ+ pueden buscar la gestación subrogada cuando necesitan que otra persona actúe como portadora gestacional de su hijo biológico. Recientemente, ha aumentado el número de parejas que viajan fuera de los EE. UU. para buscar la gestación subrogada. Por lo general, estos servicios comerciales atienden solo a futuros padres blancos y ricos. En algunos países es ilegal pagar a las madres sustitutas, pero el debate es que la gestación subrogada no remunerada puede tener lugar.
La elección de quién será el padre biológico puede variar de una pareja a otra, ya que cada pareja decide de dónde pueden provenir los gametos. Los gametos pueden adquirirse a través de recursos comerciales, concertarse mediante un acuerdo entre una conexión genética con ambos padres o mediante una donación de un amigo.
Existe una larga historia de subrogación transnacional utilizada por padres homosexuales que buscan la subrogación en la India. Utilizan gametos fertilizados por uno o ambos padres para inseminar a mujeres locales que son empleadas a través de una agencia. Existe una crítica global debido a la transparencia en torno a la remuneración y los resultados para las partes involucradas. Debido a esto, los padres homosexuales están retirando los servicios de subrogación en la India porque hay un acceso restringido a las actualizaciones del embarazo. La incapacidad de comunicarse puede crear un distanciamiento emocional para los padres homosexuales y el embarazo puede ser estresante para ellos. Pasar por los servicios de subrogación puede ser un viaje estresante porque los padres homosexuales se ven atrapados entre cuadros y gráficos, en lugar de poder tener una conexión emocional con el bebé a través de la madre sustituta y las experiencias por las que pasan.
La gestación subrogada transnacional puede plantear problemas legales cuando nace el niño. Existen conflictos sobre las normas jurídicas nacionales en materia de paternidad y esto complica la cuestión de la ciudadanía, lo que a menudo puede dar lugar a que el niño no tenga padres legales ni ciudadanía en ningún país.
La Asociación Mundial de Profesiones para la Salud Transgénero ( WPATH ) recomienda que todos los pacientes transgénero tomen decisiones sobre su fertilidad antes de comenzar la terapia hormonal en su guía Estándares de Atención (2012) para profesionales médicos. [10]
El embarazo es posible para los hombres transgénero que conservan una vagina , ovarios y útero funcionales . [51] [52] La testosterona no inhibe la capacidad de una persona para quedar embarazada y dar a luz, ya que no es un método anticonceptivo suficiente. Si bien los hombres trans pueden quedar embarazados mientras toman testosterona, se recomienda dejar de hacerlo antes de intentar quedar embarazada, ya que tomar testosterona durante el embarazo puede provocar problemas con el desarrollo fetal. [53] [54] Muchos hombres transgénero que quedaron embarazados pudieron hacerlo dentro de los seis meses posteriores a dejar de tomar testosterona. [55] Otro estudio realizado en 2019 encontró que los pacientes masculinos transgénero que buscaban la recuperación de ovocitos para la criopreservación de ovocitos, la criopreservación de embriones o la FIV pudieron someterse al tratamiento 4 meses después de suspender el tratamiento con testosterona, en promedio. [52] No se han realizado estudios sobre hombres transgénero que hayan intentado quedarse embarazadas después de recibir testosterona ni sobre la salud de los hijos concebidos a partir de ovocitos expuestos a la testosterona, por lo que se desconocen las tasas de fertilidad exactas. [11] [51]
La terapia hormonal masculinizante en hombres trans a menudo conduce a amenorrea , pero esta amenorrea suele ser reversible y la terapia con andrógenos no agota los folículos primordiales ni afecta la capacidad de desarrollo de los folículos. [56] [8] Sin embargo, histológicamente se ha encontrado hiperplasia de la corteza y el estroma ováricos. [8] Se ha debatido si esto es fisiológicamente comparable al síndrome de ovario poliquístico . [8] Las ovariectomías conducen a la terminación irreversible de la fertilidad (si los óvulos no se almacenan), pero no impiden el embarazo gestacional con TRA. [8] [51] Las histerectomías eliminarán la opción de gestar. [51]
A los hombres trans y a las personas transmasculinas que quedan embarazadas se les suele llamar "papás caballito de mar". [57]
Las mujeres transgénero con una pareja fértil pueden optar por tener hijos a través de la actividad sexual natural . Algunas mujeres transgénero han informado de un menor deseo sexual con el tratamiento hormonal. [58] Se ha descubierto que los pacientes transgénero sometidos a terapia hormonal feminizante tienen parámetros seminales anormales. [59] [60] El tratamiento hormonal sostenido finalmente conduce a la hipoespermatogénesis y, en última instancia, a la azoospermia , que se volverá irreversible en un momento desconocido. [8] [61] [62] Un estudio de 2015 demostró una espermatogénesis normal en pacientes con terapia de estrógeno a largo plazo. [10] La extirpación quirúrgica de los testículos también conduce a una esterilidad irreversible. [8] [62] Se recomienda a quienes buscan estas opciones y están interesados en preservar la fertilidad que almacenen criogénicamente su esperma antes de comenzar su tratamiento. [8]
El tratamiento y la preservación de la fertilidad son costosos. El ciclo promedio de FIV puede costar entre $12,000 y $17,000 (sin incluir la medicación), con medicación puede llegar a costar entre $25,000 y $30,000 [63] [64] y el precio a menudo depende del seguro que se tenga, que puede tener estipulaciones. El costo de la IIU varía entre $500 y $4,000 por ciclo. [65] La criopreservación de material genético también es costosa (ver la tabla a continuación) y puede variar mucho de un lugar a otro y de un estado a otro. [66]
Otra barrera es el conocimiento. Estos procedimientos no son muy conocidos y no es habitual hablar de la preservación de la fertilidad. En un estudio de 133 mujeres transgénero, el 61% afirmó que ningún proveedor de atención médica les había hablado de la posibilidad de almacenar esperma antes de su terapia hormonal o cirugía. [70] En otro estudio, 70 hombres transgénero citaron barreras como el coste percibido del tratamiento (36%), la necesidad de interrumpir o retrasar la terapia hormonal (19%) y el empeoramiento de la disforia de género con el tratamiento y el embarazo (11%). [12]
Sólo el 3% de las personas transgénero se esfuerzan por preservar su fertilidad durante la transición [71], el 51% de las mujeres transgénero expresan arrepentimiento por no haber preservado su fertilidad [72] y el 97% de los adultos transgénero creen que debería discutirse antes de la transición. [73]
La terapia con testosterona afecta la fertilidad, pero muchos hombres trans que quedaron embarazados pudieron hacerlo dentro de los seis meses de dejar de tomar testosterona. [74] Otro estudio realizado en 2019 encontró que los pacientes masculinos transgénero que buscaban la recuperación de ovocitos para la criopreservación de ovocitos, la criopreservación de embriones o la FIV pudieron someterse al tratamiento 4 meses después de suspender el tratamiento con testosterona, en promedio. [75] Todos los pacientes experimentaron menstruaciones y niveles normales de AMH, FSH y E 2 y recuentos de folículos antrales después de dejar la testosterona, lo que permitió una recuperación exitosa de ovocitos. [75] Aunque los efectos a largo plazo del tratamiento con andrógenos sobre la fertilidad aún se desconocen ampliamente, la recuperación de ovocitos no parece verse afectada. Se pueden lograr futuros embarazos mediante el almacenamiento de ovocitos , pero el proceso puede aumentar la disforia de género o puede no ser accesible debido a la falta de cobertura de seguro. [74] La terapia con testosterona no es un método anticonceptivo suficiente y los hombres trans pueden sufrir embarazos no deseados, [74] [76] especialmente si omiten dosis. [74]
Algunos estudios informan de una mayor incidencia del síndrome de ovario poliquístico (SOP) entre los hombres transgénero antes de tomar testosterona , [77] [78] [79] la enfermedad causa infertilidad y puede dificultar que los hombres trans congelen óvulos, [80] aunque no todos han encontrado la misma asociación entre hombres trans y SOP. [81] Se informa también de que las personas con SOP en general tienen más probabilidades de verse a sí mismas como "sexualmente indiferenciadas" o "andróginas" y "menos propensas a identificarse con un esquema de género femenino". [82] [81]
Se está realizando un trabajo teórico para crear un cigoto a partir de dos hombres que permitiría a ambos ser padres biológicos, pero aún no se ha implementado en la práctica. [83]
Existe la posibilidad teórica de que se produzca una reproducción entre personas del mismo sexo utilizando células madre para derivar gametos y producir hijos biológicamente relacionados, [84] pero esto ha sido polémico [85] y se ha considerado que es posiblemente "imposible". [84] Sin embargo, los científicos han creado con éxito óvulos de ratones machos para producir descendencia con dos donantes genéticos biológicamente masculinos y han sido optimistas respecto de que la aplicación humana podría llegar dentro de los próximos 10 años. [86] [87]
En el caso de las niñas transgénero prepúberes, la criopreservación de tejido testicular (TTC) es actualmente la única opción de preservación de la fertilidad. [11] Un procedimiento quirúrgico experimental para extraer y criopreservar tejido testicular para una fecha posterior, cuando las células madre espermatogoniales puedan madurar y convertirse en espermatozoides. Hasta la fecha, no se ha informado de ninguna recuperación espermatogénica y las tecnologías de TTC que lo permiten actualmente solo se están estudiando en modelos animales [11].
Se está trabajando teóricamente en la creación de un cigoto a partir de dos mujeres, lo que permitiría a ambas ser madres biológicas, pero aún no se ha implementado en la práctica. [83] La creación de un espermatozoide a partir de un óvulo y su uso para fertilizar otro óvulo puede ofrecer una solución a este problema, [5] como también lo podría hacer un proceso análogo a la transferencia nuclear de células somáticas que implica la fusión de dos óvulos. [88]
En 2004 y 2018, los científicos lograron crear ratones con dos madres mediante la fusión de óvulos. [2] [3] [4] La modificación de la impronta genómica fue necesaria para crear ratones bimaternos sanos, mientras que se crearon ratones bipaternos vivos, pero no eran saludables, probablemente debido a la impronta genómica. [4]
Si se creara un "espermatozoide femenino", podría fecundar un óvulo, un procedimiento que, entre otras posibles aplicaciones, podría permitir a parejas de mujeres del mismo sexo producir un niño que sería el hijo biológico de sus dos madres. También se afirma que la producción de espermatozoides femeninos puede estimular a una mujer a ser a la vez madre y padre (de manera similar a la reproducción asexual) de un hijo producido por su propio esperma. Sobre estos argumentos surgen muchas dudas, tanto éticas como morales. [89] [90] [91] [92]
Algunas mujeres transgénero desean gestar a sus propios hijos mediante un embarazo transgénero , lo que conlleva una serie de problemas que deben superarse, ya que las mujeres transgénero no tienen naturalmente la anatomía necesaria para el desarrollo embrionario y fetal. Hasta 2008, no se había registrado ningún caso exitoso de trasplante de útero en mujeres transgénero. [93]
Otra posibilidad para las mujeres transgénero vendría de un trasplante de útero exitoso que pueda llevar un embarazo a término en una mujer transgénero. [94] Ha habido nacimientos exitosos con trasplante de útero en mujeres cis, pero actualmente ninguno en mujeres trans [94] ya que actualmente no ha habido trasplantes de útero exitosos en mujeres transgénero. [95] Surgen problemas teóricos en el dimorfismo sexual de la pelvis humana, el riesgo del régimen farmacológico (inmunosupresión postrasplante y terapia hormonal para sostener la implantación y el embarazo) y el riesgo de anastomosis neovaginal. [94] [95] [96] Los mismos estudios que identificaron estos riesgos también llegaron a la conclusión de que a pesar de las consideraciones, el trasplante de útero no debería limitarse a las mujeres cis, [94] [95] [96] con un artículo de revista incapaz de encontrar ningún aumento en el riesgo teórico del procedimiento en comparación con las mujeres cis. [96] No hay expectativa de que las mujeres trans den a luz a través del canal neovaginal. [97]
Hasta 2019, se habían realizado más de 42 procedimientos de trasplante uterino en mujeres cisgénero, con 12 nacimientos vivos resultantes de los úteros trasplantados hasta la publicación. [98] La Sociedad Internacional de Trasplante Uterino (ISUTx) se estableció a nivel internacional en 2016, con 70 médicos clínicos y científicos, y actualmente tiene 140 delegados intercontinentales. [99] Su objetivo es, "a través de innovaciones científicas, avanzar en la atención médica en el campo del trasplante de útero". [100]
En 2012, la Universidad McGill publicó en Transplant International los “Criterios de Montreal para la viabilidad ética del trasplante uterino”, un conjunto de criterios propuestos para llevar a cabo trasplantes uterinos . [101] Según estos criterios, solo una mujer cisgénero podría ser considerada éticamente como receptora de trasplante. La exclusión de las mujeres trans de la candidatura puede carecer de justificación. [102]
Además, si las mujeres trans desean concebir con una pareja masculina cisgénero, enfrentan los mismos problemas que las parejas homosexuales cisgénero tienen para crear un cigoto.
{{cite news}}: CS1 maint: unrecognized language (link)Tradicionalmente, se ha aconsejado a los pacientes que criopreservaran el esperma antes de comenzar la terapia hormonal cruzada, ya que existe un potencial de disminución de la motilidad del esperma con la terapia de estrógenos en dosis altas con el tiempo (Lubbert et al., 1992). Sin embargo, esta disminución de la fertilidad debido a la terapia de estrógenos es controvertida debido a los estudios limitados.
Los estrógenos son inhibidores muy eficaces del eje hipotálamo-hipofisario-testicular (212-214). Además de su acción de retroalimentación negativa a nivel del hipotálamo y la hipófisis, es probable que tengan efectos inhibidores directos sobre el testículo (215,216). [...] La histología de los testículos [con tratamiento estrogénico] mostró desorganización de los túbulos seminíferos, vacuolización y ausencia de luz, y compartimentación de la espermatogénesis.
actúan principalmente a través de una retroalimentación negativa a nivel hipotálamo-hipofisario para reducir la secreción de LH y la síntesis de andrógenos testiculares. [...] Curiosamente, si se interrumpe el tratamiento con estrógenos después de 3 años de exposición ininterrumpida, la testosterona sérica puede permanecer en niveles de castración hasta otros 3 años. Se cree que esta supresión prolongada es resultado de un efecto directo de los estrógenos sobre las células de Leydig.
Los antiandrógenos no esteroides incluyen flutamida, nilutamida y bicalutamida, que no reducen los niveles de andrógenos y pueden ser favorables para las personas que desean preservar el impulso sexual y la fertilidad [9].
{{cite news}}: |last2=tiene nombre genérico ( ayuda )Sin embargo, ciertamente vale la pena mencionar que no parece haber una razón ética prima facie para rechazar la idea de realizar un trasplante uterino en un paciente masculino o trans. Un paciente asignado como varón al nacer que desee gestar un niño no tiene un derecho menor a ese deseo que cualquier otra persona. El principio de autonomía no es específico del sexo. Este derecho no es absoluto, pero no es competencia de la medicina decidir qué es irrazonable solicitar para una persona en pleno uso de sus facultades mentales, salvo en lo que se refiere al riesgo médico y quirúrgico, así como a la distribución de los recursos. Un hombre que se identifica como mujer, por ejemplo, podría decirse que tiene una incapacidad funcionalmente innata, sin diferencia funcional alguna de una mujer que nace con una incapacidad funcional innata. Independientemente de los desafíos quirúrgicos que implique, el derecho de esa persona a la autogestión de su potencial reproductivo debería ser igual al de sus pares genéticamente femeninos y debería ser respetado.