El grupo 5 es un grupo de elementos de la tabla periódica . El grupo 5 contiene vanadio (V), niobio (Nb), tantalio (Ta) y dubnio (Db). [1] Este grupo se encuentra en el bloque d de la tabla periódica. A este grupo a veces se le llama grupo del vanadio o familia del vanadio por su miembro más ligero; sin embargo, el grupo en sí no ha adquirido un nombre trivial porque pertenece a la agrupación más amplia de los metales de transición .
Como es típico de los metales de transición temprana, el niobio y el tántalo tienen solo el estado de oxidación grupal de +5 como principal, y son bastante electropositivos (es fácil donar electrones) y tienen una química de coordinación menos rica (la química de los iones metálicos unidos a las moléculas). Debido a los efectos de la contracción de los lantánidos , la disminución de los radios iónicos en los lantánidos , son muy similares en propiedades. El vanadio es algo distinto debido a su tamaño más pequeño: también tiene estados +2, +3 y +4 bien definidos (aunque +5 es más estable).
Los tres elementos más ligeros del Grupo 5 se encuentran en la naturaleza y comparten propiedades similares; los tres son metales refractarios duros en condiciones estándar. El cuarto elemento, el dubnio , se ha sintetizado en laboratorios, pero no se ha encontrado en la naturaleza; la vida media del isótopo más estable, el dubnio-268, es de solo 16 horas, y otros isótopos son aún más radiactivos .
_by_Rafael_Ximeno_y_Planes_-_Museo_Tolsá_-_Palacio_de_Minería_-_Mexico_2024.jpg/440px-'Andrés_Manuel_de_Río'_(1825)_by_Rafael_Ximeno_y_Planes_-_Museo_Tolsá_-_Palacio_de_Minería_-_Mexico_2024.jpg)
El grupo 5 es el nuevo nombre IUPAC para este grupo; el antiguo nombre de estilo era grupo VB en el antiguo sistema estadounidense (CAS) o grupo VA en el sistema europeo (antiguo IUPAC). El grupo 5 no debe confundirse con el grupo con los nombres cruzados de grupo de estilo antiguo de VA (sistema estadounidense, CAS) o VB (sistema europeo, antiguo IUPAC); ese grupo ahora se llama pnicógenos o grupo 15.
El vanadio fue descubierto en 1801 por el mineralogista español Andrés Manuel del Río . Del Río extrajo el elemento de una muestra de mineral mexicano de "plomo marrón", más tarde llamado vanadinita . Encontró que sus sales exhiben una amplia variedad de colores, y como resultado nombró al elemento pancromo (griego: παγχρώμιο "todos los colores"). Más tarde, Del Río renombró el elemento eritronio (griego: ερυθρός "rojo") porque la mayoría de las sales se volvían rojas al calentarlas. En 1805, el químico francés Hippolyte Victor Collet-Descotils , respaldado por el amigo de Del Río, el barón Alexander von Humboldt , declaró incorrectamente que el nuevo elemento de Del Río era una muestra impura de cromo . Del Río aceptó la declaración de Collet-Descotils y se retractó de su afirmación. [2]
En 1831, el químico sueco Nils Gabriel Sefström redescubrió el elemento en un nuevo óxido que encontró mientras trabajaba con minerales de hierro . Más tarde ese año, Friedrich Wöhler confirmó el trabajo anterior de del Río. [3] Sefström eligió un nombre que comenzara con V, que aún no había sido asignado a ningún elemento. Llamó al elemento vanadio en honor al nórdico antiguo Vanadís (otro nombre para la diosa nórdica Vanir Freyja , cuyos atributos incluyen la belleza y la fertilidad), debido a los muchos compuestos químicos de hermosos colores que produce. [3] En 1831, el geólogo George William Featherstonhaugh sugirió que el vanadio debería ser renombrado rionio en honor a del Río, pero esta sugerencia no fue seguida. [4]
.jpg/440px-Charles_Hatchett._Soft-ground_etching_by_F._C._Lewis_after_T_Wellcome_V0002614_(cropped).jpg)
El niobio fue identificado por el químico inglés Charles Hatchett en 1801. [5] [6] [7] Encontró un nuevo elemento en una muestra mineral que había sido enviada a Inglaterra desde Connecticut , Estados Unidos en 1734 por John Winthrop FRS (nieto de John Winthrop el Joven ) y nombró al mineral columbita y al nuevo elemento columbio en honor a Columbia , [8] el nombre poético de los Estados Unidos. [9] [10] [11] Sin embargo, después de la 15.ª Conferencia de la Unión de Química en Ámsterdam en 1949, se eligió el nombre niobio para el elemento 41. [12] El columbio descubierto por Hatchett probablemente fue una mezcla del nuevo elemento con tantalio, [9] que fue descubierto por primera vez en 1802 por Anders Gustav Ekeberg .
Posteriormente, hubo una considerable confusión [13] sobre la diferencia entre el columbio (niobio) y el tántalo, estrechamente relacionado. En 1809, el químico inglés William Hyde Wollaston comparó los óxidos derivados tanto del columbio (columbita, con una densidad de 5,918 g/cm 3 ) como del tántalo (tantalita) , con una densidad de más de 8 g/cm 3 , y concluyó que los dos óxidos, a pesar de la diferencia significativa en densidad, eran idénticos; por lo tanto, mantuvo el nombre de tántalo. [13] Esta conclusión fue cuestionada en 1846 por el químico alemán Heinrich Rose , quien argumentó que había dos elementos diferentes en la muestra de tantalita, y los nombró en honor a los hijos de Tántalo : niobio (de Niobe ) y pelopio (de Pelops ). [14] [15] Esta confusión surgió de las mínimas diferencias observadas entre el tántalo y el niobio. Los elementos nuevos reivindicados , pelopio , ilmenio y dianio [16], eran de hecho idénticos al niobio o a las mezclas de niobio y tantalio. [17] El tantalio puro no se produjo hasta 1903. [18]
El último elemento del grupo, el dubnio , no se produce de forma natural, por lo que debe sintetizarse en un laboratorio. La primera detección notificada fue realizada por un equipo del Instituto Conjunto de Investigación Nuclear (JINR), que en 1968 había producido el nuevo elemento bombardeando un objetivo de americio -243 con un haz de iones de neón -22, y notificó actividades alfa de 9,4 MeV (con una vida media de 0,1–3 segundos) y 9,7 MeV ( t 1/2 > 0,05 s) seguidas de actividades alfa similares a las de 256 103 o 257 103. Con base en predicciones teóricas previas, las dos líneas de actividad se asignaron a 261 105 y 260 105, respectivamente. [19]
Después de observar las desintegraciones alfa del elemento 105, los investigadores se propusieron observar la fisión espontánea (FE) del elemento y estudiar los fragmentos de fisión resultantes. Publicaron un artículo en febrero de 1970, en el que informaban de múltiples ejemplos de dos de esas actividades, con vidas medias de 14 ms y2,2 ± 0,5 s . Asignaron la primera actividad a 242mf Am [a] y atribuyeron la segunda actividad a un isótopo del elemento 105. Sugirieron que era poco probable que esta actividad pudiera provenir de una reacción de transferencia en lugar del elemento 105, porque la relación de rendimiento para esta reacción era significativamente menor que la de la reacción de transferencia productora de 242mf Am, de acuerdo con las predicciones teóricas. Para establecer que esta actividad no provenía de una reacción ( 22 Ne, x n), los investigadores bombardearon un objetivo de 243 Am con 18 iones O ; las reacciones que produjeron 256 103 y 257 103 mostraron muy poca actividad de SF (coincidiendo con los datos establecidos), y la reacción que produjo 258 103 y 259 103 más pesados no produjo actividad de SF en absoluto, de acuerdo con los datos teóricos. Los investigadores concluyeron que las actividades observadas provenían de SF del elemento 105. [19]
El JINR intentó entonces un experimento para crear el elemento 105, publicado en un informe en mayo de 1970. Afirmaron que habían sintetizado más núcleos del elemento 105 y que el experimento confirmó su trabajo anterior. Según el artículo, el isótopo producido por el JINR fue probablemente 261 105, o posiblemente 260 105. [19] Este informe incluyó un examen químico inicial: se aplicó la versión de gradiente térmico del método de cromatografía de gases para demostrar que el cloruro de lo que se había formado a partir de la actividad del SF casi coincidía con la del pentacloruro de niobio , en lugar del tetracloruro de hafnio . El equipo identificó una actividad del SF de 2,2 segundos en un cloruro volátil que presenta propiedades de eka-tántalo, e infirió que la fuente de la actividad del SF debe haber sido el elemento 105. [19]
En junio de 1970, el JINR mejoró su primer experimento, utilizando un objetivo más puro y reduciendo la intensidad de las reacciones de transferencia instalando un colimador antes del receptor. Esta vez, pudieron encontrar actividades alfa de 9,1 MeV con isótopos hijos identificables como 256 103 o 257 103, lo que implica que el isótopo original era 260 105 o 261 105. [19]
Surgió una controversia sobre quién había descubierto el elemento, y cada grupo sugirió su propio nombre: el grupo de Dubna lo nombró nielsbohrio en honor a Niels Bohr , mientras que el grupo de Berkeley lo nombró hahnio en honor a Otto Hahn . [20] Finalmente, un grupo de trabajo conjunto de la IUPAC y la IUPAP , el Transfermium Working Group, decidió que el crédito por el descubrimiento debía ser compartido. Después de que se intentaran varios compromisos, donde el elemento 105 se llamó kurchatovio , joliotio y hahnio , en 1997 la IUPAC nombró oficialmente al elemento dubnio en honor a Dubna, [21] [18] y el nielsbohrio finalmente se simplificó y se usó para el elemento 107 .
Al igual que otros grupos, los miembros de esta familia muestran patrones en su configuración electrónica , especialmente en las capas más externas. (La configuración 4d 3 5s 2 esperada para el niobio es un estado excitado de muy baja intensidad, de aproximadamente 0,14 eV). [22]
La mayor parte de la química se ha observado solo para los tres primeros miembros del grupo (la química del dubnio no está muy establecida, pero lo que se sabe parece coincidir con las expectativas para un congénere más pesado del tántalo). Todos los elementos del grupo son metales reactivos con altos puntos de fusión (1910 °C, 2477 °C, 3017 °C). La reactividad no siempre es obvia debido a la rápida formación de una capa de óxido estable, que evita reacciones posteriores, de manera similar a las tendencias en el Grupo 3 o el Grupo 4. Los metales forman diferentes óxidos: el vanadio forma óxido de vanadio (II) , óxido de vanadio (III) , óxido de vanadio (IV) y óxido de vanadio (V) , el niobio forma óxido de niobio (II) , óxido de niobio (IV) y óxido de niobio (V) , pero de los óxidos de tántalo solo se caracteriza el óxido de tántalo (V) . Los óxidos de metal (V) son generalmente no reactivos y actúan como ácidos en lugar de bases, pero los óxidos inferiores son menos estables. Sin embargo, tienen algunas propiedades inusuales para los óxidos, como una alta conductividad eléctrica. [23]
Los tres elementos forman diversos compuestos inorgánicos , generalmente en el estado de oxidación +5. También se conocen estados de oxidación inferiores, pero son menos estables y su estabilidad disminuye a medida que aumenta la masa atómica.
El vanadio forma óxidos en los estados de oxidación +2, +3, +4 y +5 , formando óxido de vanadio(II) (VO), óxido de vanadio(III) (V2O3 ) , óxido de vanadio ( IV ) ( VO2 ) y óxido de vanadio(V) ( V2O5 ). El óxido de vanadio(V) o pentóxido de vanadio es el más común, siendo precursor de la mayoría de las aleaciones y compuestos de vanadio, y también es un catalizador industrial ampliamente utilizado. [24]
El niobio forma óxidos en los estados de oxidación +5 ( Nb 2 O 5 ), [25] +4 ( NbO 2 ), y el estado de oxidación más raro, +2 ( NbO ). [26] El más común es el pentóxido, que también es precursor de casi todos los compuestos y aleaciones de niobio. [23] [27]
El pentóxido de tantalio (Ta 2 O 5 ) es el compuesto más importante desde el punto de vista de las aplicaciones. Los óxidos de tantalio en estados de oxidación más bajos son numerosos, incluidas muchas estructuras defectuosas , y están poco estudiados o pobremente caracterizados. [26]
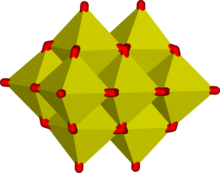
En solución acuosa, el vanadio (V) forma una extensa familia de oxianiones como se estableció mediante espectroscopia de RMN de 51 V. [28] Las interrelaciones en esta familia se describen mediante el diagrama de predominio , que muestra al menos 11 especies, dependiendo del pH y la concentración. [29] El ion ortovanadato tetraédrico, VO3−
4, es la especie principal presente a pH 12-14. Similar en tamaño y carga al fósforo(V), el vanadio(V) también tiene una química y cristalografía paralelas. Ortovanadato V O3−
4Se utiliza en cristalografía de proteínas [30] para estudiar la bioquímica del fosfato. [31] Además de eso, también se ha demostrado que este anión interactúa con la actividad de algunas enzimas específicas. [32] [33] El tetratiovanadato [VS 4 ] 3− es análogo al ion ortovanadato. [34]
A valores de pH más bajos, se forman el monómero [HVO 4 ] 2− y el dímero [V 2 O 7 ] 4− , predominando el monómero a una concentración de vanadio inferior a c. 10 −2 M (pV > 2, donde pV es igual al valor negativo del logaritmo de la concentración total de vanadio/M). La formación del ion divanadato es análoga a la formación del ion dicromato . A medida que se reduce el pH, se produce una mayor protonación y condensación a polivanadatos : a pH 4–6 predomina [H 2 VO 4 ] − a pV mayor de ca. 4, mientras que a concentraciones más altas se forman trímeros y tetrámeros. Entre pH 2–4 predomina el decavanadato , su formación a partir del ortovanadato está representada por esta reacción de condensación:
En el decavanadato, cada centro V(V) está rodeado por seis ligandos de óxido . [23] El ácido vanádico, H 3 VO 4 existe solo en concentraciones muy bajas porque la protonación de la especie tetraédrica [H 2 VO 4 ] − da como resultado la formación preferencial de la especie octaédrica [VO 2 (H 2 O) 4 ] + . En soluciones fuertemente ácidas, pH < 2, [VO 2 (H 2 O) 4 ] + es la especie predominante, mientras que el óxido V 2 O 5 precipita de la solución a altas concentraciones. El óxido es formalmente el anhídrido de ácido del ácido vanádico. Las estructuras de muchos compuestos de vanadato se han determinado mediante cristalografía de rayos X.

El vanadio(V) forma diversos complejos peroxo, sobre todo en el sitio activo de las enzimas bromoperoxidasas que contienen vanadio. La especie VO(O) 2 ( H2O ) 4+ es estable en soluciones ácidas. En soluciones alcalinas se conocen especies con 2, 3 y 4 grupos peróxido; la última forma sales violetas con la fórmula M3V ( O2)4nH2O ( M = Li , Na, etc.), en la que el vanadio tiene una estructura dodecaédrica de 8 coordenadas. [36] [37]
Los niobatos se generan disolviendo el pentóxido en soluciones de hidróxido básico o fundiéndolo en óxidos de metales alcalinos. Algunos ejemplos son el niobato de litio ( LiNbO 3 ) y el niobato de lantano ( LaNbO 4 ). En el niobato de litio hay una estructura similar a la perovskita distorsionada trigonalmente , mientras que el niobato de lantano contiene solo NbO3−
4iones. [23]
Los tantalatos, compuestos que contienen [TaO 4 ] 3− o [TaO 3 ] − son numerosos. El tantalato de litio (LiTaO 3 ) adopta una estructura de perovskita. El tantalato de lantano (LaTaO 4 ) contiene TaO aislado.3−
4tetraedros. [23]
Se conocen doce haluros binarios , compuestos con la fórmula VX n (n=2...5). VI 4 , VCl 5 , VBr 5 y VI 5 no existen o son extremadamente inestables. En combinación con otros reactivos, el VCl 4 se utiliza como catalizador para la polimerización de dienos . Como todos los haluros binarios, los de vanadio son ácidos de Lewis , especialmente los de V(IV) y V(V). Muchos de los haluros forman complejos octaédricos con la fórmula VX n L 6− n (X= haluro; L= otro ligando).
Se conocen muchos oxihaluros de vanadio (fórmula VO m X n ). [38] El oxitricloruro y el oxitrifluoruro ( VOCl 3 y VOF 3 ) son los más estudiados. Similares al POCl 3 , son volátiles, adoptan estructuras tetraédricas en fase gaseosa y son ácidos de Lewis.


El niobio forma haluros en los estados de oxidación de +5 y +4, así como diversos compuestos subestequiométricos . [23] [39] Los pentahaluros ( NbX
5) presentan centros octaédricos de Nb. El pentafluoruro de niobio ( NbF 5 ) es un sólido blanco con un punto de fusión de 79,0 °C y el pentacloruro de niobio ( NbCl 5 ) es amarillo (ver imagen a la izquierda) con un punto de fusión de 203,4 °C. Ambos se hidrolizan para dar óxidos y oxihaluros, como NbOCl 3 . El pentacloruro es un reactivo versátil utilizado para generar compuestos organometálicos , como el dicloruro de nioboceno ( (C
5yo
5)
2NbCl
2). [40] Los tetrahaluros ( NbX
4) son polímeros de color oscuro con enlaces Nb-Nb; por ejemplo, el tetrafluoruro de niobio higroscópico negro ( NbF 4 ) y el tetracloruro de niobio marrón ( NbCl 4 ).
Los compuestos de haluro aniónico de niobio son bien conocidos, debido en parte a la acidez de Lewis de los pentahaluros. El más importante es [NbF 7 ] 2− , un intermediario en la separación de Nb y Ta de los minerales. [41] Este heptafluoruro tiende a formar el oxopentafluoruro más fácilmente que el compuesto de tántalo. Otros complejos de haluro incluyen el [ NbCl 6 ] − octaédrico :
Al igual que con otros metales con números atómicos bajos, se conoce una variedad de iones de grupos de haluro reducido, siendo el principal ejemplo [ Nb 6 Cl 18 ] 4− . [26]
Los haluros de tantalio abarcan los estados de oxidación +5, +4 y +3. El pentafluoruro de tantalio (TaF 5 ) es un sólido blanco con un punto de fusión de 97,0 °C. El anión [TaF 7 ] 2- se utiliza para su separación del niobio. [41] El cloruro TaCl
5, que existe como dímero, es el principal reactivo en la síntesis de nuevos compuestos de Ta. Se hidroliza fácilmente a oxicloruro . Los haluros inferiores TaX
4y Impuestos
3, cuentan con bonos Ta-Ta. [23] [39]
Las tendencias en el grupo 5 siguen las de los otros grupos del bloque d temprano y reflejan la adición de una capa f llena al núcleo al pasar del quinto al sexto período. Todos los miembros estables del grupo son metales refractarios de color azul plateado , aunque las impurezas de carbono , nitrógeno y oxígeno los vuelven frágiles. [42] Todos ellos cristalizan en la estructura cúbica centrada en el cuerpo a temperatura ambiente, [43] y se espera que el dubnio haga lo mismo. [44]
La siguiente tabla es un resumen de las propiedades físicas clave de los elementos del grupo 5. El valor marcado con un signo de interrogación es un valor predicho. [45]
El vanadio es un metal de dureza media, dúctil y de color azul acerado. Es conductor de electricidad y aislante térmico . Algunas fuentes describen al vanadio como "blando", tal vez porque es dúctil, maleable y no quebradizo . [48] [49] El vanadio es más duro que la mayoría de los metales y aceros (véase Durezas de los elementos (página de datos) y el hierro ). Tiene buena resistencia a la corrosión y es estable frente a los álcalis y los ácidos sulfúrico y clorhídrico . [23] Se oxida en el aire a unos 933 K (660 °C, 1220 °F), aunque se forma una capa de pasivación de óxido incluso a temperatura ambiente.
El niobio es un metal gris, brillante , dúctil y paramagnético del grupo 5 de la tabla periódica (ver tabla), con una configuración electrónica en las capas más externas atípica para el grupo 5. De manera similar, existen configuraciones atípicas en las proximidades del rutenio (44), el rodio (45) y el paladio (46).
Aunque se piensa que tiene una estructura cristalina cúbica centrada en el cuerpo desde el cero absoluto hasta su punto de fusión, las mediciones de alta resolución de la expansión térmica a lo largo de los tres ejes cristalográficos revelan anisotropías que son inconsistentes con una estructura cúbica. [50] Por lo tanto, se esperan más investigaciones y descubrimientos en esta área.
El niobio se convierte en un superconductor a temperaturas criogénicas . A presión atmosférica, tiene la temperatura crítica más alta de los superconductores elementales a 9,2 K. [51] El niobio tiene la mayor profundidad de penetración magnética de todos los elementos. [51] Además, es uno de los tres superconductores elementales de tipo II , junto con el vanadio y el tecnecio . Las propiedades superconductoras dependen en gran medida de la pureza del metal niobio. [52]
Cuando está muy puro, es comparativamente blando y dúctil, pero las impurezas lo hacen más duro. [53]
El metal tiene una sección transversal de captura baja para neutrones térmicos ; [54] por lo tanto, se utiliza en las industrias nucleares donde se desean estructuras transparentes a los neutrones. [55]
El tantalio es oscuro (gris azulado), [56] denso, dúctil, muy duro, fácil de fabricar y muy conductor de calor y electricidad. El metal es famoso por su resistencia a la corrosión por ácidos ; de hecho, a temperaturas inferiores a 150 ° C, el tantalio es casi completamente inmune al ataque del normalmente agresivo agua regia . Se puede disolver con ácido fluorhídrico o soluciones ácidas que contengan el ion fluoruro y trióxido de azufre , así como con una solución de hidróxido de potasio . El alto punto de fusión del tantalio de 3017 °C (punto de ebullición 5458 °C) es superado entre los elementos solo por el tungsteno , el renio y el osmio para los metales, y el carbono .
El tantalio existe en dos fases cristalinas, alfa y beta. La fase alfa es relativamente dúctil y blanda; tiene una estructura cúbica centrada en el cuerpo ( grupo espacial Im3m , constante reticular a = 0,33058 nm), dureza Knoop 200–400 HN y resistividad eléctrica 15–60 μΩ⋅cm. La fase beta es dura y quebradiza; su simetría cristalina es tetragonal (grupo espacial P42/mnm , a = 1,0194 nm, c = 0,5313 nm), la dureza Knoop es 1000–1300 HN y la resistividad eléctrica es relativamente alta a 170–210 μΩ⋅cm. La fase beta es metaestable y se convierte a la fase alfa al calentarla a 750–775 °C. El tantalio a granel está compuesto casi en su totalidad por fase alfa, y la fase beta suele existir en forma de películas delgadas [57] obtenidas por pulverización catódica con magnetrón , deposición química en fase de vapor o deposición electroquímica a partir de una solución eutéctica de sal fundida. [58]

Un efecto relativista directo es que, a medida que aumentan los números atómicos de los elementos, los electrones más internos comienzan a girar más rápido alrededor del núcleo como resultado de un aumento de la atracción electromagnética entre un electrón y un núcleo. Se han encontrado efectos similares para los orbitales s más externos (y los p 1/2 , aunque en el dubnio no están ocupados): por ejemplo, el orbital 7s se contrae en un 25% de tamaño y se estabiliza en 2,6 eV . [45]
Un efecto más indirecto es que los orbitales s y p 1/2 contraídos protegen la carga del núcleo de manera más efectiva, dejando menos para los electrones d y f externos, que por lo tanto se mueven en orbitales más grandes. El dubnio se ve muy afectado por esto: a diferencia de los miembros anteriores del grupo 5, sus electrones 7s son ligeramente más difíciles de extraer que sus electrones 6d. [45]

Otro efecto es la interacción espín-órbita , en particular la división espín-órbita, que divide la subcapa 6d (el número cuántico azimutal ℓ de la capa d es 2) en dos subcapas, en las que cuatro de los diez orbitales tienen su ℓ reducido a 3/2 y seis elevado a 5/2. Se elevan los diez niveles de energía; cuatro de ellos son más bajos que los otros seis. (Los tres electrones 6d normalmente ocupan los niveles de energía más bajos, 6d 3/2 ). [45]
Un solo átomo ionizado de dubnio (Db + ) debería perder un electrón 6d en comparación con un átomo neutro; los átomos doblemente (Db 2+ ) o triplemente (Db 3+ ) ionizados de dubnio deberían eliminar electrones 7s, a diferencia de sus homólogos más ligeros. A pesar de los cambios, se espera que el dubnio todavía tenga cinco electrones de valencia; no se ha demostrado que los niveles de energía 7p influyan en el dubnio y sus propiedades. Como los orbitales 6d del dubnio están más desestabilizados que los 5d del tántalo, y se espera que Db 3+ tenga dos electrones 6d, en lugar de 7s, restantes, se espera que el estado de oxidación +3 resultante sea inestable e incluso más raro que el del tántalo. El potencial de ionización del dubnio en su estado de oxidación máximo +5 debería ser ligeramente inferior al del tántalo y el radio iónico del dubnio debería aumentar en comparación con el tántalo; esto tiene un efecto significativo en la química del dubnio. [45]
Los átomos de dubnio en estado sólido deberían organizarse en una configuración cúbica centrada en el cuerpo , como los elementos del grupo 5 anterior. [44] La densidad prevista del dubnio es 21,6 g/cm 3 . [46]
Hay 160 partes por millón de vanadio en la corteza terrestre, lo que lo convierte en el 19.º elemento más abundante allí. El suelo contiene en promedio 100 partes por millón de vanadio y el agua de mar contiene 1,5 partes por mil millones de vanadio. Un ser humano típico contiene 285 partes por mil millones de vanadio. Se conocen más de 60 minerales de vanadio, incluidos la vanadinita , la patronita y la carnotita . [18] Hay 20 partes por millón de niobio en la corteza terrestre, lo que lo convierte en el 33.º elemento más abundante allí. El suelo contiene en promedio 24 partes por millón de niobio y el agua de mar contiene 900 partes por cuatrillón de niobio. Un ser humano típico contiene 21 partes por mil millones de niobio. El niobio se encuentra en los minerales columbita y pirocloro . [18] Hay 2 partes por millón de tantalio en la corteza terrestre, lo que lo convierte en el 51.º elemento más abundante allí. El suelo contiene en promedio de 1 a 2 partes por mil millones de tantalio, y el agua de mar contiene 2 partes por billón de tantalio. Un ser humano típico contiene 2,9 partes por mil millones de tantalio. El tantalio se encuentra en los minerales tantalita y pirocloro. [18] El dubnio no se encuentra de forma natural en la corteza terrestre.
El vanadio metálico se obtiene mediante un proceso de varios pasos que comienza con la tostación del mineral triturado con NaCl o Na2CO3 a unos 850 °C para dar metavanadato de sodio (NaVO3 ) . Un extracto acuoso de este sólido se acidifica para producir una "torta roja", una sal de polivanadato, que se reduce con calcio metálico. Como alternativa para la producción a pequeña escala, el pentóxido de vanadio se reduce con hidrógeno o magnesio . También se utilizan muchos otros métodos, en todos los cuales el vanadio se produce como subproducto de otros procesos. [59] La purificación del vanadio es posible mediante el proceso de barra de cristal desarrollado por Anton Eduard van Arkel y Jan Hendrik de Boer en 1925. Implica la formación del yoduro metálico, en este ejemplo yoduro de vanadio(III) , y la posterior descomposición para producir el metal puro: [60]

La mayor parte del vanadio se utiliza como componente de una aleación de acero llamada ferrovanadio . El ferrovanadio se produce directamente reduciendo una mezcla de óxido de vanadio, óxidos de hierro y hierro en un horno eléctrico. El vanadio termina en arrabio producido a partir de magnetita que contiene vanadio. Dependiendo del mineral utilizado, la escoria contiene hasta un 25% de vanadio. [59]
Se producen aproximadamente 70.000 toneladas de mineral de vanadio al año, de las cuales 25.000 t se producen en Rusia, 24.000 en Sudáfrica , 19.000 en China y 1.000 en Kazajstán . Cada año se producen 7.000 t de vanadio metálico. Es imposible obtener vanadio calentando su mineral con carbono. En cambio, el vanadio se produce calentando óxido de vanadio con calcio en un recipiente a presión . El vanadio de muy alta pureza se produce a partir de una reacción del tricloruro de vanadio con magnesio. [18]
Después de la separación de los demás minerales, se obtienen los óxidos mixtos de tantalio Ta 2 O 5 y niobio Nb 2 O 5 . Para producir niobio, el primer paso en el procesamiento es la reacción de los óxidos con ácido fluorhídrico : [41]
La primera separación a escala industrial, desarrollada por el químico suizo de Marignac , explota las diferentes solubilidades de los fluoruros complejos de niobio y tantalio , oxipentafluoroniobato dipotásico monohidrato ( K 2 [NbOF 5 ]·H 2 O ) y heptafluorotantalato dipotásico ( K 2 [TaF 7 ] ) en agua. Los procesos más nuevos utilizan la extracción líquida de los fluoruros de la solución acuosa con disolventes orgánicos como la ciclohexanona . [41] Los fluoruros complejos de niobio y tantalio se extraen por separado del disolvente orgánico con agua y se precipitan mediante la adición de fluoruro de potasio para producir un complejo de fluoruro de potasio, o se precipitan con amoníaco como pentóxido: [23]
Seguido por:
Se utilizan varios métodos para la reducción a niobio metálico. La electrólisis de una mezcla fundida de K 2 [ NbOF 5 ] y cloruro de sodio es uno; el otro es la reducción del fluoruro con sodio . Con este método, se puede obtener un niobio de pureza relativamente alta. En la producción a gran escala, el Nb 2 O 5 se reduce con hidrógeno o carbono. [23] En la reacción aluminotérmica , una mezcla de óxido de hierro y óxido de niobio se hace reaccionar con aluminio :
Se añaden pequeñas cantidades de oxidantes como el nitrato de sodio para mejorar la reacción. El resultado es óxido de aluminio y ferroniobio , una aleación de hierro y niobio que se utiliza en la producción de acero. [63] [64] El ferroniobio contiene entre un 60 y un 70 % de niobio. [65] Sin óxido de hierro, se utiliza el proceso aluminotérmico para producir niobio. Es necesaria una purificación adicional para alcanzar el grado de aleaciones superconductoras . La fusión por haz de electrones al vacío es el método utilizado por los dos principales distribuidores de niobio. [39] [66]
En 2013 [actualizar], el CBMM de Brasil controlaba el 85 por ciento de la producción mundial de niobio. [67] El Servicio Geológico de los Estados Unidos estima que la producción aumentó de 38.700 toneladas en 2005 a 44.500 toneladas en 2006. [68] [69] Se estima que los recursos mundiales son de 4,4 millones de toneladas. [69] Durante el período de diez años entre 1995 y 2005, la producción se duplicó con creces, a partir de 17.800 toneladas en 1995. [70] Entre 2009 y 2011, la producción se mantuvo estable en 63.000 toneladas por año, [71] con una ligera disminución en 2012 a solo 50.000 toneladas por año. [72]
Se encuentran cantidades menores en el depósito Kanyika de Malawi ( mina Kanyika ).
Se producen anualmente 70.000 t de mineral de tantalio. Brasil produce el 90% del mineral de tantalio, y Canadá, Australia, China y Ruanda también producen este elemento. La demanda de tantalio es de alrededor de 1.200 t al año. [18]
El dubnio se produce sintéticamente bombardeando actínidos con elementos más ligeros. [18] Hasta la fecha, no se han llevado a cabo experimentos en un supercolisionador para sintetizar el siguiente miembro del grupo, ya sea unpentseptium (Ups) o unpentennium (Upe). Como tanto el unpentseptium como el unpentennium son elementos del período tardío 8 , es poco probable que estos elementos se sinteticen en un futuro próximo.

La principal aplicación del vanadio es en aleaciones, como el acero al vanadio . Las aleaciones de vanadio se utilizan en resortes , herramientas , motores a reacción , blindaje y reactores nucleares . El óxido de vanadio le da a la cerámica un color dorado, y otros compuestos de vanadio se utilizan como catalizadores para producir polímeros . [18]
Se añaden pequeñas cantidades de niobio al acero inoxidable para mejorar su calidad. Las aleaciones de niobio también se utilizan en las toberas de los cohetes debido a su alta resistencia a la corrosión . [18]
El tantalio tiene cuatro tipos principales de aplicaciones. El tantalio se añade a objetos expuestos a altas temperaturas, a dispositivos electrónicos , a implantes quirúrgicos y para manipular sustancias corrosivas. [18]
El dubnio no tiene aplicaciones debido a su radiactividad, lo que hace que sea muy peligroso estar cerca de él.
De los elementos del grupo 5, solo el vanadio ha sido identificado como un elemento que desempeña un papel en la química biológica de los sistemas vivos, pero incluso éste desempeña un papel muy limitado en la biología y es más importante en entornos oceánicos que en la tierra.

El vanadio, esencial para las ascidias y los tunicados como vanabinas , se conoce en las células sanguíneas de Ascidiacea (ascidias) desde 1911, [73] [74] en concentraciones de vanadio en su sangre más de 100 veces superiores a la concentración de vanadio en el agua de mar que las rodea. Varias especies de macrohongos acumulan vanadio (hasta 500 mg/kg en peso seco). [75] La bromoperoxidasa dependiente de vanadio genera compuestos organobromados en varias especies de algas marinas . [76]
También se sabe que las ratas y los pollos requieren vanadio en cantidades muy pequeñas y las deficiencias dan como resultado un crecimiento reducido y una reproducción deteriorada . [77] El vanadio es un suplemento dietético relativamente controvertido , principalmente para aumentar la sensibilidad a la insulina [78] y el desarrollo corporal . El sulfato de vanadilo puede mejorar el control de la glucosa en personas con diabetes tipo 2. [79] Además, el decavanadato y los oxovanadatos son especies que potencialmente tienen muchas actividades biológicas y que se han utilizado con éxito como herramientas en la comprensión de varios procesos bioquímicos. [80]
No se sabe que el vanadio puro sea tóxico. Sin embargo, el pentóxido de vanadio causa irritación grave de los ojos, la nariz y la garganta. [18] Se ha informado que el VOSO 4 tetravalente es al menos 5 veces más tóxico que el V 2 O 3 trivalente . [81] La Administración de Seguridad y Salud Ocupacional ha establecido un límite de exposición de 0,05 mg/m 3 para el polvo de pentóxido de vanadio y 0,1 mg/m 3 para los humos de pentóxido de vanadio en el aire del lugar de trabajo durante una jornada laboral de 8 horas, una semana laboral de 40 horas. [82] El Instituto Nacional de Seguridad y Salud Ocupacional ha recomendado que 35 mg/m 3 de vanadio se consideren inmediatamente peligrosos para la vida y la salud, es decir, es probable que causen problemas de salud permanentes o la muerte. [82] Los compuestos de vanadio se absorben mal a través del sistema gastrointestinal. La inhalación de vanadio y compuestos de vanadio produce principalmente efectos adversos en el sistema respiratorio. [83] [84] [85] Sin embargo, los datos cuantitativos son insuficientes para derivar una dosis de referencia por inhalación subcrónica o crónica. Se han informado otros efectos después de exposiciones orales o por inhalación en parámetros sanguíneos, [86] [87] hígado, [88] desarrollo neurológico, [89] y otros órganos [90] en ratas.
Hay poca evidencia de que el vanadio o los compuestos de vanadio sean toxinas reproductivas o teratógenos . Se informó que el pentóxido de vanadio es cancerígeno en ratas macho y en ratones macho y hembra por inhalación en un estudio del NTP, [84] aunque la interpretación de los resultados ha sido cuestionada recientemente. [91] La carcinogenicidad del vanadio no ha sido determinada por la Agencia de Protección Ambiental de los Estados Unidos . [92] Las trazas de vanadio en los combustibles diésel son el principal componente del combustible en la corrosión a alta temperatura . Durante la combustión, el vanadio se oxida y reacciona con el sodio y el azufre, produciendo compuestos de vanadato con puntos de fusión tan bajos como 530 °C, que atacan la capa de pasivación del acero y lo vuelven susceptible a la corrosión. Los compuestos sólidos de vanadio también desgastan los componentes del motor. [93] [94]
El niobio no tiene ninguna función biológica conocida. Mientras que el polvo de niobio es un irritante para los ojos y la piel [18] y un peligro potencial de incendio, el niobio elemental en una escala mayor es fisiológicamente inerte (y por lo tanto hipoalergénico) e inofensivo. A menudo se utiliza en joyería y se ha probado su uso en algunos implantes médicos. [95] [96] Se cree que el niobio y sus compuestos son ligeramente tóxicos. La exposición a corto y largo plazo a los niobatos y al cloruro de niobio, dos sustancias químicas solubles en agua, se ha probado en ratas. Las ratas tratadas con una sola inyección de pentacloruro de niobio o niobatos muestran una dosis letal media (LD50 ) entre 10 y 100 mg/kg. [97] [98] [99] Para la administración oral la toxicidad es menor; un estudio con ratas arrojó una LD50 después de siete días de 940 mg/kg. [97]
Los compuestos que contienen tantalio rara vez se encuentran en el laboratorio, y este y sus compuestos rara vez causan lesiones, y cuando lo hacen, las lesiones normalmente son erupciones. [18] El metal es altamente biocompatible [100] y se utiliza para implantes y recubrimientos corporales , por lo tanto, la atención puede centrarse en otros elementos o en la naturaleza física del compuesto químico . [101] Las personas pueden estar expuestas al tantalio en el lugar de trabajo al respirarlo, por contacto con la piel o con los ojos. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal ( límite de exposición permisible ) para la exposición al tantalio en el lugar de trabajo en 5 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado de 5 mg/m 3 durante una jornada laboral de 8 horas y un límite a corto plazo de 10 mg/m 3. A niveles de 2500 mg/m 3 , el tantalio es inmediatamente peligroso para la vida y la salud . [102]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: |journal=ignorado ( ayuda ){{cite book}}: |journal=ignorado ( ayuda )