El gluten es la proteína de almacenamiento de las semillas maduras de trigo (y de las semillas de especies estrechamente relacionadas). Es la sustancia pegajosa del trigo harinero que permite que la masa suba y conserve su forma durante el horneado. Las mismas proteínas, o muy similares, también se encuentran en pastos relacionados dentro de la tribu Triticeae . Los glutenes de semillas de algunas plantas que no son Triticeae tienen propiedades similares, pero ninguno puede funcionar a la par con los de los taxones Triticeae, particularmente las especies Triticum (trigo harinero, trigo duro, etc.). Lo que distingue al trigo harinero de estas otras semillas de pastos es la cantidad de estas proteínas y el nivel de subcomponentes, siendo el trigo harinero el que tiene el mayor contenido de proteínas y una mezcla compleja de proteínas derivadas de tres especies de pastos ( Aegilops speltoides , Aegilops tauschii strangulata y Triticum) . monococo ).
Las proteínas de las semillas de Triticeae se dividen en cuatro grupos: [1]
De estas proteínas, las dos últimas, la prolamina (en el trigo – gliadina) y la glutelina (en el trigo – glutenina) forman los componentes del gluten clásicamente definidos en el trigo.
Los glutenes de Triticeae son principalmente importantes para una definición en desarrollo de "sin gluten" en los tratamientos dietéticos para la sensibilidad al gluten que tienen como objetivo excluir las proteínas patógenas de la dieta de personas susceptibles (es decir, la enfermedad celíaca ). Los motivos venenosos parecen estar ampliamente extendidos en Triticeae , pero no en otros taxones, para la mayoría de los celíacos. Sin embargo, las cuatro proteínas están involucradas en las alergias al trigo y las proteínas que no son de trigo pueden no estar involucradas en ciertas alergias al gluten o en sensibilidades idiopáticas.
Proteínas del endospermo de Triticeae que generalmente son ricas en arginina, prolina, glutamina y/o asparagina.
Debido a la utilidad de los glutenes de trigo, los estudios genéticos se han centrado en gran medida en la genética del trigo . El trigo tiene tres genomas (AABBDD) y puede codificar muchas variaciones de la misma proteína, incluso en las subcategorías de gliadina, muchos tipos de gliadina por cultivar, X = genoma (cromosomas del genoma A, B o D (1 a 7)). Los genomas A y B se derivan del trigo silvestre, que a su vez es una especie digenómica natural que contiene un genoma similar al de Triticum monococcum y Aegilops speltoides . El genoma D se deriva de la especie existente Aegilops tauschii strangulatum . [3]
Los estudios genéticos indican que en el trigo, cada tipo de proteína puede ser codificado por varios loci y se pueden encontrar varios alelos diferentes para cada loci en diferentes genomas, lo que permite una gran cantidad de isoformas codificadas de forma única.
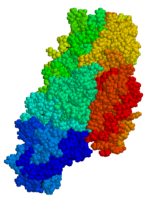
Las prolaminas y, en menor grado, las glutelinas son excelentes sustratos para la desamidación, particularmente por las transglutaminasas de tejidos de mamíferos (tTG). La desamidación es un proceso en el que la porción R-C0-NH2 de las glutaminas (o asparagina) se hidroliza a R-CO-OH formando ácido glutámico o ácido aspártico. En la gliadina, los tripéptidos -QQP-, -QVP-, -QLP-, -QYP- en el contexto de péptidos adyacentes favorables se desamidan fácilmente. [5] La mayoría de las proteínas tienen pocos o ningún sitio de transglutaminasa; sin embargo, la alfa gliadina tiene 13 de esos sitios. La transglutaminasa del tejido humano no sólo desamida la gliadina, sino que también se entrecruza con la gliadina, lo que tiene consecuencias inmunológicas. La gliadina también tiene un pequeño péptido que parece alterar la distribución de la transglutaminasa en el intestino pero no está entrecruzado; el mecanismo de su comportamiento "innato" no está claro. tTG también entrecruza la gliadina con otras proteínas a través de estos sitios, generando respuestas anti-alimentos, respuestas anti-proteínas propias y respuestas de reacción cruzada propia a proteínas alimentarias que dan como resultado autoinmunidades secundarias. La función de los tTG en la matriz extracelular es reticular las cadenas laterales de lisina de proteínas como el colágeno con proteínas; sin embargo, los glutenes parecen infiltrarse en el intestino delgado, interfiriendo con este proceso y dando como resultado un falso reconocimiento inmunológico de la matriz y las células circundantes como extraño , lo que lleva, en última instancia, a la destrucción de la mucosa intestinal. Las semillas de ciertas plantas pueden provocar respuestas innatas y celulares como respuesta defensiva al consumo excesivo de semillas.
Si bien las prolaminas y glutelinas son excelentes sustratos de deamidasa y transaminasa, los motivos altamente repetitivos, en particular los tractos de poliprolina/glutamina, a menudo son sustratos deficientes para las endoproteasas gastrointestinales , como las producidas en el tracto gastrointestinal. Un claro ejemplo es un 33-mero de α-2 gliadina . Otra región resistente a la digestión es una de 25 unidades que contiene el péptido innato. [6] Las alfa gliadinas, que contienen estos sitios, son específicamente venenosas para las ratas jóvenes cuando se alimentan en concentraciones superiores al 1% [7] y la adición de inhibidores de manosidasa aumenta la sensibilidad específicamente a las alfa gliadinas. [8] Estas propiedades de ciertas alfa-gliadinas parecen haber evolucionado para prevenir el consumo prolongado o exclusivo de ciertos pastos de trigo por parte de ciertas especies. Esta es una de las propiedades irónicas del trigo, ya que una de las principales ventajas del trigo es la cantidad de proteína que contiene; sin embargo, parte de ella se desperdicia en la flora intestinal (o el sistema inmunológico del huésped), ya que no se puede descomponer. Un remedio sugerido para este problema son las nuevas enzimas que ayudan específicamente a descomponer las prolaminas en el estómago. Esto puede prevenir la aparición de enfermedades relacionadas con el trigo en individuos susceptibles, pero actualmente ningún examen de este tipo es eficaz y una vez que se alcanza el estado clínico la mayoría de los individuos son tan sensibles a las gliadinas del trigo que, efectivamente, se requeriría una digestión completa en el estómago.
La inmunoquímica de Triticeae es importante en varias enfermedades autoinmunes (ver sección sobre Enfermedades humanas), sensibilidad al gluten y alergia al gluten en general. Se puede subdividir en respuestas innatas (estimulación directa del sistema inmunológico), presentación mediada por Clase II ( HLA DQ ), estimulación de células asesinas mediada por Clase I y reconocimiento de anticuerpos. La presentación de gliadina a los linfocitos T cooperadores mediada por clase II restringida por DQ parece ser el proceso principal implicado en la enfermedad celíaca .
Los glutenes son una parte esencial de la industria alimentaria moderna. La industria del trigo se remonta a antes del período Neolítico , cuando la gente procesaba los granos (o granos) individualmente a mano. Durante la fase inicial de cultivo, se seleccionaron trigos por su capacidad de cosecha y crecimiento en diversas condiciones climáticas, lo que dio como resultado los primeros cultivares. Esta industria se extendió a muchas áreas de Eurasia occidental durante la neolitización, llevando los cultivares más primitivos. Estos granos podían usarse para sopas (espeltoides) o molerse laboriosamente para obtener harinas simples y productos horneados. Durante la segunda fase se produjo un trigo Emmer que era una especie alocuadrploide y que contenía más gluten, lo que hacía que la cocción fuera más eficiente. Esto también se extendió durante la neolitización, pero en algunos lugares estos cultivares eran una minoría. Una variante del trigo escanda se llama trigo duro y es la fuente de la harina de sémola , que se utiliza para hacer pastas y otras pastas alimenticias. Se encuentran variedades comparables en toda Eurasia. Finalmente, el trigo emmers se combinó con pasto de cabra (Aegilops tauschii) para formar trigo harinero alohexaploide, que tiene una textura suave y fina después de fermentar y cocinar. Las propiedades industriales de este trigo se basan en sus glutenes, glutenes de alta elasticidad, alta tolerancia al calor de otros glutenes o que cambian cuando se someten al calor para producir polímeros más fuertes.
El maíz se prepara hirviéndolo en agua con álcali y luego se muele, lo que da como resultado un material sin piel llamado masa nixtamalizada . La masa se puede utilizar para tortillas, tamales, chips y otros productos, pero se debe utilizar rápidamente porque sus glutenes cambian rápidamente y la unión disminuye rápidamente. Masa no se almacena bien y se le añaden productos químicos para mejorar la conservación a expensas de la calidad. Por el contrario, los glutenes del trigo tienen más propiedades adhesivas que cambian cuando se preparan de diferentes maneras. Las gluteninas, por ejemplo, se estiran, pero también pueden fijar su forma a altas temperaturas, haciendo que el pan mantenga su elevación característica.
Cuando la harina se combina con agua y levadura, la masa puede crecer y posteriormente fijarse mediante calor, lo que da como resultado una capa exterior dura con un interior suave y agradable al paladar. Esto hace que el pan sea fácil de transportar y lo conserva durante varios días (en condiciones secas). La cebada se puede germinar durante un período corto y tostarse, la malta resultante se puede moler para uso alimentario o combinarse con levadura de pan (actualmente una variedad cervecera) para producir cerveza y licores destilados como whisky , vodka y maltas de masa madre . Agregar un ácido suave a la harina de centeno la activa para la elaboración de pan (panes de masa madre utilizados en el norte de Europa).

Agregar huevo a la harina de sémola de T. durum se puede usar para hacer pastas, o sin huevo, una variante de pasta que se usa para hacer bolas de masa chinas. A la harina de trigo o sémola se le pueden añadir otros ingredientes como pescado, carne o leche para crear pastas alimenticias. El trigo se puede procesar aún más hasta obtener una harina muy fina y tamizar; alternativamente, los glutenes se pueden extraer y volver a agregar a otros productos. Si bien muchos glutenes de semillas y gomas alimenticias, cuando se combinan con almidón alimentario, se aproximan a la creación de productos refinados de harina de trigo y harina de trigo duro, ninguna combinación se ha acercado todavía a las cualidades de estas harinas a un precio comparable.

Algunos cultivares de triticeae, como la cebada, tienen valores de proteína relativamente bajos. Esto los hace más aceptables para elaborar cerveza, donde los granos ricos en proteínas pueden provocar una "neblina" proteica o turbidez. Las proteínas de almacenamiento de las semillas de pasto (es decir, el gluten del trigo) están diseñadas para ayudar a la planta a crecer durante su vida temprana, y entre las proteínas de las semillas se encuentran enzimas que convierten el almidón en azúcar.

Estas proteínas se activan durante la germinación y el almidón alrededor del endospermo se convierte en azúcares . Posteriormente, las prolaminas se descomponen para proporcionar a las semillas jóvenes una fuente de nitrógeno y energía, lo que proporciona a las plántulas de Triticeae un gran impulso durante sus primeros años de vida.
Una vez que el almidón se convierte en azúcar , Saccharomyces cerevisiae puede fermentarlo fácilmente . Sin embargo, primero se debe detener el proceso de brotación. Para ello, los granos parcialmente germinados se colocan en un horno de asado y se tuestan hasta que los brotes estén esterilizados y secos. Este proceso de brotación y secado se llama malteado . Luego los brotes tostados se muelen, se rehidratan y se fermentan. Esto produce una cerveza cruda .
El potencial de desamidación de los trigos se analiza anteriormente. Los glutenes son generados por la industria del almidón de trigo. Sin embargo, los glutenes son más difíciles de manejar una vez que se eliminan el almidón y otras proteínas; por ejemplo, los glutenes solubles en alcohol no se pueden mezclar con lácteos ya que el alcohol desnaturaliza y precipita las proteínas lácteas. Por lo tanto, el gluten a menudo se modifica para uso comercial mediante desamidación mediante tratamiento con ácido a altas temperaturas o tratamiento enzimático con desamidasa o transglutaminasas. El aumento de carga aumenta la hidrofilicidad de las gliadinas, lo que hace que se estiren en solución. La desamidación del 20% de las cadenas laterales de glutamina a glutamato es suficiente para generar un producto soluble. Esto hace que el gluten sea lo suficientemente soluble sin alcohol para mezclarlo con otros productos como la leche.
Las personas que padecen enteropatía/enfermedad celíaca sensible al gluten tienen una reacción adversa al gluten de los cultivares de Triticeae cuando lo ingieren. [9] Además del trigo harinero, se sabe que el centeno y la cebada (que tienen gluten similar) causan síntomas en los celíacos. Entre el 2 y el 10% de las personas sensibles al gluten también lo son a la avena , pero no está claro en qué medida esto se debe a la contaminación de las semillas de triticeae en la avena o a respuestas alérgicas (frente a la intolerancia). Por lo tanto, cuando se aplica de manera amplia, la designación sin gluten se aplica a los alimentos que contienen proteínas de almacenamiento de semillas derivadas de Triticeae.