En espectrometría de masas, la fragmentación es la disociación de iones moleculares energéticamente inestables que se forman al pasar por el espectro de masas de las moléculas . Estas reacciones están bien documentadas a lo largo de las décadas y los patrones de fragmentación son útiles para determinar el peso molar y la información estructural de moléculas desconocidas. [1] [2] La fragmentación que ocurre en experimentos de espectrometría de masas en tándem ha sido un foco de investigación reciente, porque estos datos ayudan a facilitar la identificación de moléculas. [3]

La fragmentación puede ocurrir en la fuente de iones (fragmentación en la fuente) [4] [5] donde se ha utilizado con ionización electrónica [4] para ayudar a identificar moléculas y, recientemente (2020), con ionización por electrospray se ha demostrado que proporciona el mismo beneficio al facilitar la identificación molecular. [5] Antes de estos experimentos, [5] [6] la fragmentación en la fuente de ionización por electrospray generalmente se consideraba un efecto no deseado [7] sin embargo, se ha demostrado que la ionización por electrospray utilizando Fragmentación/Anotación Mejorada en la Fuente (EISA) promueve la fragmentación en la fuente que crea iones de fragmentos que son consistentes con los espectrómetros de masas en tándem. [5] [6] La fragmentación generada por espectrometría de masas en tándem generalmente se realiza en la zona de colisión (fragmentación posterior a la fuente) de un espectrómetro de masas en tándem . La EISA y la disociación inducida por colisión (CID), entre otros eventos físicos que impactan a los iones, son parte de la química de iones en fase gaseosa . Algunos tipos diferentes de fragmentación de masa son la disociación inducida por colisión (CID) a través de la colisión con una molécula neutra, la disociación inducida por superficie (SID) utilizando la colisión de iones de rápido movimiento con una superficie sólida, la disociación inducida por láser que utiliza láser para inducir la formación de iones, la disociación por captura de electrones (ECD) debido a la captura de electrones de baja energía, la disociación por transferencia de electrones (ETD) a través de la transferencia de electrones entre iones, la disociación por transferencia de electrones negativa (NETD), la disociación por desprendimiento de electrones (EDD), la fotodisociación , particularmente la disociación multifotónica infrarroja (IRMPD) que utiliza radiación IR para el bombardeo y la disociación radiativa infrarroja de cuerpo negro (BIRD) que utiliza radiación IR en lugar de láser, la disociación de trampa C de mayor energía (HCD), EISA y la fragmentación remota de carga . [8] [9] [10]
La fragmentación es un tipo de disociación química en la que la eliminación de un electrón de la molécula da como resultado la ionización. La eliminación de electrones del enlace sigma, el enlace pi o los orbitales no enlazantes provoca la ionización. [2] Esto puede tener lugar mediante un proceso de escisión homolítica u homólisis o escisión heterolítica o heterólisis del enlace. La energía relativa del enlace y la capacidad de experimentar estados de transición cíclicos favorables afectan el proceso de fragmentación. Las reglas para los procesos básicos de fragmentación están dadas por la regla de Stevenson.
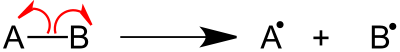
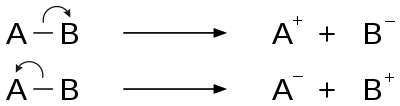
Las dos categorías principales de patrones de escisión de enlaces son las reacciones de escisión de enlaces simples y las reacciones de reordenamiento. [2]
La mayoría de los compuestos orgánicos experimentan reacciones de ruptura de enlaces simples, en las que se produce una ruptura directa del enlace. La ruptura del enlace sigma, la fragmentación iniciada por el sitio radical y la fragmentación iniciada por el sitio de carga son algunos tipos de reacciones de ruptura de enlaces simples. [2]

La ruptura del enlace sigma se observa con mayor frecuencia en moléculas que pueden producir cationes estables, como alcanos saturados o carbocationes secundarios y terciarios . Esto ocurre cuando se elimina un electrón alfa. El enlace CC se alarga y se debilita, lo que provoca la fragmentación. La fragmentación en este sitio produce un fragmento cargado y un fragmento radical. [2]

La escisión del enlace sigma también ocurre en cationes radicales alejados del sitio de ionización. Esto se observa comúnmente en alcoholes , éteres , cetonas , ésteres , aminas , alquenos y compuestos aromáticos con un carbono unido al anillo. El catión tiene un radical en un heteroátomo o un grupo funcional insaturado. La fuerza impulsora de la fragmentación es la fuerte tendencia del ion radical a aparearse con electrones. La escisión ocurre cuando el radical y un electrón impar de los enlaces adyacentes al radical migran para formar un enlace entre el carbono alfa y el heteroátomo o el grupo funcional insaturado. El enlace sigma se rompe; por lo tanto, esta escisión también se conoce como escisión de enlace homolítico o escisión α. [2]

La fuerza impulsora de la fragmentación iniciada por el sitio de carga es el efecto inductivo del sitio de carga en los cationes radicales. Los electrones del enlace adyacente al átomo que lleva la carga migran a ese átomo, neutralizando la carga original y haciendo que se mueva a un sitio diferente. Este término también se denomina escisión inductiva y es un ejemplo de escisión de enlace heterolítico. [2]

Las reacciones de reordenamiento son reacciones de fragmentación que forman nuevos enlaces que producen una estructura intermedia antes de la escisión. Una de las reacciones de reordenamiento más estudiadas es el reordenamiento de McLafferty / reordenamiento de γ-hidrógeno. Esto ocurre en los cationes radicales con grupos funcionales insaturados, como cetonas , aldehídos , ácidos carboxílicos , ésteres , amidas , olefinas y fenilalcanos. Durante esta reacción, el γ-hidrógeno se transferirá al grupo funcional primero y luego tendrá lugar la escisión posterior del enlace α, β del intermedio. [2] Otras reacciones de reordenamiento incluyen la fisión del anillo heterocíclico (HRF), la fisión formadora de benzofurano (BFF), la fisión de quinona meturo (QM) o Retro Diels-Alder (RDA). [11]