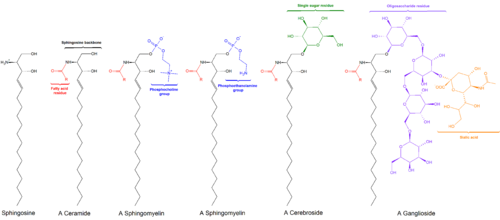
Los esfingolípidos son una clase de lípidos que contienen una estructura principal de bases esfingoides, que son un conjunto de aminoalcoholes alifáticos que incluyen esfingosina . Fueron descubiertos en extractos de cerebro en la década de 1870 y recibieron el nombre de la esfinge mitológica debido a su naturaleza enigmática. [1] [2] Estos compuestos juegan papeles importantes en la transducción de señales y el reconocimiento celular . [3] Las esfingolipidosis , o trastornos del metabolismo de los esfingolípidos, tienen un impacto particular en el tejido neuronal . Un esfingolípido con un grupo hidroxilo terminal es una ceramida . Otros grupos comunes unidos al átomo de oxígeno terminal incluyen fosfocolina , produciendo una esfingomielina , y varios monómeros o dímeros de azúcar , produciendo cerebrósidos y globósidos , respectivamente. Los cerebrósidos y los globósidos se conocen colectivamente como glucoesfingolípidos .
Las bases de cadena larga, a veces simplemente conocidas como bases esfingoides, son los primeros productos no transitorios de la síntesis de novo de esfingolípidos tanto en levaduras como en mamíferos. Estos compuestos, conocidos específicamente como fitoesfingosina y dihidroesfingosina (también conocida como esfinganina, [4] aunque este término es menos común), son principalmente compuestos C 18 , con niveles algo más bajos de bases C 20. [5] Las ceramidas y los glicoesfingolípidos son derivados N -acilados de estos compuestos. [6]
La cadena principal de esfingosina está unida por enlace O a un grupo de cabeza (generalmente) cargado, como etanolamina , serina o colina . [ cita requerida ]
La cadena principal también está unida mediante amida a un grupo acilo , como un ácido graso . [ cita requerida ]
Los esfingolípidos simples, que incluyen las bases esfingoides y las ceramidas, constituyen los primeros productos de las vías sintéticas de los esfingolípidos.
Los esfingolípidos complejos pueden formarse mediante la adición de grupos de cabeza a la ceramida o fitoceramida:
La síntesis de novo de esfingolípidos comienza con la formación de 3-ceto-dihidroesfingosina por la serina palmitoiltransferasa . [9] Los sustratos preferidos para esta reacción son palmitoil-CoA y serina . Sin embargo, estudios han demostrado que la serina palmitoiltransferasa tiene cierta actividad hacia otras especies de acil-CoA graso [10] y aminoácidos alternativos [11] y recientemente se ha revisado la diversidad de bases esfingoides. [12] A continuación, la 3-ceto-dihidroesfingosina se reduce para formar dihidroesfingosina. La dihidroesfingosina es acilada por una de las seis (dihidro)-ceramida sintasa, CerS -originalmente denominada LASS- para formar dihidroceramida. [13] Las seis enzimas CerS tienen diferente especificidad para los sustratos de acil-CoA , lo que resulta en la generación de dihidroceramidas con diferentes longitudes de cadena (que van desde C14 a C26). Luego, las dihidroceramidas se desaturan para formar ceramida. [14]

La ceramida generada de novo es el eje central de la red de esfingolípidos y posteriormente tiene varios destinos. Puede ser fosforilada por la ceramida quinasa para formar ceramida-1-fosfato. Alternativamente, puede ser glicosilada por la glucosilceramida sintasa o la galactosilceramida sintasa. Además, puede convertirse en esfingomielina mediante la adición de un grupo de cabeza de fosforilcolina por la esfingomielina sintasa . El diacilglicerol se genera mediante este proceso. Finalmente, la ceramida puede ser degradada por una ceramidasa para formar esfingosina . La esfingosina puede ser fosforilada para formar esfingosina-1-fosfato. Esta puede ser desfosforilada para reformar esfingosina. [15]
Las vías de degradación permiten la reversión de estos metabolitos a ceramida. Los glicoesfingolípidos complejos se hidrolizan a glucosilceramida y galactosilceramida. Estos lípidos son luego hidrolizados por beta-glucosidasas y beta-galactosidasas para regenerar la ceramida. De manera similar, la esfingomielina puede ser degradada por la esfingomielinasa para formar ceramida. [ cita requerida ]
La única vía por la que los esfingolípidos se convierten en no esfingolípidos es a través de la esfingosina-1-fosfato liasa, que forma fosfato de etanolamina y hexadecenal. [16]
Se cree comúnmente que los esfingolípidos protegen la superficie celular contra factores ambientales dañinos al formar una capa externa mecánicamente estable y químicamente resistente de la bicapa lipídica de la membrana plasmática . Se descubrió que ciertos glicoesfingolípidos complejos estaban involucrados en funciones específicas, como el reconocimiento celular y la señalización . El reconocimiento celular depende principalmente de las propiedades físicas de los esfingolípidos, mientras que la señalización involucra interacciones específicas de las estructuras de glicano de los glicoesfingolípidos con lípidos similares presentes en células vecinas o con proteínas . [ cita requerida ]
Recientemente, se ha demostrado que los metabolitos simples de los esfingolípidos , como la ceramida y la esfingosina-1-fosfato , son mediadores importantes en las cascadas de señalización implicadas en la apoptosis , la proliferación , las respuestas al estrés, la necrosis , la inflamación , la autofagia , la senescencia y la diferenciación . [17] [18] [19] [20] [21] Los lípidos basados en ceramida se autoagregan en las membranas celulares y forman fases separadas menos fluidas que los fosfolípidos a granel. Estos microdominios basados en esfingolípidos, o " balsas lipídicas ", se propusieron originalmente para clasificar las proteínas de membrana a lo largo de las vías celulares de transporte de membrana. En la actualidad, la mayoría de las investigaciones se centran en la función organizadora durante la transducción de señales. [22]
Los esfingolípidos se sintetizan en una vía que comienza en el RE y se completa en el aparato de Golgi , pero estos lípidos se enriquecen en la membrana plasmática y en los endosomas , donde realizan muchas de sus funciones. [23] El transporte se produce a través de vesículas y transporte monomérico en el citosol . Los esfingolípidos están prácticamente ausentes de las mitocondrias y el RE , pero constituyen una fracción molar de 20-35 de los lípidos de la membrana plasmática. [24]
En animales de experimentación, la alimentación con esfingolípidos inhibe la carcinogénesis del colon , reduce el colesterol LDL y eleva el colesterol HDL . [25]
Los esfingolípidos son universales en eucariotas pero son raros en bacterias y arqueas , lo que significa que son evolutivamente muy antiguos. Las bacterias que producen esfingolípidos se encuentran en algunos miembros del grupo superfilo FCB ( Sphingobacteria ), particularmente la familia Sphingomonadaceae , algunos miembros de Bdellovibrionota y algunos miembros de Myxococcota . [26]
Debido a la increíble complejidad de los sistemas de los mamíferos, las levaduras se utilizan a menudo como organismo modelo para desarrollar nuevas vías. Estos organismos unicelulares suelen ser más manejables genéticamente que las células de los mamíferos, y existen bibliotecas de cepas que ofrecen cepas que albergan casi cualquier deleción simple de marco de lectura abierto no letal . Las dos levaduras más utilizadas son Saccharomyces cerevisiae y Schizosaccharomyces pombe , aunque también se realizan investigaciones en la levadura patógena Candida albicans . [ cita requerida ]
Además de las importantes funciones estructurales de los esfingolípidos complejos (inositol fosforilceramida y sus derivados manosilados), las bases esfingoides fitoesfingosina y dihidroesfingosina (esfinganina) desempeñan papeles vitales de señalización en S. cerevisiae . Estos efectos incluyen la regulación de la endocitosis , la proteólisis dependiente de ubiquitina (y, por lo tanto, la regulación de la absorción de nutrientes [27] ), la dinámica del citoesqueleto , el ciclo celular , la traducción , la modificación postraduccional de proteínas y la respuesta al estrés térmico. [28] Además, recientemente se ha descrito la modulación del metabolismo de los esfingolípidos por la señalización del fosfatidilinositol (4,5)-bisfosfato a través de Slm1p y Slm2p y la calcineurina . [29] Además, se ha demostrado una interacción a nivel de sustrato entre la síntesis de esfingolípidos complejos y el ciclo del fosfatidilinositol 4-fosfato por la fosfatidilinositol quinasa Stt4p y la fosfatasa lipídica Sac1p. [30]
Las plantas superiores contienen una variedad más amplia de esfingolípidos que los animales y los hongos. [ cita requerida ]
Existen varios trastornos del metabolismo de los esfingolípidos, conocidos como esfingolipidosis . Los principales miembros de este grupo son la enfermedad de Niemann-Pick , la enfermedad de Fabry , la enfermedad de Krabbe , la enfermedad de Gaucher , la enfermedad de Tay-Sachs y la leucodistrofia metacromática . Por lo general, se heredan de forma autosómica recesiva , pero la enfermedad de Fabry está ligada al cromosoma X. En conjunto, las esfingolipidosis tienen una incidencia de aproximadamente 1 en 10.000, pero sustancialmente más en ciertas poblaciones como los judíos asquenazíes . La terapia de reemplazo enzimático está disponible para tratar principalmente la enfermedad de Fabry y la enfermedad de Gaucher , y las personas con estos tipos de esfingolipidosis pueden vivir hasta bien entrada la edad adulta. Los otros tipos son generalmente fatales entre los 1 y los 5 años de edad para las formas infantiles, pero la progresión puede ser leve para las formas de inicio juvenil o adulto. [ cita requerida ]
Los esfingolípidos también se han relacionado con la proteína frataxina (Fxn), cuya deficiencia está asociada con la ataxia de Friedreich (FRDA). La pérdida de Fxn en el sistema nervioso de ratones también activa una vía hierro/esfingolípido/PDK1/Mef2, lo que indica que el mecanismo está conservado evolutivamente. Además, los niveles de esfingolípidos y la actividad de PDK1 también aumentan en los corazones de los pacientes con FRDA, lo que sugiere que una vía similar se ve afectada en la FRDA. [31] Otras investigaciones han demostrado que la acumulación de hierro en los sistemas nerviosos de las moscas mejora la síntesis de esfingolípidos, que a su vez activa la proteína quinasa dependiente de 3-fosfoinosítido-1 (Pdk1) y el factor potenciador de miocitos-2 (Mef2) para desencadenar la neurodegeneración de los fotorreceptores adultos. [32]
Los esfingolípidos desempeñan un papel clave en la supervivencia neuronal en la enfermedad de Parkinson (EP) y su alteración de la vía catabólica en el cerebro está parcialmente representada en el líquido cefalorraquídeo y los tejidos sanguíneos (Tabla 1) y tienen potencial diagnóstico. [33]