El olfato de los insectos se refiere a la función de los receptores químicos que permiten a los insectos detectar e identificar compuestos volátiles para buscar alimento , evitar a los depredadores, encontrar compañeros de apareamiento (a través de feromonas ) y localizar hábitats de oviposición . [1] Por tanto, es la sensación más importante para los insectos. [1] Los comportamientos más importantes de los insectos deben sincronizarse perfectamente, lo que depende de lo que huelen y cuándo lo huelen. [2] Por ejemplo, el olfato es esencial para localizar plantas hospedantes y cazar presas en muchas especies de insectos, como la polilla Deilephila elpenor y la avispa Polybia sericea , respectivamente.
Los dos órganos que los insectos utilizan principalmente para detectar olores son las antenas y unas piezas bucales especializadas llamadas palpos maxilares. [3] Sin embargo, un estudio reciente ha demostrado el papel olfativo del ovipositor en las avispas del higo. [4] Dentro de estos órganos olfativos hay neuronas llamadas neuronas receptoras olfativas que, como su nombre lo indica, albergan receptores de moléculas aromáticas en su membrana celular. La mayoría de las neuronas receptoras olfativas normalmente residen en la antena . Estas neuronas pueden ser muy abundantes; por ejemplo, las moscas Drosophila tienen 2.600 neuronas sensoriales olfativas. [3]
Los insectos son capaces de oler y diferenciar entre miles de compuestos volátiles de forma sensible y selectiva. [1] [5] La sensibilidad es qué tan sintonizado está el insecto con cantidades muy pequeñas de un olor o pequeños cambios en la concentración de un olor. La selectividad se refiere a la capacidad de los insectos para distinguir un olor de otro. Entre los artrópodos que se alimentan de sangre, estos compuestos comúnmente se dividen en tres clases: ácidos carboxílicos de cadena corta , aldehídos y compuestos nitrogenados de bajo peso molecular. [5]
Los insectos se han utilizado como sistema modelo para estudiar el olfato de los mamíferos y especialmente del ser humano . Sin embargo, a diferencia de los vertebrados que utilizan receptores acoplados a proteína G ( GPCR ), los insectos expresan proteínas que incluyen OR ( receptores olfativos ), GR (receptores gustativos) e IR ( receptores ionotrópicos ), que son todos canales iónicos heteroméricos activados por ligando . [3] Una especie de polilla del orden de los lepidópteros conocida como polilla del gusano cortador negro ( Agrotis ipsilon ) produce aún más proteínas, incluidas OBP ( proteínas de unión a olores ), CSP (proteínas de unión quimiosensorial) y SNMP (proteínas de membrana de neuronas sensoriales) que ayudar a la polilla a reconocer las feromonas sexuales y los olores como los que liberan las plantas hospedantes. [6] Al igual que en los vertebrados, los axones de las neuronas sensoriales convergen en glomérulos, pero difieren en el lugar donde se alojan los glomérulos. En los mamíferos se ubican en los bulbos olfatorios , pero en los insectos se encuentran en el lóbulo antenal . [7]
El olfato es metabólicamente costoso. Las compensaciones evolutivas involucradas requieren más estudios porque, hasta 2016, [actualizar]la mayoría de estas investigaciones se han realizado en condiciones de laboratorio con alimentos irrealmente confiables. [8]
Las neuronas sensoriales en la antena, el palpo maxilar y el labelo generan señales eléctricas específicas de un olor llamadas picos ( potenciales de acción ) en respuesta a la unión de los olores a las proteínas de la superficie celular, como los receptores olfativos . Las neuronas sensoriales de la antena y el maxilar envían esta información a través de sus axones al lóbulo antenal , [7] mientras que las neuronas sensoriales del labelo envían esta información a través de axones al ganglio subesofágico . [9] Dentro del lóbulo antenal hacen sinapsis con otras neuronas en estructuras semidelineadas (con límites de membrana) llamadas glomérulos .
Específicamente, el proceso es el siguiente: primero, el olor flota hacia la antena o palpo maxilar de un insecto , que está cubierto con proyecciones parecidas a pelos llamadas sensilla . [5] Luego, el olor entra a través de pequeños poros en el exoesqueleto (o cutícula) de ese sensillum y se difunde en el líquido entre las células llamado líquido extracelular . [1] Allí, la molécula odorífera se une a una proteína de unión odorante que la transporta a un equipo receptor [1] y correceptor (Orco) en la superficie de la neurona receptora olfativa (ORN). [1] [3] Esto lleva a que la neurona dispare un potencial de acción a lo largo del axón. [2] Esta señal se envía al lóbulo antenal o ganglio subesofágico del cerebro del insecto, donde luego puede integrar la información con otras señales de otras sensillas .
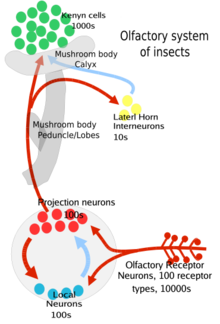
Estos ORN son bipolares, en un extremo están las dendritas olfativas con los receptores de los olores y en el otro extremo están los axones que llevan el potencial de acción al lóbulo antenal del cerebro. [3] Los lóbulos antenales tienen dos tipos de neuronas, neuronas de proyección (en su mayoría excitadoras) y neuronas locales (inhibitorias, con algunas excitadoras). Las neuronas de proyección envían sus terminales axónicos a una parte del cerebro del insecto llamada cuerpos de hongo (importantes para regular las respuestas a olores aprendidas) y a otra parte del cerebro llamada cuerno lateral (importante para regular las respuestas a olores innatos [3] ). Ambas regiones son parte del protocerebro del cerebro del insecto.
Los registros del potencial de acción se realizan de tres formas diferentes: electroantenogramas, electropalpogramas y registros sensillum únicos (SSR). [5] En electroantenogramas (EAG) y electropalpogramas (EPG), se registran los potenciales de acción de toda la antena o palpo maxilar, respectivamente. Los EAG y EPG proporcionan una visión general del olfato en el órgano respectivo. [5] Durante una SSR, se inserta un electrodo en un solo sensillum y el registro se realiza solo a partir de los ORN que están contenidos dentro de ese sensillum, lo que proporciona información más detallada [5] .
Cualquiera de estos métodos se puede combinar con una cromatografía de gases de alta resolución para aislar compuestos volátiles de animales o hábitats importantes. [5] Por ejemplo, este método podría usarse para determinar qué compuesto de una flor en particular es el más atractivo para una abeja. Los registros de las neuronas de proyección muestran que en algunos insectos existe una fuerte especialización y discriminación de los olores presentados por los ORN. Esto es especialmente cierto para las neuronas de proyección de los macroglomérulos, un complejo especializado de glomérulos responsable de la detección de feromonas.
Los seres humanos explotan el sistema olfativo de los insectos para controlar las plagas agrícolas y portadoras de enfermedades. [3] Para algunas plagas agrícolas, las feromonas sexuales fabricadas se colocan en trampas para capturar a los adultos antes de que puedan ovipositar (poner huevos), lo que lleva a la eclosión de sus destructivas larvas. [3] Si bien hay miles de sustancias químicas que los insectos pueden detectar, existe un rango limitado que los insectos utilizan como señales para acercarse o alejarse de la fuente del olor. [5]
El arte de encontrar un atrayente o repelente para un insecto de interés particular es complicado y un proceso largo e intensivo. Por ejemplo, el uso de feromonas sólo atrae a los insectos en su etapa reproductiva, un período corto de su vida. [2] Si bien los olores de los alimentos pueden ser atractivos para los insectos hambrientos, no serían efectivos en un campo lleno de una cosecha que sea apetecible para ese insecto. [2]
Los insectos utilizan la misma señal para muchos usos diferentes dependiendo de la situación, esto se llama parsimonia química. [5] Las situaciones que pueden cambiar el comportamiento de un insecto en reacción a un olor son cosas como la concentración del compuesto, la etapa de vida del insecto, su estado de apareamiento, otras señales olfativas, el estado de alimentación del insecto (hambriento o lleno), la hora del día, o incluso la posición del cuerpo del insecto. [2] [3] [5] Por ejemplo, las Drosophila se sienten muy atraídas por el vinagre de sidra de manzana, pero en concentraciones muy altas se activa un receptor olfativo adicional (que tiene baja afinidad por el vinagre, Or85a), lo que cambia el comportamiento de la mosca de atracción a aversión. [3] Estos diferentes comportamientos ante la misma señal se denomina plasticidad conductual. [2]
Muchos insectos son capaces de detectar cambios muy pequeños en la concentración de CO 2 . [5] Si bien se ha descubierto que el CO 2 es un atrayente en todos los artrópodos estudiados [5] y es muy importante en el seguimiento y control de los mosquitos, incluso esta reacción estereotipada puede ser plástica. Drosophila evita el CO 2 cuando camina pero avanza hacia él cuando vuela. [3]
Se ha demostrado que muchos insectos (y otros artrópodos) evitan áreas que contienen N,N-dietil-3-metilbenzamida o DEET . Evitan de forma innata el DEET, probablemente porque es un "confundente" que estimula los receptores gustativos, ionotrópicos y olfativos y "distorsiona" la interacción de otros olores con esos receptores. [3]