La daptomicina , vendida bajo la marca Cubicin , entre otras, es un antibiótico lipopéptido utilizado en el tratamiento de infecciones sistémicas y potencialmente mortales causadas por organismos grampositivos . [4]
La daptomicina se eliminó de la Lista de medicamentos esenciales de la Organización Mundial de la Salud en 2019. [7] [8] La Organización Mundial de la Salud clasifica la daptomicina como de importancia crítica para la medicina humana. [9]
En los Estados Unidos, la daptomicina está indicada para su uso en adultos para infecciones de la piel y de las estructuras cutáneas causadas por infecciones por grampositivos, bacteriemia por S. aureus y endocarditis por S. aureus del lado derecho . [4] Se une ávidamente al surfactante pulmonar , por lo que no puede usarse en el tratamiento de la neumonía. [10] Parece haber una diferencia en el funcionamiento de la daptomicina en la neumonía hematógena. [11]
Las reacciones adversas comunes a los medicamentos asociadas con la terapia con daptomicina incluyen: [4] [12]
Los eventos adversos menos comunes, pero graves informados en la literatura incluyen
Además, se han informado miopatía y rabdomiólisis en pacientes que toman estatinas simultáneamente , [15] pero se desconoce si esto se debe exclusivamente a la estatina o si la daptomicina potencia este efecto. Debido a los datos limitados disponibles, el fabricante recomienda suspender temporalmente las estatinas mientras el paciente recibe tratamiento con daptomicina. Los niveles de creatina quinasa generalmente se controlan periódicamente mientras los individuos reciben tratamiento con daptomicina. [ cita necesaria ]
En julio de 2010, la FDA emitió una advertencia de que la daptomicina podría causar neumonía eosinofílica potencialmente mortal . La FDA dijo que había identificado siete casos confirmados de neumonía eosinofílica entre 2004 y 2010 y 36 casos posibles adicionales. Los siete casos confirmados eran todos mayores de 60 años y los síntomas aparecieron dos semanas después del inicio de la terapia. [ cita necesaria ]
La daptomicina tiene un mecanismo de acción distinto, que altera múltiples aspectos de la función de la membrana celular bacteriana . Se inserta en la membrana celular de forma dependiente del fosfatidilglicerol , donde luego se agrega. La agregación de daptomicina altera la curvatura de la membrana, lo que crea agujeros por los que se escapan iones. Esto provoca una despolarización rápida , lo que resulta en una pérdida del potencial de membrana que conduce a la inhibición de la síntesis de proteínas , ADN y ARN , lo que resulta en la muerte de las células bacterianas. [dieciséis]
Se ha propuesto que la formación de micelas esféricas [17] por la daptomicina puede afectar el modo de acción.
La daptomicina es bactericida únicamente contra bacterias Gram positivas. Ha demostrado actividad in vitro contra enterococos (incluidos enterococos resistentes a glicopéptidos (GRE)), estafilococos (incluido Staphylococcus aureus resistente a meticilina ), estreptococos , [18] corinebacterias y Borrelia burgdorferi persistente en fase estacionaria . [19]
La resistencia a la daptomicina aún es poco común, [ ¿cuándo? ] pero se ha informado cada vez más en GRE, comenzando en Corea en 2005, en Europa en 2010, en Taiwán en 2011 y en los Estados Unidos, donde se notificaron nueve casos entre 2007 y 2011. [20] La resistencia a la daptomicina surgió en cinco de los seis casos mientras eran tratados. Se desconoce el mecanismo de resistencia. Se descubrió que una cepa de Paenibacillus de cuatro millones de años aislada de muestras de suelo en la cueva de Lechuguilla era naturalmente resistente a la daptomicina. [21]
Se ha sugerido que la administración conjunta de daptomicina con al menos otro antibiótico activo podría ayudar a prevenir la aparición de resistencias y aumentar el efecto bactericida. [22] Los datos de estudios in vitro e in vivo sugieren que se debe utilizar un enfoque personalizado teniendo en cuenta tanto el agente causal como el sitio de la infección. [23]
Se ha demostrado que la daptomicina no es inferior a las terapias estándar ( nafcilina , oxacilina , flucloxacilina o vancomicina ) en el tratamiento de la bacteriemia y la endocarditis derecha causada por S. aureus . [24] Un estudio realizado en Detroit, Michigan, comparó 53 pacientes tratados por sospecha de infección de la piel o tejidos blandos por MRSA con daptomicina versus vancomicina, y mostró una recuperación más rápida (4 versus 7 días) con daptomicina. [25]
En los ensayos clínicos de fase III, datos limitados mostraron que la daptomicina se asocia con malos resultados en pacientes con endocarditis del lado izquierdo. [ cita necesaria ] La daptomicina no se ha estudiado en pacientes con endocarditis o meningitis de válvula protésica . [26]

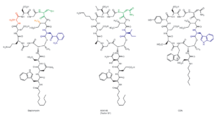

La daptomicina es un antibiótico lipopéptido cíclico producido por Streptomyces filamentosus . [28] [29] La daptomicina consta de 13 aminoácidos, 10 de los cuales están dispuestos de forma cíclica y tres en una cola exocíclica. En el fármaco existen dos aminoácidos no proteinógenos, el inusual aminoácido L-quinurenina (Kyn), conocido sólo por la daptomicina, y el ácido L-3-metilglutámico (mGlu). El extremo N del residuo de triptófano exocíclico está acoplado al ácido decanoico, un ácido graso de cadena media (C10). La biosíntesis se inicia mediante el acoplamiento del ácido decanoico al triptófano N-terminal , seguido del acoplamiento de los aminoácidos restantes mediante mecanismos de péptido sintetasa no ribosomal (NRPS). Finalmente, se produce un evento de ciclación, que es catalizado por una enzima tioesterasa, y se garantiza la posterior liberación del lipopéptido. [ cita necesaria ]
El NRPS responsable de la síntesis de daptomicina está codificado por tres genes superpuestos , dptA, dptBC y dptD . Es probable que los genes dptE y dptF , inmediatamente aguas arriba de dptA , estén involucrados en el inicio de la biosíntesis de daptomicina mediante el acoplamiento del ácido decanoico al Trp N-terminal. [30] Estos nuevos genes (dptE, dptF) corresponden a productos que probablemente funcionan junto con un dominio de condensación único para acilar el primer aminoácido (triptófano). Se cree que estos y otros genes nuevos ( dptI, dptJ ) participan en el suministro de los aminoácidos no proteinógenos ácido L-3-metilglutámico y Kyn; están ubicados al lado de los genes NRPS. [30]
La porción de ácido decanoico de la daptomicina se sintetiza mediante la maquinaria de la ácido graso sintasa (Figura 2). La modificación postraduccional de la proteína portadora de apoacilo (ACP, tiolación o dominio T) por una enzima fosfopanteteiniltransferasa (PPTasa) cataliza la transferencia de un brazo flexible de fosfopanteteína de la coenzima A a una serina conservada en el dominio ACP a través de un enlace fosfodiéster. . El holo-ACP puede proporcionar un tiol sobre el cual el sustrato y las cadenas de acilo se unen covalentemente durante los alargamientos de cadena. Los dos dominios catalíticos centrales son una aciltransferasa (AT) y una cetosintasa (KS). La AT actúa sobre un sustrato malonil-CoA y transfiere un grupo acilo al tiol del dominio ACP. Esta transtiolación neta es un paso energéticamente neutro. A continuación, el acil-S-ACP se transtiola a una cisteína conservada en el KS; el KS descarboxila el malonil-S-ACP aguas abajo y forma un β-cetoacil-S-ACP. Esto sirve como sustrato para el siguiente ciclo de elongación. Sin embargo, antes de que comience el siguiente ciclo, el grupo β-ceto se reduce al alcohol correspondiente catalizado por un dominio cetorreductasa, seguido de deshidratación a la olefina catalizada por un dominio deshidratasa y, finalmente, reducción al metileno catalizada por un dominio enoilreductasa. Cada ciclo catalítico KS da como resultado la adición neta de dos carbonos. Después de tres iteraciones más de elongación, una enzima tioesterasa cataliza la hidrólisis y, por tanto, la liberación del ácido graso C-10 libre. [ cita médica necesaria ]
Para sintetizar la porción peptídica de la daptomicina, se emplea el mecanismo de un NRPS. La maquinaria biosintética de un sistema NRPS está compuesta por líneas de ensamblaje enzimático multimodulares que contienen un módulo por cada monómero de aminoácido incorporado. [31] Dentro de cada módulo hay dominios catalíticos que llevan a cabo el alargamiento de la cadena peptidilo en crecimiento. El péptido en crecimiento está unido covalentemente a un dominio de tiolación; aquí se denomina proteína transportadora de peptidilo, ya que transporta el péptido en crecimiento de un dominio catalítico al siguiente. Nuevamente, el dominio apo-T debe ser preparado para el dominio holo-T mediante una PPTasa, uniendo un brazo flexible de fosfopanteteína a un residuo de serina conservado. Un dominio de adenilación selecciona el monómero de aminoácido que se incorporará y activa el carboxilato con ATP para producir el aminoacil-AMP. A continuación, el dominio A instala un grupo aminoacilo en el tiolato del dominio T adyacente. El dominio de condensación (C) cataliza la reacción de formación del enlace peptídico, que provoca el alargamiento de la cadena. Une un peptidil-ST aguas arriba al aminoacil-ST aguas abajo (Figura 7). El alargamiento de la cadena por un residuo aminoacilo y la translocación de la cadena al siguiente dominio T ocurren simultáneamente. El orden de estos dominios es CAT. En algunos casos, es necesario un dominio de epimerización en aquellos módulos en los que se van a incorporar y epimerizar monómeros de L-aminoácidos a D-aminoácidos. La organización del dominio en dichos módulos es CATE. [31]
El primer módulo tiene una organización CAT de tres dominios; Estos ocurren a menudo en líneas de ensamblaje que producen péptidos N-acilados. [31] El primer dominio C cataliza la N-acilación del aminoácido iniciador (triptófano) mientras está instalado en T. Una enzima adenilante (Ad) cataliza la condensación del ácido decanoico y el triptófano N-terminal, que incorpora el ácido decanoico en el péptido en crecimiento (Figura 3). Los genes responsables de este evento de acoplamiento son dptE y dptF, que se encuentran aguas arriba de dptA, el primer gen del grupo de genes biosintéticos de daptomicina NRPS. Una vez que se produce el acoplamiento del ácido decanoico al residuo de triptófano N-terminal, comienza la condensación de aminoácidos, catalizada por el NRPS. [ cita médica necesaria ]
Los primeros cinco módulos del NRPS están codificados por el gen dptA y catalizan la condensación de L-triptófano, D-asparagina, L-aspartato, L-treonina y glicina, respectivamente (Figura 4). Los módulos 6 a 11, que catalizan la condensación de L-ornitina, L-aspartato, D-alanina, L-aspartato, glicina y D-serina, están codificados para el gen dptBC (Figura 5). dptD cataliza la incorporación de dos aminoácidos no proteinógenos, el ácido L-3-metilglutámico (mGlu) y Kyn, que hasta ahora solo se conoce como daptomicina, en el péptido en crecimiento (Figura 6). [29] El alargamiento por estos módulos NRPS finalmente conduce a la macrociclación y liberación en la que un grupo α-amino, a saber, treonina, actúa como un nucleófilo interno durante la ciclación para producir el anillo de 10 aminoácidos (Figura 6). El módulo de terminación en la línea de montaje NRPS tiene una organización CAT-TE. El dominio tioesterasa cataliza la terminación de la cadena y la liberación del lipopéptido maduro. [31]
La ingeniería molecular de la daptomicina, el único antibiótico lipopéptido ácido comercializado hasta la fecha (Figura 8), ha experimentado muchos avances desde su introducción en la medicina clínica en 2003. [32] Es un objetivo atractivo para la biosíntesis combinatoria por muchas razones: derivados de segunda generación actualmente se encuentran en la clínica para su desarrollo; [33] Streptomyces roseosporus , el organismo productor de daptomicina, es susceptible de manipulación genética; [34] el grupo de genes biosintéticos de daptomicina ha sido clonado, secuenciado y expresado en S. lividans ; [33] la maquinaria biosintética de lipopéptidos tiene el potencial de ser interrumpida por variaciones de precursores naturales, así como por biosíntesis dirigida por precursores, eliminación de genes, intercambio genético e intercambio de módulos; [34] las herramientas de ingeniería molecular se han desarrollado para facilitar la expresión de los tres genes NRPS individuales de tres sitios diferentes en el cromosoma, utilizando ermEp* para la expresión de dos genes de loci ectópicos; [35] se han clonado y secuenciado otros grupos de genes de lipopéptidos, tanto relacionados como no relacionados con la daptomicina, [27] proporcionando así genes y módulos que permiten la generación de moléculas híbridas; [34] los derivados pueden obtenerse mediante síntesis quimioenzimática; [36] y, por último, los esfuerzos en química medicinal pueden modificar aún más estos productos de ingeniería molecular. [33]
Los nuevos derivados de daptomicina (Figura 9) se generaron originalmente intercambiando la tercera subunidad NRPS ( dptD ) con las subunidades terminales del A54145 (Factor B1) o vías de antibióticos dependientes de calcio para crear moléculas que contienen Trp13, Ile13 o Val13. [37] dptD es responsable de incorporar el penúltimo aminoácido, el ácido 3-metil-glutámico (3mGlu12), y el último aminoácido, Kyn13, a la cadena. Este intercambio se logró sin diseñar los sitios de acoplamiento de interpéptidos. Estos intercambios de subunidades completas se han combinado con la eliminación del gen Glu12-metiltransferasa, con intercambios de módulos en sitios de enlace intradominio en Ala8 y Ser11, y con variaciones de cadenas laterales de ácidos grasos naturales para generar más de 70 nuevos lipopéptidos en cantidades significativas; la mayoría de estos lipopéptidos resultantes tienen potentes actividades antibacterianas. [27] [37] Algunos de estos compuestos tienen actividades antibacterianas in vitro análogas a la daptomicina. Además, uno mostró una actividad mejorada contra un mutante imp de E. coli que tenía una capacidad defectuosa para ensamblar su lipopolisacárido inherente. Varios de estos compuestos se produjeron con rendimientos que oscilaban entre 100 y 250 mg/litro; Esto, por supuesto, abre la posibilidad de realizar ampliaciones exitosas mediante técnicas de fermentación. Hasta ahora sólo se ha investigado un pequeño porcentaje de las posibles combinaciones de aminoácidos dentro del núcleo peptídico. [38]
La daptomicina, originalmente designada como LY 146032, fue descubierta por investigadores de Eli Lilly and Company a finales de la década de 1980 a partir del actinomiceto Streptomyces roseosporus . LY 146032 se mostró prometedor en los ensayos clínicos de fase I/II para el tratamiento de infecciones causadas por organismos grampositivos. Lilly detuvo su desarrollo porque la terapia con dosis altas se asoció con efectos adversos sobre el músculo esquelético, incluida la mialgia . [39] [40]
Los derechos de LY 146032 fueron adquiridos por Cubist Pharmaceuticals en 1997, que tras la aprobación de la Administración de Drogas y Alimentos de los EE. UU. (FDA) en septiembre de 2003, para su uso en personas mayores de 18 años, comenzó a comercializar el medicamento con el nombre comercial Cubicin. Novartis comercializa Cubicin en la UE y en varios otros países tras la compra de Chiron Corporation , el anterior licenciatario. [40] [41]