El ácido de Meldrum o 2,2-dimetil-1,3-dioxano-4,6-diona es un compuesto orgánico de fórmula C 6 H 8 O 4 . Su molécula tiene un núcleo heterocíclico con cuatro átomos de carbono y dos de oxígeno ; la fórmula también se puede escribir como [−O−(C(CH 3 ) 2 )−O−(C=O)−(CH 2 )−(C=O)−] .
Es un sólido cristalino incoloro, poco soluble en agua. Se descompone al calentarlo con liberación de dióxido de carbono y acetona . [2] [3]
El compuesto puede perder fácilmente un ion hidrógeno del metileno ( CH 2 ) en el anillo (carbono 5); lo que crea un doble enlace entre éste y uno de los carbonos adyacentes (el número 4 o 6), y una carga negativa en el oxígeno correspondiente. El anión resultante [C 6 H 7 O 4 ] − se estabiliza por resonancia entre las dos alternativas, de modo que el doble enlace se deslocaliza y cada oxígeno en los carbonilos tiene una carga formal de −1/2.

La constante de ionización p K a es 4,97; lo que hace que se comporte como un ácido monobásico aunque no contenga grupos ácido carboxílico . [2] En esta y otras propiedades, el compuesto se parece a la dimedona y al ácido barbitúrico . Sin embargo, mientras que la dimedona existe en solución predominantemente como tautómero monoenol , el ácido de Meldrum se presenta casi en su totalidad como forma dicetona . [2]
La acidez inusualmente alta de este compuesto se consideró anómala durante mucho tiempo: es 8 órdenes de magnitud más ácido que el compuesto estrechamente relacionado malonato de dimetilo . En 2004, Ohwada y sus compañeros determinaron que la estructura de conformación del compuesto que minimiza la energía coloca el orbital σ* CH del protón alfa en la geometría adecuada para alinearse con el π * CO , de modo que el estado fundamental plantea una desestabilización inusualmente fuerte del enlace CH. . [4]
El compuesto fue elaborado por primera vez por Meldrum mediante una reacción de condensación de acetona con ácido malónico en anhídrido acético y ácido sulfúrico . [3]

Como alternativa a su preparación original, el ácido de Meldrum se puede sintetizar a partir de ácido malónico, acetato de isopropenilo (un derivado enólico de la acetona) y ácido sulfúrico catalítico.
Una tercera ruta es la reacción del subóxido de carbono C 3 O 2 con acetona en presencia de ácido oxálico . [2]
Al igual que el ácido malónico y sus derivados éster, y otros compuestos 1,3-dicarbonilo , el ácido de Meldrum puede servir como reactivo para una variedad de reacciones nucleofílicas .
La acidez del carbono 5 (entre los dos grupos carbonilo) permite una derivatización simple del ácido de Meldrum en esta posición, mediante reacciones como la alquilación y la acilación . Por ejemplo, la desprotonación y la reacción con un haluro de alquilo simple ( R−Cl ) une el grupo alquilo ( R− ) en esa posición:
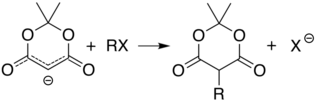
La reacción análoga con un cloruro de acilo ( R-(C=O)-Cl ) une el acilo ( R-(C=O)- ) en su lugar:
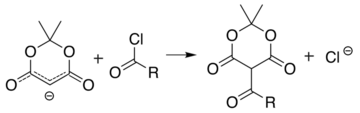
Estas dos reacciones permiten que el ácido de Meldrum sirva como plataforma inicial para la síntesis de muchas estructuras diferentes con varios grupos funcionales. Los productos alquilados pueden manipularse adicionalmente para producir diversos compuestos de amida y éster. Calentar el producto acilo en presencia de un alcohol conduce al intercambio de éster y a la descarboxilación en un proceso similar a la síntesis de éster malónico . La naturaleza reactiva del diéster cíclico permite una buena reactividad incluso para alcoholes tan impedidos como el t -butanol , [5] y esta reactividad del ácido de Meldrum y sus derivados se ha utilizado para desarrollar una variedad de reacciones. [6] [7] [8] [9] Los cetoésteres formados a partir de la reacción de alcoholes con derivados ácidos de Meldrum son útiles en la síntesis de pirrol de Knorr .
A temperaturas superiores a 200 °C [10] el ácido de Meldrum sufre una reacción pericíclica que libera acetona y dióxido de carbono y produce un compuesto ceteno altamente reactivo : [11]

Estas cetenas se pueden aislar mediante pirólisis instantánea al vacío (FVP). Los cetenos son altamente electrófilos y pueden sufrir reacciones de adición con una variedad de otras sustancias químicas, particularmente cicloadiciones de ceteno o dimerización a diceteno . Con este enfoque es posible formar nuevos enlaces C-C, anillos, amidas , ésteres y ácidos:
Alternativamente, la pirólisis se puede realizar en solución, para obtener los mismos resultados sin aislar la cetena, en una reacción en un solo recipiente . La capacidad de formar productos tan diversos hace que el ácido de Meldrum sea un reactivo muy útil para los químicos sintéticos. [12] [13] [14]

El compuesto lleva el nombre de Andrew Norman Meldrum , quien informó sobre su síntesis en 1908. [3] Identificó erróneamente su estructura como una β- lactona del ácido β-hidroxiisopropilmalónico; La estructura correcta, la bislactona de 1,3-dioxano, se informó en 1948. [15]