La síntesis de pirrol de Knorr es una reacción química ampliamente utilizada que sintetiza pirroles sustituidos (3) . [1] [2] [3] El método implica la reacción de una α- aminocetona ( 1) y un compuesto que contiene un grupo aceptor de electrones (por ejemplo, un éster como se muestra) α con un grupo carbonilo (2) . [4]

El mecanismo requiere zinc y ácido acético como catalizadores. Se procederá a temperatura ambiente. Debido a que las α-aminocetonas se autocondensan muy fácilmente, deben prepararse in situ . La forma habitual de hacerlo es a partir de la oxima correspondiente , mediante el reordenamiento de Neber . [5] [6]
La síntesis original de Knorr empleó dos equivalentes de acetoacetato de etilo , uno de los cuales se convirtió en 2-oximinoacetoacetato de etilo disolviéndolo en ácido acético glacial y agregando lentamente un equivalente de nitrito de sodio acuoso saturado , bajo enfriamiento externo. Luego se agitó polvo de zinc , reduciendo el grupo oxima a amina. Esta reducción consume dos equivalentes de zinc y cuatro equivalentes de ácido acético.
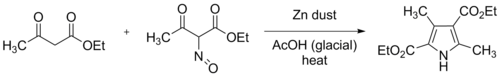
La práctica moderna consiste en añadir gradualmente la solución de oxima resultante de la nitrosación y el polvo de zinc a una solución bien agitada de acetoacetato de etilo en ácido acético glacial. La reacción es exotérmica y la mezcla puede alcanzar el punto de ebullición si no se aplica enfriamiento externo. El producto resultante, 3,5-dimetilpirrol-2,4-dicarboxilato de dietilo, se llama desde entonces pirrol de Knorr . En el esquema anterior, R 2 = COOEt y R 1 = R 3 = Me representan esta reacción original.
El pirrol de Knorr se puede derivatizar de varias maneras útiles. Un equivalente de hidróxido de sodio saponificará selectivamente el 2-éster. Disolver el pirrol de Knorr en ácido sulfúrico concentrado y luego verter la solución resultante en agua hidrolizará selectivamente el grupo 4-éster. El grupo 5-metilo se puede oxidar de diversas formas a clorometilo, aldehído o ácido carboxílico mediante el uso de cloruro de sulfurilo estequiométrico en ácido acético glacial. [7] Alternativamente, el átomo de nitrógeno se puede alquilar. Las dos posiciones de éster se pueden diferenciar más suavemente incorporando grupos bencilo o terc -butilo a través de los correspondientes ésteres de acetoacetato. Los grupos bencilo se pueden eliminar mediante hidrogenólisis catalítica sobre paladio sobre carbono , y los grupos terc-butilo se pueden eliminar mediante tratamiento con ácido trifluoroacético o ácido acético acuoso hirviendo. R 1 y R 3 (así como R 2 y "Et") pueden variarse mediante la aplicación de β-cetoésteres apropiados, que se obtienen fácilmente mediante una síntesis que emana de cloruros de ácido , ácido de Meldrum y el alcohol de su elección. De este modo se obtienen fácilmente ésteres etílicos y bencílicos, y la reacción es digna de mención porque incluso el alcohol terc -butílico altamente impedido da rendimientos muy altos en esta síntesis. [8]
Levi y Zanetti ampliaron la síntesis de Knorr en 1894 al uso de acetilacetona (2,4-pentanodiona) en reacción con 2-oximinoacetoacetato de etilo. El resultado fue 4-acetil-3,5-dimetilpirrol-2-carboxilato de etilo, donde "OEt" = R1 = R3 = Me, y R2 = COOEt. [9] El grupo 4-acetilo podría convertirse fácilmente en un grupo 4-etilo mediante reducción de Wolff-Kishner (hidrazina y álcali, calentado); hidrogenólisis, o el uso de diborano . Los acetoacetatos de bencilo o terc -butilo también funcionan bien en este sistema y, con un estricto control de la temperatura, el sistema de terc -butilo proporciona un rendimiento muy alto (cerca del 80%). [10] Las N , N -dialquilpirrol-2- y/o 4-carboxamidas se pueden preparar mediante el uso de N , N -dialquilacetoacetamidas en la síntesis. Con este método también se han preparado con éxito tioésteres. [11] En cuanto a la nitrosación de β-cetoésteres, a pesar de las numerosas especificaciones bibliográficas sobre un estricto control de la temperatura en la nitrosación, la reacción se comporta casi como una titulación, y se puede permitir que la mezcla alcance incluso los 40 °C sin afectar significativamente el resultado final. producir.
El mecanismo de síntesis del pirrol de Knorr comienza con la condensación de la amina y la cetona para dar una imina. Luego, la imina se tautomeriza a una enamina, seguida de ciclación, eliminación de agua e isomerización al pirrol.

Hay una serie de síntesis importantes de pirroles que funcionan a la manera de la síntesis de Knorr, a pesar de tener mecanismos de conectividad muy diferente entre los materiales de partida y el producto pirrólico.
Hans Fischer y Emmy Fink descubrieron que la síntesis de Zanetti a partir de 2,4-pentanodiona y 2-oximinoacetoacetato de etilo daba 3,5-dimetilpirrol-2-carboxilato de etilo como un subproducto traza. De manera similar, el dietilacetal de 3-cetobutiraldehído condujo a la formación de 5-metilpirrol-2-carboxilato de etilo. Ambos productos resultaron de la pérdida del grupo acetilo del intermedio 2-aminoacetoacetato de etilo inferido. Un producto importante de la síntesis de Fischer-Fink fue el 4,5-dimetilpirrol-2-carboxilato de etilo, elaborado a partir de 2-oximinoacetoacetato de etilo y 2-metil-3-oxobutal, obtenido a su vez mediante la condensación de Claisen de 2-butanona con formiato de etilo. . [12]
George Kleinspehn informó que la conectividad Fischer-Fink podría forzarse a ocurrir exclusivamente, mediante el uso de oximinomalonato de dietilo en la síntesis, con 2,4-pentanodiona o sus derivados 3-alquil sustituidos. Los rendimientos fueron elevados, alrededor del 60%, y esta síntesis acabó convirtiéndose en una de las más importantes del repertorio. [13] Los rendimientos mejoraron significativamente mediante el uso de aminomalonato de dietilo preformado (preparado mediante hidrogenolisis de oximinomalonato de dietilo en etanol, sobre Pd/C) y la adición de una mezcla de aminomalonato de dietilo y la β-dicetona al ácido acético glacial en ebullición activa. . [14]
Mientras tanto, Johnson había ampliado la síntesis de Fischer-Fink haciendo reaccionar ésteres de 2-oximinoacetoacetato (etilo, bencilo o butilo terciario) con 2,4-pentanodionas sustituidas con 3-alquilo. [15] La síntesis de Kleinspehn se amplió bajo David Dolphin mediante el uso de β-dicetonas asimétricas (como las 2,4-hexanodionas sustituidas con 3-alquilo), que reaccionaban preferentemente inicialmente en el grupo acetilo menos impedido y proporcionaban el correspondiente 5-metilpirrol. -Ésteres de 2-carboxilato. También se encontró que las N , N -Dialquil 2-oximinoacetoacetamidas daban pirroles cuando reaccionaban en condiciones de Knorr con 2,4-pentanodionas 3-sustituidas, con rendimientos comparables a los ésteres correspondientes (alrededor del 45%). Sin embargo, cuando se usaron dicetonas asimétricas, se encontró que el grupo acetilo de la acetoacetamida se retenía en el producto y uno de los grupos acilo de la dicetona se había perdido. [16] Este mismo mecanismo ocurre en menor medida en los sistemas de éster de acetoacetato, y Harbuck y Rapoport lo habían detectado radioquímicamente previamente . [17] La mayoría de las síntesis descritas anteriormente tienen aplicación en la síntesis de porfirinas, pigmentos biliares y dipirrinas.