La leishmaniasis es una amplia gama de manifestaciones clínicas causadas por parásitos protozoarios del género Trypanosomatida Leishmania . [7] Generalmente se transmite a través de la picadura de flebótomos , Phlebotomus y Lutzomyia , y ocurre con mayor frecuencia en los trópicos y subtrópicos de África, Asia, América y el sur de Europa. [ 2] [8] La enfermedad puede presentarse de tres formas principales: cutánea , mucocutánea o visceral . [2] La forma cutánea se presenta con úlceras en la piel, mientras que la forma mucocutánea se presenta con úlceras en la piel, la boca y la nariz. La forma visceral comienza con úlceras en la piel y luego se presenta con fiebre, recuento bajo de glóbulos rojos y agrandamiento del bazo y el hígado. [2] [3]
Las infecciones en humanos son causadas por más de 20 especies de Leishmania . [8] [2] Los factores de riesgo incluyen pobreza , desnutrición , deforestación y urbanización . [2] Los tres tipos pueden diagnosticarse observando los parásitos bajo microscopio. [2] Además, la enfermedad visceral puede diagnosticarse mediante análisis de sangre. [3]
La leishmaniasis se puede prevenir en parte durmiendo bajo mosquiteros tratados con insecticidas . [2] Otras medidas incluyen rociar insecticidas para matar a los flebótomos y tratar a las personas con la enfermedad de forma temprana para evitar una mayor propagación. [2] El tratamiento necesario se determina según el lugar donde se adquiere la enfermedad, la especie de Leishmania y el tipo de infección. [2] Algunos medicamentos posibles utilizados para la enfermedad visceral incluyen anfotericina B liposomal , [9] una combinación de antimoniales pentavalentes y paromomicina , [9] y miltefosina . [10] Para la enfermedad cutánea, la paromomicina, el fluconazol o la pentamidina pueden ser eficaces. [11]
En la actualidad, entre 4 y 12 millones de personas están infectadas [4] [5] en unos 98 países. [3] Cada año se producen alrededor de 2 millones de casos nuevos [3] y entre 20 y 50 mil muertes. [2] [12] Alrededor de 200 millones de personas en Asia, África, América del Sur y Central y el sur de Europa viven en zonas donde la enfermedad es común. [3] [13] La Organización Mundial de la Salud ha obtenido descuentos en algunos medicamentos para tratar la enfermedad. [3] Está clasificada como una enfermedad tropical desatendida . [14] La enfermedad puede presentarse en varios otros animales, incluidos perros y roedores . [2]

Los síntomas de la leishmaniasis son llagas en la piel que aparecen semanas o meses después de que la persona es picada por flebótomos infectados.
La leishmaniasis se puede dividir en los siguientes tipos: [15]
La leishmaniasis se considera una de las causas clásicas de un bazo notablemente agrandado (y por lo tanto palpable) ; el órgano, que normalmente no se palpa durante el examen del abdomen, puede incluso llegar a ser más grande que el hígado en casos graves. [ cita requerida ]

La leishmaniasis se transmite por la picadura de flebótomos hembra infectados [ 2] que pueden transmitir el protozoo Leishmania . [2] Los flebótomos inyectan la fase infecciosa, promastigotes metacíclicos, durante las comidas de sangre. Los promastigotes metacíclicos en la herida punzante son fagocitados por macrófagos y se transforman en amastigotes . Los amastigotes se multiplican en las células infectadas y afectan a diferentes tejidos, dependiendo en parte del huésped y en parte de qué especie de Leishmania esté involucrada. Estas diferentes especificidades tisulares causan las diferentes manifestaciones clínicas de las diversas formas de leishmaniasis. Los flebótomos se infectan durante las comidas de sangre en huéspedes infectados cuando ingieren macrófagos infectados con amastigotes. En el intestino medio del flebótomo, los parásitos se diferencian en promastigotes, que se multiplican, se diferencian en promastigotes metacíclicos y migran a la probóscide.
Se han secuenciado los genomas de tres especies de Leishmania ( L. major , L. infantum y L. braziliensis ), lo que ha proporcionado mucha información sobre la biología del parásito . Por ejemplo, en Leishmania , se entiende que los genes codificadores de proteínas están organizados como grandes unidades policistrónicas de manera cabeza con cabeza o cola con cola; la ARN polimerasa II transcribe mensajes policistrónicos largos en ausencia de promotores de ARN polimerasa II definidos, y Leishmania tiene características únicas con respecto a la regulación de la expresión génica en respuesta a cambios en el medio ambiente. El nuevo conocimiento de estos estudios puede ayudar a identificar nuevos objetivos para medicamentos que se necesitan con urgencia y ayudar al desarrollo de vacunas. [16]
Aunque la mayor parte de la literatura menciona solo un género que transmite Leishmania a los humanos ( Lutzomyia ) en el Nuevo Mundo, un estudio de 2003 realizado por Galati sugirió una nueva clasificación para los flebótomos del Nuevo Mundo, elevando varios subgéneros al nivel de género. En otras partes del mundo, el género Phlebotomus se considera el vector de la leishmaniasis. [16]
Se han observado algunos casos de infección de animales no humanos por especies de Leishmania que infectan a los humanos. En un estudio, se identificó L. major en doce de noventa y una muestras fecales de gorilas occidentales de las tierras bajas salvajes [17] y en un estudio de cincuenta y dos primates no humanos cautivos en un zoológico en un área endémica de leishmaniasis, se encontró que ocho (los tres chimpancés , tres tamarinos león dorado , un mono capuchino y un talapoín angoleño ) estaban infectados con L. infantum y eran capaces de infectar a los flebótomos Lutzomyia longipalpis , aunque "las cargas parasitarias en los flebótomos infectados observados en este estudio se consideraron bajas". [18]
La enfermedad visceral suele ser causada por Leishmania donovani , L. infantum o L. chagasi , [3] pero ocasionalmente estas especies pueden causar otras formas de enfermedad. [3] La forma cutánea de la enfermedad es causada por más de 15 especies de Leishmania . [3]
Los factores de riesgo incluyen la desnutrición, la deforestación, la falta de saneamiento, el sistema inmunológico debilitado y la urbanización. [2]

La leishmaniasis se diagnostica en el laboratorio de hematología mediante la visualización directa de los amastigotes (cuerpos de Leishman-Donovan). Las preparaciones de capa leucocítica de sangre periférica o aspirados de médula ósea, bazo, ganglios linfáticos o lesiones cutáneas deben extenderse en un portaobjetos para hacer un frotis fino y teñirse con tinción de Leishman o tinción de Giemsa ( pH 7,2) durante 20 minutos. Los amastigotes se observan dentro de los monocitos de la sangre y el bazo o, con menor frecuencia, en los neutrófilos circulantes y en los macrófagos tisulares aspirados. Son cuerpos pequeños y redondos de 2 a 4 μm de diámetro con citoplasma indistinto, un núcleo y un pequeño cinetoplasto en forma de bastón . Ocasionalmente, se pueden ver amastigotes sueltos entre las células. [19] Sin embargo, la recuperación de muestras de tejido a menudo es dolorosa para el paciente y la identificación de las células infectadas puede ser difícil. Por ello, se han desarrollado otros métodos de diagnóstico inmunológico indirecto, como el ensayo inmunoabsorbente ligado a enzimas, las tiras reactivas recubiertas de antígeno y la prueba de aglutinación directa. Aunque estas pruebas están fácilmente disponibles, no son las pruebas diagnósticas estándar debido a su sensibilidad y especificidad insuficientes [ cita requerida ] .
Existen varias pruebas de reacción en cadena de la polimerasa (PCR) diferentes para la detección del ADN de Leishmania . [3] Con este ensayo, finalmente es posible un procedimiento de diagnóstico específico y sensible. Las pruebas de PCR más sensibles utilizan el ADN del kinetoplasto en minicírculos que se encuentra en el parásito. El ADN del kinetoplasto contiene secuencias de proteínas mitocondriales en sus maxicírculos (~25–50 por parásito) y ARN guía en sus minicírculos (~10.000 por parásito) del kinetoplasto. Con este método específico, se puede detectar Leishmania incluso con una carga parasitaria muy baja. Cuando se necesita diagnosticar una especie específica de Leishmania, en lugar de solo detectarla, otros métodos de PCR han sido superiores. [20]
La mayoría de las formas de la enfermedad se transmiten únicamente a partir de animales no humanos, pero algunas pueden propagarse entre humanos. Las infecciones en humanos son causadas por aproximadamente 21 de las 30 especies que infectan a los mamíferos; [21] las diferentes especies parecen iguales, pero se pueden diferenciar mediante análisis de isoenzimas , análisis de secuencia de ADN o anticuerpos monoclonales .

El tratamiento se determina según el lugar donde se adquiere la enfermedad, la especie de Leishmania y el tipo de infección. [2] Para la leishmaniasis visceral en la India, Sudamérica y el Mediterráneo, la anfotericina B liposomal es el tratamiento recomendado y a menudo se utiliza en una dosis única. [3] [9] Se han informado tasas de curación con una dosis única de anfotericina del 95%. [3] En la India, casi todas las infecciones son resistentes a los antimoniales pentavalentes . [3] En África, se recomienda una combinación de antimoniales pentavalentes y paromomicina. [9] Sin embargo, estos pueden tener efectos secundarios significativos. [3] La miltefosina , un medicamento oral, es eficaz contra la leishmaniasis visceral y cutánea. [10] Los efectos secundarios son generalmente leves, aunque puede causar defectos de nacimiento si se toma dentro de los tres meses posteriores al embarazo. [3] [10] No parece funcionar para L. major o L. braziliensis . [11] Se ha demostrado que el herbicida trifluralina es un tratamiento eficaz en forma de ungüento, sin efectos secundarios hemolíticos ni tóxicos para las células. [24]
La evidencia en torno al tratamiento de la leishmaniasis cutánea es pobre. [3] Se pueden utilizar varios tratamientos tópicos para la leishmaniasis cutánea. Los tratamientos que son efectivos dependen de la cepa, siendo la paromomicina tópica efectiva para L. major , L. tropica , L. mexicana , L. panamensis y L. braziliensis . [11] La pentamidina es efectiva para L. guyanensis . [11] El fluconazol o itraconazol oral parece ser efectivo en L. major y L. tropica . [3] [11] Existe evidencia limitada para apoyar el uso de la terapia de calor en la leishmaniasis cutánea a partir de 2015. [25]
No existen estudios que determinen el efecto de los suplementos nutricionales orales sobre la leishmaniasis visceral tratada con fármacos antileishmaniacos. [26]

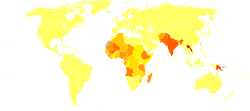
De los 200 países y territorios que informan a la OMS, 97 países y territorios son endémicos de leishmaniasis. [28] Los entornos en los que se encuentra la leishmaniasis varían desde las selvas tropicales de América Central y del Sur hasta los desiertos de Asia occidental y Oriente Medio. Afecta a unas 12 millones de personas en todo el mundo, con 1,5 a 2,0 millones de casos nuevos cada año. [29] La forma visceral de leishmaniasis tiene una incidencia estimada de 500.000 casos nuevos. [30] En 2014, más del 90% de los nuevos casos notificados a la OMS se produjeron en seis países: Brasil, Etiopía, India, Somalia, Sudán del Sur y Sudán. [31] En 2010, [actualizar]causó alrededor de 52.000 muertes, frente a las 87.000 de 1990. [12] Existen diferentes tipos de la enfermedad en diferentes regiones del mundo. [2] La enfermedad cutánea es más común en Afganistán, Argelia, Brasil, Colombia e Irán, mientras que la enfermedad mucocutánea es más común en Bolivia, Brasil y Perú, y la enfermedad visceral es más común en Bangladesh, Brasil, Etiopía, India y Sudán. [2]
La leishmaniasis se encuentra en gran parte de las Américas desde el norte de Argentina hasta el sur de Texas , aunque no en Uruguay o Chile , y recientemente se ha demostrado que se está extendiendo al norte de Texas y Oklahoma, [32] [33] y una mayor expansión hacia el norte puede ser facilitada por el cambio climático a medida que más hábitat se vuelve adecuado para las especies vectoras y reservorios de la leishmaniasis. [34] La leishmaniasis también se conoce como papalomoyo , papa lo moyo, úlcera de los chicleros y chiclera en América Latina. [35] Durante 2004, aproximadamente 3.400 tropas del ejército colombiano , que operaban en las selvas cercanas al sur del país (en particular alrededor de los departamentos de Meta y Guaviare), se infectaron con leishmaniasis. Supuestamente, un factor contribuyente fue que muchos de los soldados afectados no usaron el repelente de insectos proporcionado oficialmente debido a su olor perturbador. En todo Colombia se registraron casi 13.000 casos de la enfermedad durante 2004, y en febrero de 2005 se habían notificado unos 360 casos nuevos de la enfermedad entre soldados. [36]
La enfermedad se encuentra en gran parte de Asia y en Oriente Medio. Dentro de Afganistán, la leishmaniasis se presenta comúnmente en Kabul , en parte debido al mal saneamiento y a los desechos que se dejan sin recoger en las calles, lo que permite que los flebótomos que propagan parásitos tengan un entorno que les resulta favorable. [37] [38] En Kabul, se estimó que el número de personas infectadas fue de al menos 200.000, y en otras tres ciudades ( Herat , Kandahar y Mazar-i-Sharif ) se produjeron alrededor de 70.000 más, según cifras de la OMS de 2002. [39] [40] Se estima que Kabul es el mayor centro de leishmaniasis cutánea del mundo, con alrededor de 67.500 casos en 2004. [41] África, en particular el este y el norte , [27] también alberga casos de leishmaniasis. La leishmaniasis se considera endémica también en algunas partes del sur de Europa occidental y se ha extendido hacia el norte en los últimos años. [42] Por ejemplo, entre 2010 y 2012 se notificó un brote de leishmaniasis cutánea y visceral en Madrid (España). [43]
La leishmaniasis es una enfermedad que afecta principalmente a los países en desarrollo y rara vez se conoce en los países desarrollados , salvo en un pequeño número de casos, sobre todo en casos en que las tropas están estacionadas fuera de sus países de origen. Las tropas estadounidenses estacionadas en Arabia Saudita e Irak han informado de casos de leishmaniasis desde la Guerra del Golfo de 1990 , incluida la leishmaniasis visceral. [44] [45] [46] En septiembre de 2005, al menos cuatro marines holandeses que estaban estacionados en Mazar-i-Sharif (Afganistán) contrajeron la enfermedad y posteriormente fueron repatriados para recibir tratamiento. [47] [48]

Las descripciones de lesiones llamativas similares a la leishmaniasis cutánea aparecen en tablillas del rey Asurbanipal del siglo VII a. C., algunas de las cuales pueden haber derivado de textos incluso anteriores de 1500 a 2500 a. C. Los médicos persas , incluido Avicena en el siglo X d. C., dieron descripciones detalladas de lo que se llamó llaga de Balkh . [49] En 1756, Alexander Russell , después de examinar a un paciente turco , dio una de las descripciones clínicas más detalladas de la enfermedad. Los médicos del subcontinente indio la describirían como kala-azar (pronunciado kālā āzār , la frase en urdu , hindi e indostánico para "fiebre negra", kālā significa negro y āzār significa fiebre o enfermedad). En América , la evidencia de la forma cutánea de la enfermedad en Ecuador y Perú aparece en cerámica preincaica que representa lesiones cutáneas y rostros deformados que datan del siglo I d. C. Algunos textos de los siglos XV y XVI del período inca y de los colonizadores españoles mencionan "enfermedad del valle", "enfermedad andina" o "lepra blanca", que probablemente sean la forma cutánea. [50]
No está claro quién descubrió por primera vez el organismo. David Douglas Cunningham , cirujano mayor del ejército británico de la India , pudo haberlo visto en 1885 sin poder relacionarlo con la enfermedad. [51] [52] Peter Borovsky , un cirujano militar ruso que trabajaba en Tashkent , realizó una investigación sobre la etiología de la "llaga oriental", conocida localmente como llaga sart , y en 1898 publicó la primera descripción precisa del agente causal, describió correctamente la relación del parásito con los tejidos del huésped y lo refirió correctamente a los protozoos . Sin embargo, debido a que sus resultados se publicaron en ruso en una revista de baja circulación, sus resultados no fueron reconocidos internacionalmente durante su vida. [53] En 1901, William Boog Leishman identificó ciertos organismos en frotis tomados del bazo de un paciente que había muerto de "fiebre dum-dum" ( Dum Dum es un área cercana a Calcuta ) y propuso que eran tripanosomas , encontrados por primera vez en la India . [54] Unos meses más tarde, el capitán Charles Donovan (1863-1951) confirmó el hallazgo de lo que se conoció como cuerpos de Leishman-Donovan en frotis tomados de personas en Madrás en el sur de la India. [55] Pero fue Ronald Ross quien propuso que los cuerpos de Leishman-Donovan eran las etapas intracelulares de un nuevo parásito, al que llamó Leishmania donovani . [56] El vínculo con la enfermedad kala-azar fue sugerido por primera vez por Charles Donovan, y fue demostrado de manera concluyente por el descubrimiento de Charles Bentley de L. donovani en pacientes con kala-azar . [57] La transmisión por flebótomos fue planteada por Lionel Napier y Ernest Struthers en la Escuela de Medicina Tropical de Calcuta y luego probada por sus colegas. [58] [59] La enfermedad se convirtió en un problema importante para las tropas aliadas que luchaban en Sicilia durante la Segunda Guerra Mundial ; la investigación de Leonard Goodwin demostró entonces que el pentostam era un tratamiento eficaz. [60]
El Instituto para la Salud Mundial ha reintroducido el fármaco paromomicina para el tratamiento de la leishmaniasis, cuyos resultados llevaron a su aprobación como fármaco huérfano . La Iniciativa Medicamentos para Enfermedades Olvidadas también está facilitando activamente la búsqueda de nuevas terapias. Un tratamiento con paromomicina costará unos 10 dólares estadounidenses. El fármaco se había identificado originalmente en la década de 1950, pero se había abandonado porque no sería rentable, ya que la enfermedad afecta principalmente a la gente pobre. [61] El gobierno indio aprobó la venta de paromomicina en agosto de 2006. [62]
En 2012, la Organización Mundial de la Salud había negociado con éxito con los fabricantes para lograr una reducción del costo de la anfotericina B liposomal , a 18 dólares por vial, pero se necesitan varios viales para el tratamiento y debe mantenerse a una temperatura estable y fresca. [3]

En 2017 no había ninguna vacuna contra la leishmaniasis para humanos. [63] [64] Se están realizando investigaciones para producir una vacuna humana. [64]
Actualmente existen algunas vacunas eficaces contra la leishmaniasis canina. [65] También se considera que las prácticas de salud pública pueden controlar o eliminar la leishmaniasis sin una vacuna. [64] Se están explorando fármacos basados en pirimidinas como compuestos antileishmaniasis. [66]
{{cite web}}: CS1 maint: copia archivada como título ( enlace )