La citometría de flujo ( FC ) es una técnica utilizada para detectar y medir las características físicas y químicas de una población de células o partículas. [1] [2] [3] [4]
En este proceso, una muestra que contiene células o partículas se suspende en un líquido y se inyecta en el citómetro de flujo . La muestra se enfoca para que, idealmente, fluya una célula a la vez a través de un rayo láser, donde la luz dispersada es característica de las células y sus componentes. Las células suelen estar marcadas con marcadores fluorescentes para que la luz se absorba y luego se emita en una banda de longitudes de onda. Se pueden examinar rápidamente decenas de miles de células y los datos recopilados se procesan en una computadora. [5]
La citometría de flujo se utiliza habitualmente en la investigación básica, la práctica clínica y los ensayos clínicos . Los usos de la citometría de flujo incluyen:
Un analizador de citometría de flujo es un instrumento que proporciona datos cuantificables de una muestra. Otros instrumentos que utilizan citometría de flujo incluyen clasificadores de células que separan físicamente y, por lo tanto, purifican las células de interés en función de sus propiedades ópticas.
El primer dispositivo de citometría de flujo basado en impedancia , que utiliza el principio de Coulter , se describió en la patente estadounidense 2.656.508, concedida en 1953 a Wallace H. Coulter . Mack Fulwyler fue el inventor del precursor de los citómetros de flujo actuales, en particular el clasificador de células. [6] Fulwyler desarrolló esto en 1965 con su publicación en Science . [7] El primer dispositivo de citometría de flujo basado en fluorescencia (ICP 11) fue desarrollado en 1968 por Wolfgang Göhde de la Universidad de Münster , solicitó la patente el 18 de diciembre de 1968 [8] y se comercializó por primera vez en 1968/69 por el desarrollador y fabricante alemán. Partec a través de Phywe AG en Gotinga . En ese momento, otros científicos todavía preferían ampliamente los métodos de absorción a los métodos de fluorescencia . [9] Poco después, se desarrollaron instrumentos de citometría de flujo, incluido el citofluorógrafo (1971) de Bio/Physics Systems Inc. (más tarde: Ortho Diagnostics), el PAS 8000 (1973) de Partec, el primer FACS (clasificación de células activadas por fluorescencia) ) instrumento de Becton Dickinson (1974), el ICP 22 (1975) de Partec/Phywe y los Epics de Coulter (1977/78). Amphasys (2012) presentó el primer citómetro de flujo de impedancia de alta frecuencia sin etiquetas basado en un "laboratorio en chip" de microfluidos patentado, Ampha Z30. [ cita necesaria ]
El nombre original de la tecnología de citometría de flujo basada en fluorescencia era "citofotometría de pulso" ( en alemán : Impulszytophotometrie ), basado en la primera solicitud de patente sobre citometría de flujo basada en fluorescencia. En la V Conferencia de la Fundación Americana de Ingeniería sobre Citología Automatizada celebrada en Pensacola (Florida) en 1976 –ocho años después de la introducción del primer citómetro de flujo basado en fluorescencia (1968)– se acordó utilizar comúnmente el nombre de "citometría de flujo", un término que rápidamente se hizo popular. [10]
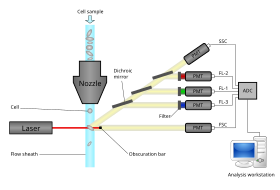
Los citómetros de flujo modernos pueden analizar miles de partículas por segundo, en "tiempo real" y, si se configuran como clasificadores de células, pueden separar y aislar activamente partículas con propiedades ópticas específicas a velocidades similares. Un citómetro de flujo es similar a un microscopio , excepto que, en lugar de producir una imagen de la célula, la citometría de flujo ofrece una cuantificación automatizada de alto rendimiento de parámetros ópticos específicos célula por célula. Para analizar tejidos sólidos , primero se debe preparar una suspensión unicelular. [ cita necesaria ]
Un citómetro de flujo tiene cinco componentes principales: una celda de flujo, un sistema de medición, un detector, un sistema de amplificación y una computadora para el análisis de las señales. La celda de flujo tiene una corriente de líquido (líquido envolvente), que transporta y alinea las celdas para que pasen en fila india a través del haz de luz para su detección. El sistema de medición comúnmente utiliza medición de impedancia (o conductividad) y sistemas ópticos – lámparas ( mercurio , xenón ); láseres de alta potencia refrigerados por agua ( argón , criptón , láser de colorante); láseres de baja potencia refrigerados por aire (argón (488 nm), HeNe rojo (633 nm), HeNe verde, HeCd (UV)); Láseres de diodo (azul, verde, rojo, violeta) que generan señales luminosas. El detector y el sistema de conversión analógico a digital (ADC) convierte mediciones analógicas de luz dispersada hacia adelante (FSC) y luz dispersada lateralmente (SSC), así como señales de fluorescencia específicas de colorantes, en señales digitales que pueden ser procesadas por una computadora. . El sistema de amplificación puede ser lineal o logarítmico . [ cita necesaria ]
El proceso de recopilación de datos de muestras utilizando el citómetro de flujo se denomina "adquisición". La adquisición está mediada por una computadora conectada físicamente al citómetro de flujo y el software que maneja la interfaz digital con el citómetro. El software es capaz de ajustar los parámetros (p. ej., voltaje, compensación) para la muestra que se está probando y también ayuda a mostrar información inicial de la muestra mientras adquiere datos de la muestra para garantizar que los parámetros estén configurados correctamente. Los primeros citómetros de flujo eran, en general, dispositivos experimentales, pero los avances tecnológicos han permitido aplicaciones generalizadas para su uso en una variedad de propósitos tanto clínicos como de investigación. Debido a estos desarrollos, se ha desarrollado un mercado considerable para instrumentación, software de análisis y reactivos utilizados en la adquisición, como anticuerpos marcados con fluorescencia .
Los instrumentos modernos suelen tener múltiples láseres y detectores de fluorescencia. El récord actual para un instrumento comercial es de diez láseres [11] y 30 detectores de fluorescencia. [12] El aumento del número de láseres y detectores permite el etiquetado de anticuerpos múltiples y puede identificar con mayor precisión una población objetivo mediante sus marcadores fenotípicos . Ciertos instrumentos pueden incluso tomar imágenes digitales de células individuales, lo que permite el análisis de la ubicación de la señal fluorescente dentro o sobre la superficie de las células. [ cita necesaria ]
Las células deben pasar uniformemente a través del centro de los rayos láser enfocados para medir con precisión las propiedades ópticas de las células en cualquier citómetro de flujo. [13] [14] [15] El propósito del sistema fluídico es mover las células una por una a través del rayo láser y por todo el instrumento. Los fluidos en un citómetro de flujo con capacidades de clasificación de células también utilizan la corriente para transportar células clasificadas a tubos o pozos de recolección. [13]
Para el posicionamiento preciso de las células en un chorro de líquido, en la mayoría de los citómetros se utiliza el enfoque hidrodinámico. [13] [14] Las células en suspensión ingresan al instrumento encerradas por una envoltura externa de líquido. El núcleo de muestra se mantiene en el centro del fluido envolvente. La velocidad de entrada de la muestra o la velocidad con la que las células fluyen hasta el interrogatorio láser se puede controlar mediante la presión del fluido de envoltura sobre el núcleo de la muestra. En condiciones óptimas, la corriente de fluido central y el fluido de envoltura no se mezclan. [ cita necesaria ]
La tecnología de enfoque acústico se utiliza en algunos citómetros de flujo para respaldar el enfoque hidrodinámico. [13] [15] Las ondas acústicas (>2 MHz) preenfocan la muestra antes de introducirla en el líquido envolvente. Luego, la muestra preenfocada se inyecta en el núcleo hidrodinámico y fluye a través del instrumento. Esto puede ayudar a aumentar la precisión de los datos con altas tasas de entrada de muestras.
La luz emitida por los fluoróforos se encuentra en un espectro de longitudes de onda, por lo que la combinación de varios fluoróforos puede provocar una superposición. Para agregar especificidad, se utilizan filtros ópticos y espejos dicroicos para filtrar y mover la luz a los detectores, como tubos fotomultiplicadores (PMT) o fotodiodos de avalancha (APD). [13] Los filtros ópticos están diseñados como filtros de paso de banda (BP), de paso largo (LP) o de paso corto (SP). La mayoría de los citómetros de flujo utilizan espejos dicroicos y filtros de paso de banda para seleccionar bandas específicas del espectro óptico.
La citometría de flujo espectral utiliza prismas o rejillas de difracción para dispersar la luz emitida de un marcador a través de una matriz de detectores. [13] [16] Esto permite medir el espectro completo de cada partícula. A continuación, los espectros medidos de células individuales se desmezclan utilizando espectros de referencia de todos los colorantes utilizados y el espectro de autofluorescencia. Esto puede permitir un diseño de panel más amplio y la aplicación de nuevos marcadores biológicos. [ cita necesaria ]
La citometría de flujo de imágenes (IFC) captura imágenes multicanal de células. [13] [17] Los detectores utilizados en plataformas de imágenes pueden equiparse con un dispositivo de carga acoplada (CCD) o un semiconductor complementario de óxido metálico (CMOS) para capturar imágenes de células individuales.
Cada fluorocromo tiene un amplio espectro de fluorescencia. Cuando se utiliza más de un fluorocromo, puede producirse el solapamiento entre los fluorocromos. Esta situación se llama superposición de espectro. Es necesario superar esta situación. Por ejemplo, el espectro de emisión de FITC y PE es que la luz emitida por la fluoresceína se superpone a la misma longitud de onda cuando pasa a través del filtro utilizado para PE. Esta superposición espectral se corrige eliminando una parte de la señal FITC de las señales PE o viceversa. Este proceso se llama compensación de color, que calcula un fluorocromo como porcentaje para medirse a sí mismo. [18]
La compensación es el proceso matemático mediante el cual se corrige la superposición espectral de datos de citometría de flujo multiparamétrico. Dado que los fluorocromos pueden tener un espectro de amplio alcance, pueden superponerse, provocando el resultado indeseable de confusión durante el análisis de los datos. Esta superposición, conocida como desbordamiento y cuantificada en el coeficiente de desbordamiento, generalmente es causada por detectores de un determinado fluorocromo que miden un pico significativo en la longitud de onda de un fluorocromo diferente. El álgebra lineal se utiliza con mayor frecuencia para realizar esta corrección. [18]
En general, cuando se muestran gráficos de uno o más parámetros, es para mostrar que los demás parámetros no contribuyen a la distribución mostrada. Especialmente cuando se utilizan parámetros que son más del doble, este problema es más grave. Actualmente, no se han descubierto herramientas para mostrar de manera eficiente parámetros multidimensionales. La compensación es muy importante para ver la distinción entre celdas.

[ cita necesaria ]
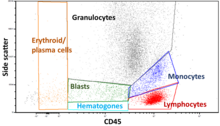
Los datos generados por los citómetros de flujo se pueden representar gráficamente en una sola dimensión , para producir un histograma , o en diagramas de puntos bidimensionales, o incluso en tres dimensiones. Las regiones de estos gráficos se pueden separar secuencialmente, según la intensidad de la fluorescencia , mediante la creación de una serie de extracciones de subconjuntos, denominadas "puertas". Existen protocolos de activación específicos para fines clínicos y de diagnóstico, especialmente en relación con la hematología . Las células individuales individuales a menudo se distinguen de los dobletes de células o agregados superiores por su "tiempo de vuelo" (denotado también como "ancho de pulso") a través del rayo láser enfocado estrechamente [19]
Los gráficos suelen realizarse en escalas logarítmicas. Debido a que los espectros de emisión de diferentes tintes fluorescentes se superponen, [20] [21] las señales en los detectores deben compensarse tanto electrónica como computacionalmente. Los datos acumulados con el citómetro de flujo se pueden analizar mediante software. Una vez recopilados los datos, no es necesario permanecer conectado al citómetro de flujo y el análisis suele realizarse en una computadora separada. [ cita necesaria ] Esto es especialmente necesario en instalaciones centrales donde el uso de estas máquinas tiene una gran demanda. [ cita necesaria ]
Los avances recientes en la identificación automatizada de poblaciones mediante métodos computacionales han ofrecido una alternativa a las estrategias de selección tradicionales. Los sistemas de identificación automatizados podrían ayudar potencialmente a encontrar poblaciones raras y ocultas. Los métodos automatizados representativos incluyen FLOCK [22] en Immunology Database and Analysis Portal (ImmPort), [23] SamSPECTRAL [24] y flowClust [25] [26] [27] en Bioconductor , y FLAME [28] en GenePattern . La incrustación de vecinos estocásticos distribuidos en T (tSNE) es un algoritmo diseñado para realizar una reducción de dimensionalidad , para permitir la visualización de datos multidimensionales complejos en un "mapa" bidimensional. [29] Los esfuerzos de colaboración han dado como resultado un proyecto abierto llamado FlowCAP (Citometría de flujo: Evaluación crítica de métodos de identificación de poblaciones, [30] ) para proporcionar una forma objetiva de comparar y evaluar los métodos de agrupación de datos de citometría de flujo, y también para establecer una guía sobre uso y aplicación adecuados de estos métodos.
Los controles de fluorescencia menos uno (FMO) son importantes para la interpretación de datos cuando se construyen paneles multicolores, en los que una célula se tiñe con múltiples fluorocromos simultáneamente. Los controles FMO proporcionan una medida del desbordamiento de fluorescencia en un canal determinado y permiten una compensación. Para generar un control FMO, se tiñe una muestra con todos los fluorocromos excepto el que se está analizando, lo que significa que si está utilizando 4 fluorocromos diferentes, su control FMO debe contener solo 3 de ellos (ejemplo: fluorocromos: A, B, C, D; FMO – ABC_, AB_D, A_CD, _BCD). [ cita necesaria ]
La clasificación de células es un método para purificar poblaciones de células en función de la presencia o ausencia de características físicas específicas. [13] [15] [31] En los citómetros de flujo con capacidades de clasificación, el instrumento detecta células utilizando parámetros que incluyen el tamaño celular, la morfología y la expresión de proteínas, y luego tecnología de gotas para clasificar las células y recuperar los subconjuntos para uso post-experimental. [13] [15]
El primer prototipo de clasificador fue construido en el Laboratorio Nacional de Los Álamos (LANL) en 1965 por el físico Mack J. Fulwyler uniendo un sensor de volumen Coulter con la recién inventada impresora de inyección de tinta. [32] El clasificador de células vivas o clasificador de células activadas por fluorescencia (FACS) [a] fue generado por Len Herzenberg , quien posteriormente ganó el Premio Kyoto en 2006 por su trabajo fundamental. [34]
_B.jpg/440px-Fluorescence_Assisted_Cell_Sorting_(FACS)_B.jpg)
Los clasificadores de células por citometría de flujo tienen un sistema de recolección a diferencia de los analizadores de citometría de flujo. El proceso de recolección comienza cuando se inyecta una muestra en una corriente de líquido envolvente que pasa a través de la celda de flujo y es interceptada por el láser. [35] Luego, la corriente transporta la celda a través de una boquilla vibratoria que genera gotas y la mayoría contiene una celda o ninguna. Se coloca un anillo de carga eléctrica justo en el punto donde la corriente se rompe en gotas y se coloca una carga en el anillo inmediatamente antes de medir la intensidad de la fluorescencia; la carga opuesta queda atrapada en la gota cuando se desprende de la corriente y, por lo tanto, las gotas están cargadas. Luego, las gotas cargadas caen a través de un sistema de deflexión electrostática que las desvía hacia contenedores en función de su carga. En algunos sistemas, la carga se aplica directamente a la corriente y la gota que se desprende retiene la carga del mismo signo que la corriente. Luego, la corriente regresa a neutral después de que la gota se desprende. Después de recolectarlas, estas células se pueden cultivar, manipular y estudiar más a fondo. [ cita necesaria ]

La citometría de flujo utiliza las propiedades de la luz dispersadas por células o partículas para la identificación o medición cuantitativa de propiedades físicas. Se pueden utilizar etiquetas, tintes y tintes para análisis multiparamétricos (comprender más propiedades de una célula). El inmunofenotipado es el análisis de poblaciones heterogéneas de células utilizando anticuerpos marcados [36] y otros reactivos que contienen fluoróforos, como tintes y colorantes.
Se puede utilizar una amplia gama de fluoróforos como etiquetas en citometría de flujo. [20] Los fluoróforos, o simplemente "flúor", [ cita necesaria ] generalmente se unen a un anticuerpo que reconoce una característica objetivo en o dentro de la célula; también pueden estar unidos a una entidad química con afinidad por la membrana celular u otra estructura celular. Cada fluoróforo tiene una longitud de onda máxima característica de excitación y emisión , y los espectros de emisión a menudo se superponen. En consecuencia, la combinación de etiquetas que se puede utilizar depende de la longitud de onda de la(s) lámpara(s) o del(los) láser(es) utilizados para excitar los fluorocromos y de los detectores disponibles. [37] Se cree que el número máximo de etiquetas fluorescentes distinguibles es 17 o 18, y este nivel de complejidad requiere una optimización laboriosa para limitar los artefactos, así como complejos algoritmos de deconvolución para separar los espectros superpuestos. [38] La citometría de flujo utiliza la fluorescencia como herramienta cuantitativa; La máxima sensibilidad de la citometría de flujo no tiene comparación con otras plataformas de detección fluorescente, como la microscopía confocal . La sensibilidad de fluorescencia absoluta es generalmente menor en la microscopía confocal porque el sistema óptico confocal rechaza las señales desenfocadas y porque la imagen se construye en serie a partir de mediciones individuales en cada ubicación de la célula, lo que reduce la cantidad de tiempo disponible para recopilar la señal. . [39]
A veces se utilizan puntos cuánticos en lugar de los fluoróforos tradicionales debido a sus picos de emisión más estrechos. [ cita necesaria ]
La citometría de masas supera el límite de marcado fluorescente mediante la utilización de isótopos de lantánidos unidos a anticuerpos. En teoría, este método podría permitir el uso de 40 a 60 etiquetas distinguibles y se ha demostrado para 30 etiquetas. [38] La citometría de masas es fundamentalmente diferente de la citometría de flujo: las células se introducen en un plasma , se ionizan y los isótopos asociados se cuantifican mediante espectrometría de masas de tiempo de vuelo . Aunque este método permite el uso de una gran cantidad de etiquetas, actualmente tiene una capacidad de rendimiento menor que la citometría de flujo. También destruye las células analizadas, impidiendo su recuperación mediante clasificación. [38]
Además de la capacidad de marcar e identificar células individuales mediante anticuerpos fluorescentes, también se pueden medir productos celulares como citoquinas, proteínas y otros factores. De manera similar a los ensayos ELISA tipo sándwich, los ensayos citométricos de matriz de perlas ( CBA ) utilizan múltiples poblaciones de perlas típicamente diferenciadas por tamaño y diferentes niveles de intensidad de fluorescencia para distinguir múltiples analitos en un solo ensayo. La cantidad de analito capturado se detecta mediante un anticuerpo biotinilado contra un epítopo secundario de la proteína, seguido de un tratamiento con estreptavidina-R-ficoeritrina. La intensidad fluorescente de R-ficoeritrina en las perlas se cuantifica en un citómetro de flujo equipado con una fuente de excitación de 488 nm. Las concentraciones de una proteína de interés en las muestras se pueden obtener comparando las señales fluorescentes con las de una curva estándar generada a partir de una dilución en serie de una concentración conocida del analito. Comúnmente también se conoce como matriz de perlas de citoquinas (CBA).
Los sistemas de análisis de celda única basados en impedancia se conocen comúnmente como contadores Coulter . Representan un método bien establecido para contar y dimensionar prácticamente cualquier tipo de células y partículas. La tecnología sin etiquetas se ha mejorado recientemente mediante un enfoque basado en " laboratorio en un chip " y mediante la aplicación de corriente alterna (CA) de alta frecuencia en el rango de radiofrecuencia (de 100 kHz a 30 MHz) en lugar de una corriente estática directa. corriente (CC) o campo CA de baja frecuencia. [40] [41] Esta tecnología patentada permite un análisis celular de alta precisión y proporciona información adicional como la capacitancia y la viabilidad de la membrana . El tamaño relativamente pequeño y la robustez permiten el uso in situ en el campo con batería.
Los factores mensurables en el análisis celular y la citometría de flujo incluyen un conjunto diverso de rasgos e indicadores que brindan información importante sobre la biología y función celular. Las técnicas de citometría de flujo pueden cuantificar y evaluar estos factores, lo que permite a los investigadores investigar y analizar diversos aspectos de las células. A continuación se muestran algunos parámetros cuantificables importantes que se investigan con frecuencia:
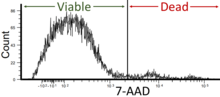
La tecnología tiene aplicaciones en varios campos, incluida la biología molecular , patología , inmunología , virología, [44] biología vegetal y biología marina . [45] Tiene una amplia aplicación en medicina , especialmente en trasplantes, hematología, inmunología tumoral y quimioterapia, diagnóstico prenatal, genética y clasificación de esperma para la preselección del sexo . La citometría de flujo se aplica ampliamente para detectar anomalías en los espermatozoides asociadas con la fragmentación del ADN [46] en ensayos de fertilidad masculina . [47] Además, se utiliza ampliamente en investigaciones para la detección de daños en el ADN , [48] [49] escisión de caspasas y apoptosis . [50] La citometría de flujo fotoacústica se utiliza en el estudio de bacterias resistentes a múltiples fármacos (más comúnmente MRSA) para detectar, diferenciar y cuantificar bacterias en la sangre marcadas con bacteriófagos teñidos. [51] En neurociencia , también se puede analizar la coexpresión de antígenos intracelulares y de superficie celular. [52] En microbiología, se puede utilizar para detectar y clasificar bibliotecas de mutantes de transposones construidas con un transposón que codifica GFP (TnMHA), [53] o para evaluar la viabilidad. [54] En ingeniería de proteínas, la citometría de flujo se utiliza junto con la visualización de levaduras y bacterias para identificar variantes de proteínas que se muestran en la superficie celular con propiedades deseadas. Las principales ventajas de la citometría de flujo sobre la histología y la IHC es la posibilidad de medir con precisión las cantidades de antígenos y la posibilidad de teñir cada célula con múltiples anticuerpos-fluoróforos; en los laboratorios actuales se pueden unir alrededor de 10 anticuerpos a cada célula. Esto es mucho menos que el citómetro de masas, donde actualmente se pueden medir hasta 40, pero a un precio más alto y a un ritmo más lento.
En los sistemas acuáticos, la citometría de flujo se utiliza para el análisis de células autofluorescentes o células marcadas fluorescentemente con colorantes añadidos. Esta investigación comenzó en 1981 cuando Clarice Yentsch utilizó la citometría de flujo para medir la fluorescencia en una marea roja que producía dinoflagelados. [55] El año siguiente, los investigadores publicaron mediciones de citometría de flujo de múltiples especies de algas que podían distinguirse en función de sus características de fluorescencia. [56] En 1983, los investigadores marinos estaban ensamblando sus propios citómetros de flujo [57] o utilizando citómetros de flujo disponibles comercialmente en muestras de agua de mar recolectadas en las Bermudas para demostrar que las células de fitoplancton podían distinguirse del material no vivo y que las cianobacterias podían separarse de un comunidad mixta y posteriormente cultivada en el laboratorio. [58] La citometría de flujo también permitió a los investigadores marinos distinguir entre Proclorococos débilmente fluorescentes y microorganismos heterótrofos, una distinción que es difícil con evaluaciones basadas en microscopía. [59] Los avances en la tecnología ahora permiten a los científicos acuáticos usar citómetros de flujo continuamente durante los cruceros de investigación [60] y los citómetros de flujo se utilizan para proporcionar imágenes de células de fitoplancton individuales. [61] [62] Los científicos marinos utilizan la capacidad de clasificación de los citómetros de flujo para realizar mediciones discretas de la actividad y diversidad celular, [63] [64] para realizar investigaciones sobre las relaciones mutualistas entre microorganismos que viven muy cerca, [65] y para medir las tasas biogeoquímicas de múltiples procesos en el océano. [66]
La proliferación celular es la función principal del sistema inmunológico. A menudo es necesario analizar la naturaleza proliferativa de las células para poder sacar algunas conclusiones. Uno de esos ensayos para determinar la proliferación celular es el colorante de seguimiento éster succinimidílico de diacetato de carboxifluoresceína (CFSE). Ayuda a controlar las células proliferativas. Este ensayo proporciona datos cuantitativos y cualitativos durante experimentos de series temporales. [67] Este tinte se une covalentemente con las moléculas de larga vida presentes dentro de la célula. Cuando las células se dividen, las moléculas también se dividen y las células hijas poseen la mitad de tinte que la población original. Esta disminución de la intensidad se puede visualizar mediante citometría de flujo. [68] En la literatura, esta poderosa técnica de citometría de flujo y CFSE se ha utilizado para encontrar la eficiencia de las células T para matar las células diana en cánceres como la leucemia. Para visualizar la muerte de las células diana, tanto rápida como lenta, los científicos han utilizado el etiquetado CFSE con tinción de anticuerpos de ciertos tipos de células y microperlas marcadas con fluorescencia. Esto también proporcionó información sobre la proliferación de las células diana tras el tratamiento con determinadas citoquinas. [69]
La citometría de flujo se ha utilizado para medir los tamaños del genoma , o más precisamente: la cantidad de ADN en una célula o núcleo . Aunque los genomas se pueden analizar con mayor precisión mediante la secuenciación del genoma , esto suele ser difícil debido a una alta fracción de microcromosomas o secuencias repetitivas que pueden pasar desapercibidas mediante la secuenciación (o que se filtran durante el paso de análisis cuando no se pueden asignar a cromosomas ). Sin embargo, la citometría de flujo tampoco es perfecta. Los tamaños del genoma resultante pueden diferir según el tinte utilizado. Un análisis de los genomas de peces dio como resultado tamaños de genoma significativamente diferentes cuando se utilizaron yoduro de propidio (PI) y DAPI , respectivamente. Por ejemplo, se encontró que el genoma de Anguilla japonica contenía 1,09 pg de ADN con PI frente a 1,25 pg con DAPI. De manera similar, se encontró que el genoma de Myxocyprinus asiaticus contenía 2,75 pg de ADN (PI) frente a 3,08 pg (DAPI). Es decir, las diferencias fueron del orden del 12% al 14%. [70]
{{cite web}}: Mantenimiento CS1: otros ( enlace )