La zingibaína , zingipaína o proteasa del jengibre ( EC 3.4.22.67) es una enzima cisteína proteasa que se encuentra en los rizomas del jengibre (Zingiber officinale). [1] [2] [3] Cataliza la escisión preferencial de péptidos con un residuo de prolina en la posición P2 . Tiene dos formas distintas , la proteasa del jengibre I (GP-I) y la proteasa del jengibre II (GP-II). [4]
Como miembro de la familia de proteasas de tipo papaína de las proteasas de cisteína, la zingibaína comparte varias similitudes estructurales y funcionales con enzimas más estudiadas como la papaína , la bromelina y la actinidina . Estas peptidasas contienen un residuo de cisteína activo en sus centros que cataliza la escisión hidrolítica de los enlaces peptídicos. La zingibaína se destaca por su actividad como proteasa y colagenasa . [1]
Fue aislado, purificado y reportado por primera vez en 1973 por Ichikawa et al. en la Universidad de Mujeres de Japón . [5] Recientemente, se descubrió que la zingibaína existe como dos isoenzimas , GP-I y GP-II, que se aislaron por cromatografía, con pesos moleculares de aproximadamente 22.500 Da. [5]
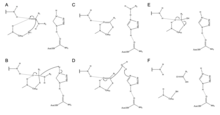
La zingibaína utiliza una tríada catalítica de residuos de Cys, His y Asn en su sitio activo para escindir enlaces peptídicos hidrolíticamente. La presencia de Asn175 estabiliza el anillo de imidazol de His, lo que garantiza que esté en una posición óptima para catalizar la hidrólisis.
El mecanismo comienza con una transferencia de protones de Cys25 a His159. [6] El anión sulfuro luego ataca el carbono alfa del aminoácido , desplazando el grupo amina , que se une a His159. [6] El carbono alfa del aminoácido estabilizado es luego atacado por una molécula de agua, que desplaza el sulfuro de Cys25 para convertir el aminoácido en un ácido carboxílico , que se libera del sitio activo de la enzima. [6]
La introducción experimental de ditiotreitol , un conocido protector del grupo tiol , mejora la actividad proteolítica, lo que proporciona una verificación adicional de la importancia del residuo de cisteína central para la actividad enzimática. [7]
La zingibaína presenta una tasa de renovación máxima a 60 °C y se desnaturaliza rápidamente a 70 °C. [8] La proteólisis no se ve afectada en gran medida durante la cocción con jengibre. Los rangos de temperatura óptimos de la papaína y la ficina son elevados en relación con la zingibaína, mientras que la bromelina opera en un rango ligeramente inferior. [7]
La actividad proteolítica máxima de la zingibaína ocurre a un pH de 6,0, aunque la enzima todavía está activa en rangos de pH de 4,5 a 6,0 (pH óptimo para adobos de carne ). [7]
GP-II, la más ácida de las dos isoenzimas, exhibe un pI de 4,82, y GP-I exhibe valores de pI de 5,05 o 5,16. [1] Estos múltiples valores de pI respaldan la teoría de que GP-I puede ser una mezcla de dos proteínas.
La zingibaína fue purificada y caracterizada por primera vez con cristalografía de rayos X en 2000 por investigadores de la Universidad de Boston . [1]
La enzima tiene 221 aminoácidos de longitud y está glicosilada con 2 cadenas de oligosacáridos unidos a N en Asn96 y Asn154. [3] La cadena polipeptídica de zingibaína se pliega en dos dominios polares de tamaño aproximadamente igual, divididos por una hendidura neutra central. [3] El primer dominio contiene hélices alfa y el segundo tiene láminas beta antiparalelas . [3] Esta separación de regiones polares y no polares facilita las interacciones proteína-proteína entre la enzima y una amplia gama de sustratos. [3]
El sitio activo de la zingibaína, ubicado en la hendidura central, tiene 5,5 Å de profundidad y 9,5 Å de largo. [3] El sitio activo contiene la tríada catalítica de Cys25, His159 y Asn175, que permiten cooperativamente la catálisis ácido/base.
La zingibaína exhibe especificidad de unión a sustratos peptídicos con prolina en la posición P2. [1] El subsitio S2 de la zingibaína contiene la cadena de aminoácidos Trp67-Met68-Asn69-Thr133-Ala157, lo que hace que el sitio sea demasiado compacto para acomodar residuos de sustrato aromático hidrofóbico más grandes favorecidos por otras enzimas en la familia de la papaína. [1] La prolina, sin embargo, se estabiliza mediante múltiples interacciones no covalentes con esta región.
La estructura de la enzima está estabilizada por enlaces de hidrógeno , así como por enlaces de sulfuro reticulados entre tres pares de residuos de cisteína (Cys22-Cys63, Cys56-Cys95 y Cys153-Cys200), análogos a muchas otras papaínas. [1]
Si bien la enzima existe como un monómero en solución, la zingibaína cristalizada forma tetrámeros o dímeros de dímeros, unidos por cadenas de glicosilación en cada subunidad. La zingibaína exhibe cadenas de oligosacáridos N-ligados de tipo complejo en dos residuos. [1] Las cadenas tienen entre 5 y 13 unidades de glicosilo de largo y están compuestas de N-acetilglucosamina , fucosa , manosa y xilosa . Las secuencias de azúcar de la zingibaína son casi idénticas a los oligosacáridos observados en las lectinas de las semillas del árbol de pagoda japonés , la lacasa a de las células de sicómoro y las S-glicoproteínas de Brassica campestris . [1]
Dentro de los rizomas de jengibre, la proteasa de jengibre participa en múltiples funciones para el mantenimiento y conservación de las células vegetales .
La zingibaína, como la mayoría de las proteasas de cisteína, se sintetiza como una proproteína de 40-50 kDa dentro de polisomas citoplasmáticos unidos a las membranas celulares . [9] Dentro del retículo endoplásmico , estas cadenas alargadas están marcadas con una señal de retención de KDEL ER y se colocan en grandes vesículas de KDEL que se mueven desde el RE a las vacuolas de almacenamiento de proteínas en las paredes celulares . [9]
Es probable que la zingibaína participe en el almacenamiento de proteínas (dentro de las semillas o el tejido vegetal ), pero degrada y moviliza predominantemente las proteínas de almacenamiento. También puede responder a factores de estrés abióticos y bióticos , como el choque térmico , las bajas temperaturas y la deshidratación , para eliminar cualquier proteína mal plegada o desnaturalizada resultante. [9]
Al igual que la papaína de las papayas y la bromelina de las piñas , se utiliza como ablandador de carne . [10] [11]
Se ha demostrado que cuando se agrega a la carne para cocinar, generalmente dentro de jengibre crudo o seco, la zingibaína aumenta la ternura de la carne. [8] [12] La ablandación de la carne ocurre debido a la rápida proteólisis de la zingibaína de las principales proteínas musculares dentro de la carne, especialmente actomiosina y colágeno tipo I , que se encuentra en las articulaciones musculares . [8]
Aunque otras enzimas de papaína, como la papaína, la ficina y la bromelina, se utilizan con más frecuencia para ablandar la carne, la zingibaína muestra una actividad proteolítica similar o elevada. [11] De hecho, la zingibaína es la única proteasa vegetal catalogada con actividad colagenolítica. La zingibaína puede ser un ablandador de carne preferible a la papaína debido a la textura resultante de la carne producida. Si bien la papaína puede hidrolizar la actomiosina, también descompone otras proteínas tisulares importantes, lo que da lugar a una textura blanda en la carne. [11] La especificidad de la unión de la zingibaína garantiza la hidrolización predominante de la actomiosina y el colágeno tipo I.
La zingibaina también se utiliza para dar sabor a salchichas y productos horneados . [8]
Durante los últimos 100 años, la proteasa del jengibre se ha utilizado tradicionalmente para cuajar la leche y crear cuajada de leche de jengibre , un plato cantonés gelatinoso elaborado con leche caliente y jugo de jengibre . La capacidad de coagulación de la leche y la especificidad de la proteasa del jengibre para la proteólisis de la κ-caseína hacen que la enzima sea un posible sustituto del cuajo vegetal para la producción de queso .
La coagulación de la leche se lleva a cabo tradicionalmente mediante enzimas coagulantes extraídas de fuentes como el cuajo. En el cuajo, tres isoenzimas de quimosina hidrolizan la κ-caseína, una fracción proteica importante de la leche, entre Phe105 y Met106 . Las subregiones hidrófilas de la κ-caseína se escinden, dejando atrás un agregado en gran parte hidrófobo. De este modo, las enzimas desestabilizan las micelas de κ-caseína y fomentan la aglutinación de residuos proteicos hidrófobos, lo que hace que la leche se cuaje.
Las principales desventajas industriales del cuajo incluyen su suministro limitado y su alto costo, su inaccesibilidad para los vegetarianos y los miembros practicantes de ciertos grupos religiosos , y las recientes prohibiciones nacionales europeas sobre la utilización de cuajo de ternera recombinante . [13] Las proteasas fúngicas son en gran medida inadecuadas como sustitutos del cuajo, y se ha demostrado que las enzimas de muchos extractos de plantas producen bajos rendimientos, texturas pobres y sabores amargos del queso. [13]
Sin embargo, la proteasa de jengibre cruda extraída del extracto de jengibre es inestable, con una vida media de aproximadamente 2 días a 5 °C, lo que la hace problemática para aplicaciones comerciales. [14] Si bien la vida media de la enzima no impide su eficacia durante la cocción, esta baja estabilidad de almacenamiento requiere mejoras para la comercialización.
Los intentos comerciales de estabilizar la enzima para la producción a gran escala han investigado métodos potenciales para inactivar el grupo sulfhidrilo libre dentro del sitio activo de la enzima. Las posibilidades mecanicistas incluyen la oxidación del sulfhidrilo, su intercambio con puentes disulfuro , la formación de aductos de quinona -tiol o la unión del sulfhidrilo a un ion de metal pesado . [14] Se descubrió que el ascorbato de sodio al 0,2 % estabilizaba la zingibaína hasta 14 días a 5 °C, mientras que concentraciones comparables de EDTA y CaCl 2 tuvieron un impacto mínimo en la estabilidad. [14]
Se ha observado que la zingibaína se desactiva a través de la autólisis , lo que se puede evitar haciendo reaccionar el grupo sulfhidrilo activo con cistina o PCMB. [14]
Los polvos de acetona son un método comercial viable para estabilizar la zingibaína. Después de eliminar los polifenoles vegetales hidrófobos del jengibre crudo, se introduce polvo de acetona a bajas temperaturas para deshidratar la pulpa de la raíz. [14] La enzima se estabiliza debido a la actividad reducida del agua, las concentraciones más bajas de pigmentos vegetales y las estructuras 3D más rígidas a temperaturas más bajas. [14]