Transposición alílica
Esto se lleva a cabo cuando la posición alílica no presenta impedimento estérico.
En el mecanismo de reacción propuesto, el nucleófilo no ataca directamente al carbono electrofílico, sino a la doble ligadura en un mecanismo de adición al carbono vinílico con desplazamiento del grupo saliente, la cual es denominada transposición alílica.
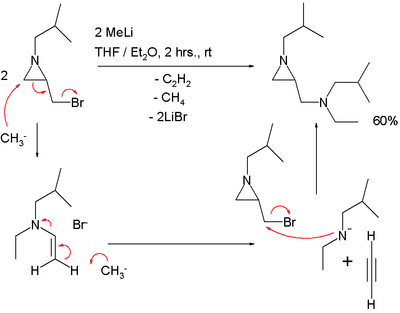
La utilidad sintética de esta reacción se puede extender a sustitución en enlaces del butadieno:[1] En el primer paso de esta macrociclización, el grupo tiol en el extremo del 1,5-pentanoditiol reacciona con el butadieno en el paso 1 para dar la enona 2 en un intercambio alílico con una sulfona como grupo saliente.
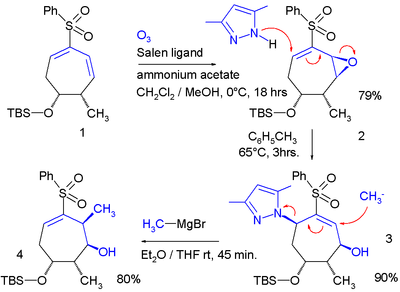
En un estudio llevado a cabo por Ahmad y colaboradores,[2] el intercambio alílico fue aplicado dos veces en un sistema cíclico: En esta secuencia de reacciones, una epoxidación de Jacobson añade un grupo epóxido a un dieno, el cual funciona como grupo saliente en la reacción con el pirazol nucleofílico.
Sólo cuando el anillo de ciclohexano es sustituido adecuadamente el protón se adicionará en una posición trans con respecto al grupo metilo adyacente.