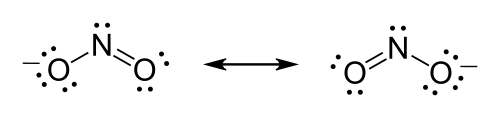
Estructura de Lewis
Esta representación se usa para saber la cantidad de electrones de valencia que puedan existir en un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples los cuales se encuentran íntimamente relacionados con la geometría molecular.
Este modelo fue propuesto por Gilbert Newton Lewis, quien lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
[6] Cuando los electrones de valencia han sido determinados, deben ubicarse en el modelo a estructurar.
Una vez que todos los pares solitarios han sido ubicados, los átomos, especialmente los centrales, pueden no cumplir con la regla del octeto.
Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar, perder o compartir electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia.
Por ejemplo los átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla del octeto, presentando enlaces simples y dobles.
Al quedar como Al3+, su configuración electrónica sería la del gas noble anterior, el neón.
En este caso se puede explicar la existencia del tricloruro de aluminio AlCl3 .Como puede verse, en los dos compuestos citados se cumple la regla del octeto para cada especie, en la cual un átomo pierde electrones y el otro los acepta, generándose de esta manera enlaces iónicos.
Por otra parte, los átomos no metálicos a partir del tercer período (Fósforo y Azufre)[7] pueden formar "octetos expandidos" es decir, pueden contener más que ocho electrones en su capa de valencia, por lo general colocando los electrones extra en subniveles.