Fisisorción
La fisisorción, también llamada adsorción física, es un proceso en el que la estructura electrónica del átomo o molécula apenas se perturba durante la adsorción.
Aunque la energía de interacción es muy débil (~10 – 100 meV), la fisisorción juega un papel importante en la naturaleza.
En comparación con la quimisorción, en la que la estructura electrónica de los átomos o moléculas enlazantes cambia y se forman enlaces covalentes o iónicos, la fisisorción no produce cambios en la estructura de los enlaces químicos.
Para dar una ilustración simple de fisisorción, primero podemos considerar un átomo de hidrógeno adsorbido frente a un conductor perfecto, como se muestra en la Fig.1.
Un núcleo con carga positiva se encuentra en R = (0, 0, Z), y la coordenada de posición de su electrón, r = (x, y, z) se da con respecto al núcleo.
Como resultado, la energía electrostática total es la suma de los términos de atracción y repulsión: El primer término es la interacción atractiva del núcleo y su carga de imagen, y el segundo término se debe a la interacción del electrón y su carga de imagen.
La energía de enlace de van der Waals se puede analizar mediante otra imagen física simple: modelar el movimiento de un electrón alrededor de su núcleo mediante un oscilador armónico simple tridimensional con una energía potencial Va: donde me y ω son la masa y la frecuencia vibratoria del electrón, respectivamente.
Además, al introducir la polarización atómica, el potencial de van der Waals se puede simplificar aún más: donde es la constante de van der Waals que está relacionada con la polarizabilidad atómica.
Como resultado, la posición del plano de la imagen que representa la referencia para la coordenada espacial es diferente de la propia superficie del sustrato y está modificada por Z0.
Para la posición del plano de la imagen dinámica, disminuye al aumentar la función dieléctrica y suele ser del orden de 0,2 A.
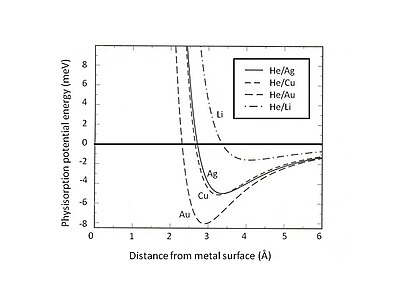
Se puede encontrar que la interacción débil de van der Waals conduce a pozos de energía atractivos poco profundos (<10 meV).
Ciertas características específicas del potencial de interacción entre los átomos dispersos y la superficie se pueden extraer analizando la distribución angular determinada experimentalmente y las secciones transversales de las partículas dispersas.
Desde 1980 se trabajaron dos teorías para explicar la adsorción y obtener ecuaciones que funcionen.
[6] Ambas teorías producen la misma ecuación para superficies planas:
donde "ads" significa "adsorbido", "m" significa "equivalencia de monocapa" y "vap" es una referencia a la presión de vapor del adsorbente líquido a la misma temperatura que la muestra sólida.
Las condiciones ultramicroporosas, microporosas y mesoporosas pueden analizarse utilizando esta técnica.
Las desviaciones estándar típicas para ajustes de isotermas completos, incluidas las muestras porosas, suelen ser inferiores al 2%.
En la figura 3 se muestra un ajuste típico a buenos datos en una superficie no porosa homogénea.