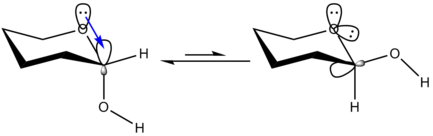
Efecto anomérico
Por ejemplo, una molécula pequeña que exhiba el efecto anomérico y suele ser usada para estudios teóricos es el dimetoximetano.La explicación más simple es que la configuración ecuatorial tiene los dipolos de ambos heteroátomos parcialmente alineados, y por tanto repeliéndose mutuamente.En contraste, la configuración axial tiene los dipolos aproximadamente opuesto, representando entonces un estado de menor energía y más estable.Cuando el átomo exocíclico (en un azúcar) lleva un par libre de electrones, debe haber una interacción similar entre el par de electrones no compartido (del átomo exocíclico) y el orbital σ* del enlace C-O anular.Sin embargo, es bien conocido que cuando el átomo exocíclico lleva pares libres de electrones, el efecto anomérico es máximo.