Descubrimiento del neutrón
Ernest Rutherford ideó a principios del siglo XX un modelo rudimentario del átomo,[1]: 188 [2] basado en el experimento de la lámina de oro bombardeada con partículas alfa, realizado por sus colaboradores Hans Geiger y Ernest Marsden.
En este modelo, los átomos tenían su masa y su carga eléctrica positiva concentrados en un núcleo muy pequeño.
[10] A principios del siglo XX, el intenso debate sobre la existencia de los átomos aún no se había resuelto.
Dos años más tarde, Paul Ulrich Villard descubrió los rayos gamma, que poseían un poder de penetración aún mayor.
Simultáneamente con el trabajo de Rutherford, Geiger y Marsden, el radioquímico Frederick Soddy estaba estudiando en la Universidad de Glasgow problemas relacionados con la química en materiales radiactivos, y ya había trabajado con Rutherford sobre la radioactividad en la Universidad McGill.
Además, aquellos radioelementos que residen en los mismos lugares del sistema periódico son químicamente idénticos.
[1]: 228 En aquel momento, no se sabía que las posiciones de los elementos en la tabla periódica tuvieran ningún significado físico.
[26]: 87 El resultado de Moseley, según la explicación posterior de Bohr, no solo estableció el número atómico como una cantidad experimental mensurable, sino que también le dio un significado físico como carga positiva en el núcleo atómico.
Rutherford, Bohr y otros lo citaron como un avance crítico en la comprensión de la naturaleza del núcleo atómico.
Como señaló Rutherford en ese momento, "Tenemos fuertes razones para creer que los núcleos de los átomos contienen electrones así como cuerpos cargados positivamente...",[32]: 376–377 es decir, se sabía que la radiación beta eran electrones emitidos desde el núcleo.
[35][36][37][5]: 6 Por esa misma época se adoptó la palabra protón para referirse al núcleo de hidrógeno.
[1]: 398 [35] Rutherford y Chadwick comenzaron inmediatamente un programa experimental en los Laboratorios Cavendish en Cambridge para buscar el neutrón.
Ralph Kronig señaló en 1926 que la transición hiperfina observada de los espectros atómicos era inconsistente con la hipótesis protón-electrón.
[49]: 511 En 1927, Charles Ellis y W. Wooster midieron en el Laboratorio Cavendish las energías de los electrones en desintegración ß.
Se inventaron muchas teorías para explicar por qué los argumentos anteriores podían estar equivocados.
[43]: 23 En 1930, Walther Bothe y su colaborador Herbert Becker, descubrieron en Gießen (Alemania), que si las partículas alfa energéticas emitidas por el polonio caían sobre ciertos elementos ligeros, específicamente berilio (94Be), boro (115B) o litio (73Li), se emitía una radiación inusualmente penetrante.
El polonio es altamente radiactivo, produce radiación alfa energética y se usaba comúnmente para experimentos de dispersión en ese momento.
[52][53][41] Dos años más tarde, Irène Joliot-Curie y Frédéric Joliot-Curie en París demostraron que si esta radiación desconocida incidía sobre parafina o cualquier otro compuesto que contenía hidrógeno, expulsaba protones de muy alta energía (5 MeV).
[5]: §1.3.1 En Roma, el joven físico Ettore Majorana declaró que la manera en que la nueva radiación interactuaba con los protones requerían una partícula neutra tan pesada como un protón, pero se negó a publicar su resultado a pesar del apoyo de Enrico Fermi.
Pollard ya habían realizado experimentos sobre la desintegración de elementos ligeros utilizando radiación alfa del polonio.
Chadwick repitió la creación de la radiación utilizando berilio para absorber las partículas alfa: 9Be + 4He (α) → 12C + 1n.
Dados los problemas del modelo protón-electrón,[43][64] rápidamente se aceptó que el núcleo atómico está compuesto de protones y de neutrones, aunque la naturaleza precisa del neutrón inicialmente no estaba clara.
En particular, supuso que el neutrón era un compuesto de protón-electrón, para lo cual no existía explicación en la mecánica cuántica.
Ninguna teoría existente podía explicar cómo los electrones, o positrones,[74] era posible que emanasen del núcleo.
La teoría básica de la desintegración beta propuesta por Fermi fue la primera en mostrar cómo se podían crear y destruir partículas.
Estableció una teoría básica general para la interacción de partículas mediante fuerzas fuertes o débiles.
[70][81] Tal como planteó Chadwick en su Lectura Bakeriana de 1933, la cuestión principal era la masa del neutrón en relación con el protón.
Utilizaron los rayos gamma de 2,6 MeV del talio-208 (208Tl) (entonces conocido como torio C") para fotodesintegrar el deuterón:[83] En esta reacción, el protón y el neutrón resultantes tienen aproximadamente la misma energía cinética, ya que sus masas son aproximadamente iguales.
[79] El descubrimiento del neutrón proporcionó inmediatamente a los científicos una nueva herramienta para investigar las propiedades de los núcleos atómicos.
[98] Frédéric Joliot-Curie y su equipo demostraron que este fenómeno era una reacción nuclear en cadena en marzo de 1939.

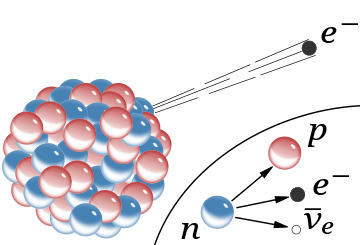
El detalle insertado muestra la desintegración beta de un neutrón libre tal como se entiende hoy: en este proceso se crean un protón, un electrón y un antineutrino