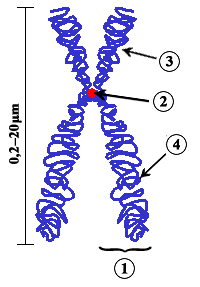
Centrómero
Es la zona por la que el cromosoma interacciona con los microtúbulos del huso acromático desde profase hasta anafase, tanto en mitosis como en meiosis, y es responsable de realizar y regular los movimientos cromosómicos que tienen lugar durante estas fases.
Los nuevos avances nos han permitido caracterizar estas secuencias, cuales constituyen 189.9 megabases de nuestro genoma.
Este fenómeno se denomina "variegación por efecto de posición" (PEV, por Position Effect Variegation).
El centrómero tiene un comportamiento diferente durante la anafase mitótica y la anafase-I de la meiosis, de manera que durante la anafase mitótica las cromátidas hermanas se separan a polos opuestos (segregación anfitélica) mientras que en la anafase-I de la meiosis lo que se separa a polos opuestos son los cromosomas homólogos completos, cada uno constituido por dos cromátidas (segregación sintélica).
Además, el cromosoma Y a veces es considerado submetacéntrico aunque otros lo describen como acrocéntrico sin satélite.
Aun cuando el concepto es ampliamente aceptado y distribuido entre la comunidad científica,[6] realmente, un cromosoma telocéntrico como tal no existe.
De hecho, el acortamiento del telomero o su ausencia total causa inestabilidad en los cromosomas y la consecuente Translocación robertsoniana.
[7] Por tanto, el término telocéntrico es incorrecto y debe considerarse el término subtelocéntrico, el cual implica que el telómero se ubica al final así no sea visible y que el centrómero esta después invariablemente.
[8] Por tanto, en esta región los factores críticos para una segregación cromosómica correcta son el contenido en A-T y la longitud del ADN, más que la secuencia de nucleótidos, quizás porque influyen en la conformación del ADN centromérico.
[12] Sin embargo, la unión de CBF3 al ADN centromérico in vivo no requiere Cse4p.
[14] Esta proteína también se une a microtúbulos in vitro, y parece ser importante en la transición G1/S del ciclo celular, ya que la eliminación de CBF5p bloquea la división celular antes de que ocurra la replicación del ADN.
[17] Mif2p es una proteína esencial en levaduras, similar a CENP-C de metazoos, cuya eliminación produce fallos en la segregación cromosómica, retraso en mitosis y microtúbulos con morfología aberrante.
[26] Las regiones K y el núcleo central son las dianas de los mecanismos epigenéticos que afectan a la función del centrómero in vivo.
[29] En Drosophila melanogaster la secuencia AATAACATAG está repetida en tándem en las regiones próximas al centrómero.
El ADN satélite también se denomina α-satélite y es uno de los componentes del genoma eucariótico que evoluciona más rápidamente.
[32] La estrecha variación en longitud de la unidad que se repite en el ADN satélite corresponde aproximadamente al rango de longitud del ADN que rodea a un nucleosoma, y repeticiones más largas, como las que se encuentran en los centrómeros del cerdo (340 pb) corresponden aproximadamente a la longitud de dos nucleosomas.
Estas unidades mínimas (denominadas monómeros) se encuentran normalmente asociadas de forma cabeza-cola.
En las regiones centroméricas del núcleo funcional, el ADN satélite se organiza en una unidad repetida que consta de múltiples monómeros.
La unidad multimonomérica se repite a su vez muchas veces, generando un vector (array) de nivel superior.
CENP-A presenta algunas características que la diferencian de la histona H3 normal, como una cola NH2-terminal no canónica, un plegamiento divergente y una región lazo 1 más largo.
A pesar de no ser esencial en humanos, CENP-B está conservada a través de varios phyla y en S. pombe se encuentran tres homólogos que sí son esenciales para la viabilidad celular.
Por todo ello, se ha sugerido que en el núcleo de esta rápida evolución existe un conflicto genético en funcionamiento.
[39] Esta observación es anti-intuitiva, porque el vector de ADN satélite centromérico es el centrómero funcional y está sometido a una fuerte presión selectiva, mientras que las regiones de heterocromatina pericéntrica no lo están.
[40] Como contrapartida, mientras que la deriva centromérica puede generar una ventaja selectiva en la meiosis femenina, puede producir defectos en la meiosis masculina, pues en este caso un centrómero mutado se apareará con otro normal, generándose una diferencia de tensión que puede activar el checkpoint de mitosis, provocando la muerte celular y con ello una disminución de la fertilidad masculina.
[1] Si este proceso tiene lugar en dos poblaciones aisladas de la misma especie, las configuraciones del ADN satélite y CENP-A divergirán rápidamente.
En cada población, CENP-A evolucionará para suprimir los efectos deletéreos de la evolución del ADN satélite.
[32] Por otra parte, gracias a comparaciones de los centrómeros en los cromosomas X, se han visto variaciones epigenéticas y estructurales en estas regiones.
Cabe destacar que las αSat se pueden originar del mismo, o de diferentes vectores.