Ácidos quirales de Lewis
En tales reacciones, la síntesis favorece la formación de un enantiómero o diastereómero específico.
[4] Las reacciones de Diels-Alder ocurren entre un dieno conjugado y un alqueno (comúnmente conocido como el dienófilo).
Además, las interacciones orbitales secundarias aumentadas se han postulado como la fuente de diastereoselección endo mejorada.
La adición de un CLA activa selectivamente un componente de la reacción (el dieno o el dienófilo) al tiempo que proporciona un entorno estereodefinido que permite una enantioselectividad única.
El ligando quiral se recupera cuantitativamente mediante cromatografía en gel de sílice.
Hisashi Yamamoto y sus colaboradores han desarrollado un práctico catalizador Diels-Alder para dienófilos aldehídos.
El complejo quiral (aciloxi) borano (CAB) es eficaz para catalizar varias reacciones de aldehído Diels-Alder.
Los experimentos espectroscópicos de RMN indicaron la proximidad del aldehído y el anillo arilo.
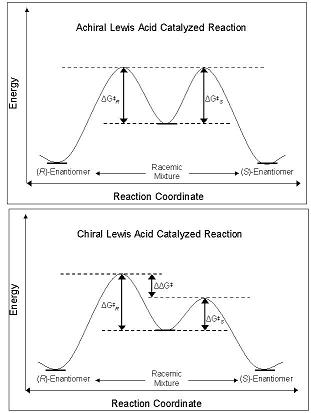
Las estructuras de transición para las reacciones con los enantiómeros catalizadores tanto R como S se muestran a continuación.
Los ácidos lewis quirales también han demostrado ser útiles en la reacción de eno.
Cuando es catalizada por un ácido lequítico aquiral, la reacción normalmente proporciona una buena diastereoselectividad.
demostró el acoplamiento regio y diastereoselectivo de 1,3- dienos con aldehídos.