En química , un trímero ( / ˈt r aɪ m ər / ; del griego antiguo tri- 'tres' y -mer 'partes') es una molécula o anión poliatómico formado por combinación o asociación de tres moléculas o iones de la misma sustancia. En la jerga técnica, un trímero es una especie de oligómero derivado de tres precursores idénticos a menudo en competencia con la polimerización .

En 1866, Marcellin Berthelot informó del primer ejemplo de ciclotrimerización , la conversión de acetileno en benceno . [1] Este proceso se comercializó:
Las 1,3,5-triazinas simétricas se preparan mediante trimerización de ciertos nitrilos como el cloruro de cianógeno .
El cloruro de cianógeno y el bromuro de cianógeno trimerizan a temperaturas elevadas sobre un catalizador de carbono. [1] El cloruro da cloruro cianúrico :
El bromuro tiene una vida útil más prolongada cuando se refrigera. Al igual que el cloruro, sufre una trimerización exotérmica para formar bromuro cianúrico . Esta reacción es catalizada por trazas de bromo, sales metálicas, ácidos y bases. [2] Por esta razón, los experimentadores evitan las muestras de color marrón. [3]
Una vía industrial para obtener ácido cianúrico implica la descomposición térmica de la urea , con liberación de amoníaco. La conversión comienza aproximadamente a 175 °C: [4]
La síntesis endotérmica de melamina se puede entender en dos pasos.
Primero, la urea se descompone en ácido ciánico y amoníaco en una reacción endotérmica:
Luego, en el segundo paso, el ácido cianhídrico se polimeriza para formar ácido cianúrico, que se condensa con el amoníaco liberado en el primer paso para liberar melamina y agua.
Esta agua luego reacciona con el ácido cianico presente, lo que ayuda a impulsar la reacción de trimerización, generando dióxido de carbono y amoníaco.
En total, el segundo paso es exotérmico :
pero el proceso general es endotérmico .
El isómero 1,5,9-trans-trans-cis del ciclododecatrieno , que tiene cierta importancia industrial, se obtiene por ciclotrimerización de butadieno con tetracloruro de titanio y un cocatalizador de organoaluminio : [5]
La ciclotrimerización del formaldehído produce 1,3,5-trioxano :
El 1,3,5-tritiano es el trímero cíclico de la especie inestable tioformaldehído . Este heterociclo consiste en un anillo de seis miembros con puentes de metileno y grupos tioéter alternados. Se prepara mediante el tratamiento del formaldehído con sulfuro de hidrógeno . [6]
Tres moléculas de acetaldehído se condensan para formar paraldehído , un trímero cíclico que contiene enlaces simples CO.
La trimerización de la acetona mediante condensación aldólica mediante catálisis y deshidratación con ácido sulfúrico produce mesitileno [7].
El dimetilsilanodiol se deshidrata para formar un trímero de Me 2 SiO y polidimetilsiloxano . La reacción ilustra la competencia entre trimerización y polimerización. El polímero y el trímero se derivan formalmente de la hipotética sila-cetona Me 2 Si=O , aunque esta especie no es un intermediario.
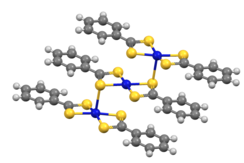
Los complejos de ditiobenzoato [M(S 2 CPh) 2 ] cristalizan como trímeros (M = Ni, Pd). [8]
{{cite web}}: CS1 maint: copia archivada como título ( enlace )