La cavidad pleural , espacio pleural o espacio intrapleural es el espacio potencial entre las pleuras del saco pleural que rodea cada pulmón . En la cavidad pleural se mantiene una pequeña cantidad de líquido pleural seroso para permitir la lubricación entre las membranas y también para crear un gradiente de presión . [1]
La membrana serosa que cubre la superficie del pulmón es la pleura visceral y está separada de la membrana externa, la pleura parietal , solo por la película de líquido pleural en la cavidad pleural. La pleura visceral sigue las fisuras del pulmón y la raíz de las estructuras pulmonares . La pleura parietal está unida al mediastino , la superficie superior del diafragma y al interior de la caja torácica . [1]
En los seres humanos , los pulmones izquierdo y derecho están completamente separados por el mediastino y no existe comunicación entre sus cavidades pleurales. Por lo tanto, en casos de neumotórax unilateral , el pulmón contralateral seguirá funcionando normalmente a menos que haya un neumotórax a tensión , que puede desplazar el mediastino y la tráquea , doblar los grandes vasos y, finalmente, colapsar la circulación cardiopulmonar contralateral.
La pleura visceral recibe su irrigación sanguínea de los capilares parenquimatosos del pulmón subyacente, que reciben aportes tanto de la circulación pulmonar como de la bronquial . La pleura parietal recibe su irrigación sanguínea de cualquier estructura subyacente a ella, que puede ramificarse desde la aorta ( arterias intercostal , frénica superior y frénica inferior ), la torácica interna ( ramas pericardiacofrénica , intercostal anterior y musculofrénica ) o su anastomosis .
Las pleuras viscerales están inervadas por nervios esplácnicos del plexo pulmonar , que también inerva los pulmones y los bronquios. Sin embargo, las pleuras parietales, al igual que sus irrigaciones sanguíneas, reciben irrigación nerviosa de diferentes fuentes. Las pleuras costales (incluida la porción que sobresale por encima de la entrada torácica ) y la periferia de las pleuras diafragmáticas están inervadas por los nervios intercostales de la caja torácica circundante , que se ramifica desde la médula espinal torácica T1-T12 . Las pleuras mediastínicas y las porciones centrales de las pleuras diafragmáticas están inervadas por los nervios frénicos , que se ramifican desde la médula cervical C3-C5 . Solo las pleuras parietales contienen nervios somatosensoriales y son capaces de percibir el dolor .
Durante la tercera semana de embriogénesis , cada mesodermo lateral se divide en dos capas. La capa dorsal une los somitas y el ectodermo suprayacentes para formar la somatopleura ; y la capa ventral se une al endodermo subyacente para formar la esplacnopleura . [2] La dehiscencia de estas dos capas crea una cavidad llena de líquido a cada lado, y con el repliegue ventral y la posterior fusión de la línea media del disco trilaminar , se forma un par de celomas intraembrionarios anterolateralmente alrededor del tubo intestinal durante la cuarta semana, con la esplacnopleura en la pared de la cavidad interna y la somatopleura en la pared de la cavidad externa.
El extremo craneal de los celomas intraembrionarios se fusiona tempranamente para formar una sola cavidad, que rota invertidamente y aparentemente desciende frente al tórax, y luego es invadida por el corazón primordial en crecimiento como la cavidad pericárdica . Las porciones caudales de los celomas se fusionan más tarde debajo de la vena umbilical para convertirse en la cavidad peritoneal más grande , separada de la cavidad pericárdica por el tabique transversal . Las dos cavidades se comunican a través de un par delgado de celomas remanentes adyacentes al intestino anterior superior llamado canal pericardioperitoneal . Durante la quinta semana, los brotes pulmonares en desarrollo comienzan a invaginarse en estos canales, creando un par de cavidades agrandadas que invaden los somitas circundantes y desplazan aún más el tabique transversal caudalmente, es decir, las cavidades pleurales. Los mesotelios empujados hacia afuera por los pulmones en desarrollo surgen de la esplacnopleura y se convierten en las pleuras viscerales ; Mientras que las otras superficies mesoteliales de las cavidades pleurales surgen de la somatopleura y se convierten en las pleuras parietales .
El tejido que separa las cavidades pleurales recién formadas de la cavidad pericárdica se conoce como membranas pericardiopleurales , que luego se convierten en las paredes laterales del pericardio fibroso . El tabique transversal y los somitas desplazados se fusionan para formar las membranas pleuroperitoneales , que separan las cavidades pleurales de la cavidad peritoneal y luego se convierten en el diafragma .
La cavidad pleural, con sus pleuras asociadas, ayuda al funcionamiento óptimo de los pulmones durante la respiración . La cavidad pleural también contiene líquido pleural, que actúa como lubricante y permite que las pleuras se deslicen sin esfuerzo una contra la otra durante los movimientos respiratorios . [3] La tensión superficial del líquido pleural también conduce a una estrecha aposición de las superficies pulmonares con la pared torácica. Esta relación permite una mayor inflación de los alvéolos durante la respiración. La cavidad pleural transmite los movimientos de los músculos de las costillas a los pulmones, particularmente durante la respiración pesada. Durante la inhalación, los intercostales externos se contraen, al igual que el diafragma . Esto provoca la expansión de la pared torácica, que aumenta el volumen de los pulmones. De este modo, se crea una presión negativa y se produce la inhalación.
El líquido pleural es un líquido seroso producido por la membrana serosa que cubre las pleuras normales. La mayor parte del líquido se produce por la exudación en la circulación parietal ( arterias intercostales ) a través del flujo masivo y se reabsorbe por el sistema linfático . [4] Por lo tanto, el líquido pleural se produce y se reabsorbe continuamente. La composición y el volumen están regulados por las células mesoteliales de la pleura. [5] En un humano normal de 70 kg, siempre hay unos pocos mililitros de líquido pleural dentro del espacio intrapleural. [6] Se pueden acumular mayores cantidades de líquido en el espacio pleural solo cuando la tasa de producción excede la tasa de reabsorción. Normalmente, la tasa de reabsorción aumenta como respuesta fisiológica a la acumulación de líquido, y la tasa de reabsorción aumenta hasta 40 veces la tasa normal antes de que se acumulen cantidades significativas de líquido dentro del espacio pleural. Por lo tanto, se requiere un aumento profundo en la producción de líquido pleural (o algún bloqueo del sistema linfático reabsorbente) para que el líquido se acumule en el espacio pleural.
El modelo de equilibrio hidrostático, el modelo de flujo viscoso y el modelo de equilibrio capilar son los tres modelos hipotéticos de circulación del líquido pleural. [7]
Según el modelo de flujo viscoso, el gradiente de presión intrapleural impulsa un flujo viscoso descendente de líquido pleural a lo largo de las superficies planas de las costillas. El modelo de equilibrio capilar establece que la alta presión pleural apical negativa conduce a un gradiente basal-apical en la superficie pleural mediastínica, lo que genera un flujo de líquido dirigido hacia arriba, hacia el ápice (ayudado por el corazón que late y la ventilación en los pulmones). De este modo, se produce la recirculación del líquido. Finalmente, hay un flujo transversal desde los márgenes hasta la parte plana de las costillas que completa la circulación del líquido. [8] [9]
La absorción ocurre en los vasos linfáticos a nivel de la pleura diafragmática. [10]
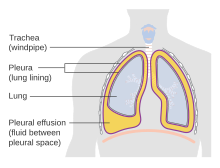
Una acumulación patológica de líquido pleural se denomina derrame pleural . Mecanismos:
Los derrames pleurales se clasifican como exudativos (con alto contenido de proteínas) o trasudativos (con bajo contenido de proteínas). Los derrames pleurales exudativos generalmente son causados por infecciones como neumonía (derrame pleural paraneumónico), neoplasias malignas, enfermedades granulomatosas como tuberculosis o coccidioidomicosis, enfermedades vasculares del colágeno y otros estados inflamatorios. Los derrames pleurales trasudativos ocurren en casos de insuficiencia cardíaca congestiva (ICC), cirrosis o síndrome nefrótico.
El derrame de líquido pleural localizado observado durante la embolia pulmonar ( EP ) probablemente sea resultado del aumento de la permeabilidad capilar debido a la liberación de citocinas o mediadores inflamatorios de los trombos ricos en plaquetas. [11]
Cuando se detecta una acumulación de líquido pleural, se requiere una evaluación citopatológica del líquido, así como una microscopía clínica, microbiología, estudios químicos, marcadores tumorales, determinación del pH y otras pruebas más esotéricas como herramientas de diagnóstico para determinar las causas de esta acumulación anormal. Incluso el aspecto macroscópico, el color, la claridad y el olor pueden ser herramientas útiles en el diagnóstico. La presencia de insuficiencia cardíaca, infección o malignidad dentro de la cavidad pleural son las causas más comunes que se pueden identificar utilizando este enfoque. [13]
La microscopía puede mostrar células residentes (células mesoteliales, células inflamatorias) de etiología benigna o maligna. Luego se realiza una evaluación por parte de un citopatólogo y se puede hacer un diagnóstico morfológico. Los neutrófilos son numerosos en el empiema pleural . Si predominan los linfocitos y las células mesoteliales son raras, esto es sugestivo de tuberculosis. Las células mesoteliales también pueden estar disminuidas en casos de pleuritis reumatoide o pleuritis pospleurodesis. Los eosinófilos se ven a menudo si un paciente se ha sometido recientemente a una punción de líquido pleural previa. Su importancia es limitada. [14]
Si hay células malignas, un patólogo puede realizar estudios adicionales, incluida inmunohistoquímica, para determinar la etiología de la malignidad.
Se pueden realizar estudios químicos que incluyan pH, proporción de proteínas en el líquido pleural y el suero, proporción de LDH, gravedad específica, niveles de colesterol y bilirrubina. Estos estudios pueden ayudar a aclarar la etiología de un derrame pleural (exudativo vs. trasudativo). La amilasa puede estar elevada en derrames pleurales relacionados con perforaciones gástricas/esofágicas, pancreatitis o neoplasias malignas. Los derrames pleurales se clasifican como exudativos (alto contenido de proteínas) o trasudativos (bajo contenido de proteínas).
A pesar de todas las pruebas diagnósticas disponibles en la actualidad, muchos derrames pleurales siguen siendo de origen idiopático . Si persisten síntomas graves, pueden ser necesarias técnicas más invasivas. A pesar de la falta de conocimiento de la causa del derrame, puede ser necesario un tratamiento para aliviar el síntoma más común, la disnea , ya que puede ser bastante incapacitante. La toracoscopia se ha convertido en el pilar de los procedimientos invasivos, ya que la biopsia pleural cerrada ha caído en desuso.
Las enfermedades de la cavidad pleural incluyen: