La senecionina es un alcaloide pirrolizidínico tóxico aislado de varias fuentes botánicas. Toma su nombre del género Senecio y es producido por muchas plantas diferentes de ese género, incluida Jacobaea vulgaris ( Senecio jacobaea ). También se ha aislado de varias otras plantas, incluidas Brachyglottis repanda , Emilia , Erechtites hieraciifolius , Petasites , Syneilesis , Crotalaria , Caltha leptosepala y Castilleja . [1]
El compuesto es tóxico y su consumo puede provocar daños en el hígado, cáncer y alcaloidosis pirrolizidínica . Por ello, el consumo de plantas que lo producen ha provocado intoxicaciones , tanto en humanos como en animales. [2]
Al igual que otros alcaloides de pirrolizidina, la senecionina es tóxica cuando se ingiere. La molécula ingerida es una protoxina que se metaboliza a su forma activa. [3]
En grandes cantidades, la ingestión puede provocar enfermedades graves, incluidas convulsiones y la muerte. Los estudios en roedores han demostrado una DL50 de 65 mg/kg. [4] En cantidades más pequeñas, no letales, la ingestión puede provocar intoxicación , aunque los signos y síntomas clínicos pueden no presentarse hasta meses después de la exposición, según el nivel de exposición. [5]
La ingestión puede provocar daños tanto en el hígado como en el ADN .
El daño hepático tanto en la intoxicación aguda como crónica puede causar enfermedad venooclusiva hepática (VOS), cuyos signos y síntomas incluyen náuseas , vómitos , hepatomegalia y diarrea sanguinolenta . [5] Además, la intoxicación aguda puede causar necrosis hemorrágica e insuficiencia hepática , con signos y síntomas que incluyen pérdida de peso , ictericia , depresión , cambios de comportamiento y ascitis . También se puede observar dermatitis fotosensible . [5] Otros síntomas y manifestaciones de la exposición crónica incluyen debilidad , hipertensión portal y cirrosis . [5] [6]
La ingestión de senecionina también puede inducir daño al ADN. Aunque hay pocos casos, si es que hay alguno, de cánceres humanos directamente relacionados con la intoxicación por senecionina, los estudios con roedores han demostrado que es capaz de inducir la formación de tumores en el hígado, los pulmones , la piel , el cerebro , la médula espinal , el páncreas y el tracto gastrointestinal. [6]
El diagnóstico de toxicidad por senecionina se realiza en base a la historia clínica , el examen físico y la biopsia hepática . [5] Los hallazgos de laboratorio pueden incluir concentraciones elevadas de ácidos biliares , hiperbilirrubinemia , hipoproteinemia y pruebas de función hepática anormales . Sin embargo, se ha observado que los animales expuestos crónicamente pueden tener valores de laboratorio normales durante meses o años a pesar del daño hepático continuo. [7] Las anomalías histológicas en la biopsia incluyen megalocitosis, necrosis, fibrosis e hiperplasia biliar , similares a otras ingestiones hepatotóxicas y trastornos del sistema inmunológico . [5]
La senecionina también se ha evaluado como un agente antimicrobiano . Se ha demostrado que un cóctel de alcaloides de pirrolizidina que contiene senecionina es tóxico para los hongos Fusarium en concentraciones milimolares . [6]
Actualmente no se conocen medicamentos ni antídotos disponibles para tratar la intoxicación por senecionina. El tratamiento es de apoyo para permitir la regeneración del hígado , que puede incluir la administración de líquidos intravenosos (IV) para corregir la deshidratación y los desequilibrios electrolíticos , glucosa IV y el cuidado de las heridas con antibióticos si la dermatitis es un síntoma presente. [5] Además, se pueden utilizar infusiones de albúmina para reducir la ascitis. La prevención sigue siendo el mejor método para reducir las intoxicaciones por senecionina, lo que incluye evitar el consumo de plantas que contienen senecionina y el uso de pesticidas para matar las infestaciones de esas plantas. [5]
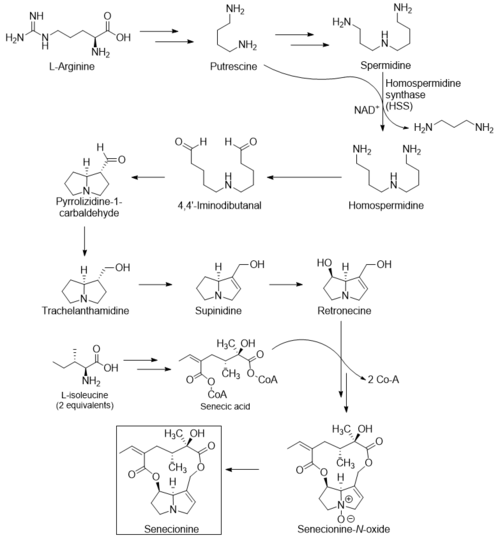
En las especies de Senecio , la biosíntesis de senecionina comienza a partir de L -arginina o L -ornitina . [8] Debido a que las plantas no tienen enzima descarboxilasa para L -ornitina, primero debe convertirse en L -arginina. Luego, la arginina se puede convertir fácilmente en putrescina y espermidina . A continuación, en una reacción dependiente de NAD+ catalizada por la homospermidina sintasa (HSS), un grupo aminopropilo de la putrescina se transfiere a la espermidina para formar homospermidina, liberando 1,3-diaminopropano (ver esquema de biosíntesis). [9] La HSS es la única enzima que ha sido definitivamente implicada en esta biosíntesis. [10]
La homospermidina se oxida y posteriormente se cicla para formar la cadena principal estereoespecífica de pirrolizidina . Luego, el aldehído se reduce y luego el núcleo de pirrolizidina se desatura y se hidroxila a través de mecanismos aún no determinados para formar retronecina . La retronecina se acila con ácido senécico, formado a partir de dos equivalentes de L -isoleucina . Este paso forma el N -óxido de senecionina, que posteriormente se reduce para producir senecionina. [10]
La senecionina tiene una estructura central de retronecina , una pirrolizida insaturada , con un anillo de lactona de 12 miembros unido al núcleo. [11] El átomo de nitrógeno en el núcleo de pirrolizidina es débilmente básico con un pKa estimado de 5,9. [12]
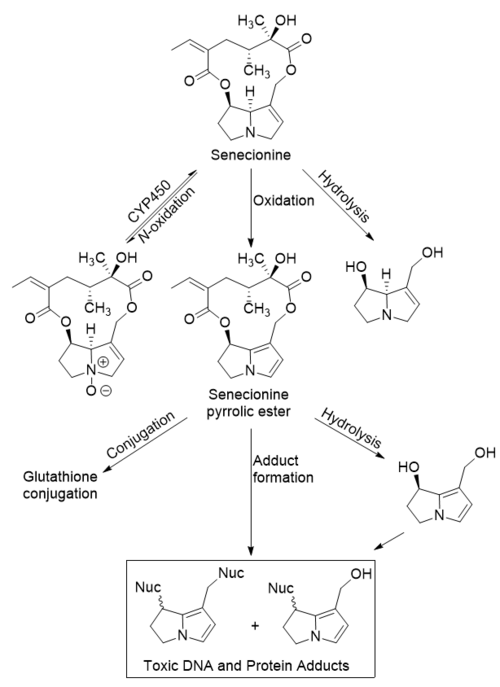
Después de la ingestión oral, la senecionina se absorbe en el tracto gastrointestinal . Cuando llega al hígado , se metaboliza a través de tres vías: N- oxidación , oxidación e hidrólisis del éster . La N- oxidación y la hidrólisis son vías de desintoxicación, y los productos de estas reacciones se conjugan y excretan por los riñones . Sin embargo, el N- óxido puede convertirse nuevamente en senecionina por las monooxigenasas del citocromo P-450 (CYP450). La oxidación de la senecionina a su respectiva deshidropirrolizidina es responsable de sus efectos tóxicos. [6]
En la vía tóxica, la 2-pirrolina en el núcleo se desatura mediante una reacción de oxidación para formar un éster pirrólico . Este metabolito aún puede eliminarse posteriormente si se conjuga con glutatión . Sin embargo, este metabolito es tóxico porque puede actuar como un electrófilo . Puede ser atacado por pares de bases de ADN o por residuos de aminoácidos en las proteínas del hígado , lo que resulta en la formación de aductos tóxicos , incluidos aductos reticulados entre pares de bases de ADN, proteínas del hígado o ambos. [13] Estos aductos pueden dañar el ADN, lo que lleva a genotoxicidad y carcinogénesis , y las enzimas hepáticas y los hepatocitos , lo que lleva a hepatotoxicidad . [6]
.jpg/440px-African_monarch_(Danaus_chrysippus_orientis).jpg)
Las plantas Senecio , la hierba cana y la hierba cana , son comunes y se encuentran en muchas regiones, más comúnmente como maleza en los terrenos cultivados. La hierba cana común es especialmente frecuente en Europa y ha sido responsable de envenenamiento y muertes de ganado cuando se consume. En África, Australia y los Estados Unidos, se ha descubierto que las especies de Crotalaria , hierbas parecidas a arbustos, son responsables de muertes de ganado similares. Los caballos parecen ser particularmente vulnerables al envenenamiento por senecionina a través de la ingestión de hierba cana. Los síntomas de envenenamiento en caballos (conocidos como "tambaleo del caballo") incluyen nerviosismo, bostezos, fatiga y marcha inestable. [17]
Algunas especies han evolucionado para aprovechar la senecionina para su propio beneficio. Las mariposas Danaus chrysippus pueden consumir de forma segura plantas que contienen senecionina, lo que hace que tengan un sabor muy amargo y, por lo tanto, desagradable para los depredadores. [15] Esta adaptación también está presente en los saltamontes del género Zonocerus [18] y las orugas de la polilla cinabrio . [19] Además, D. chrysippus puede convertir la senecionina en feromonas necesarias para un apareamiento exitoso . En consecuencia, los experimentos han demostrado que los machos privados de alcaloides de pirrolizidina, incluida la senecionina, en sus dietas tienen menos éxito en el apareamiento. [16]
Las hierbas que contienen senecionina se han utilizado en la medicina popular para el tratamiento de la diabetes mellitus , la hemorragia , la hipertensión y como estimulante uterino , a pesar de que no hay evidencia documentada de que sea eficaz para ninguna de esas afecciones y existe evidencia abrumadora de su toxicidad. [20]
En los seres humanos, el pan contaminado con hierba cana ha provocado intoxicaciones por senecionina (una afección conocida coloquialmente como "intoxicación por pan" en Sudáfrica ). En las Indias Occidentales , se han reportado intoxicaciones por el consumo de infusiones de hierbas hechas con Crotalaria . [17]
{{cite book}}: Mantenimiento de CS1: otros ( enlace ){{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )